紫心甘薯总黄酮对CCl4诱导的小鼠急性肝损伤的保护作用
2013-11-08叶淑雅李向荣邵盈盈
叶淑雅,李向荣,邵盈盈
(1.浙江大学城市学院医学院,浙江 杭州 310015;2.浙江大学医学院附属妇产科医院,浙江 杭州 310006;3.浙江大学医学院附属儿童医院,浙江 杭州 310006)
肝损伤过程大多与氧化应激和免疫有关,化学物质、药物、酒精等能直接或间接诱导肝细胞生物膜系统发生脂质过氧化,干扰细胞内的能量代谢,活化细胞死亡程序等,最终以转氨酶升高为表现形式造成不同程度的肝功能失常。CCl4诱导的肝损伤模型是评价肝损伤药物疗效的标准模型。CCl4是一种毒性很强的化学物质,进入体内后,经肝细胞微粒体细胞色素P-450 激活,生成活泼的三氯甲基自由基(·CCl3)、氯自由基(Cl-)以及三氯甲基过氧化自由基(CCl3O2),这些自由基攻击肝脏细胞膜上的磷脂分子,再与膜脂质和蛋白质大分子进行共价结合,影响蛋白质代谢,并且破坏膜结构和功能的完整性,胞浆钙离子浓度升高,最终导致肝细胞胞浆中的可溶性酶渗出,引起一系列血液生化指标的改变。
紫心甘薯系旋花科藤蔓性多年生草本植物甘薯(Ipomoera batatas)的干燥块茎,是甘薯的一个新品种。紫心甘薯不同于一般的甘薯品种,它含有大量的黄酮类化合物[1],紫心甘薯含有的黄酮类化合物稳定性高,对热、光、酸比较稳定[2-3]。近年来,国内外研究表明,紫心甘薯总黄酮提取物具有清除自由基、抗氧化、抗肿瘤、预防心脑血管疾病、调节血糖、抑菌等多种药理作用[4-12],但紫心甘薯总黄酮对肝脏损伤的保护作用未见报道。本实验通过研究紫心甘薯总黄酮提取物对四氯化碳诱导的急性肝损伤小鼠的影响,探讨其保护肝脏的作用及机制,为进一步开发和利用紫心甘薯提供理论和实验依据。
1 实验材料
1.1 实验动物 健康ICR 小鼠60 只,雌雄各半,体重18~20 g,清洁级,由浙江省医学科学院实验动物中心提供,合格证号SCXK(浙)2008-0033;实验过程中小鼠的饲养环境稳定,保持动物房温度(22±2)℃,相对湿度(60±5)%,灯光控制12 h 昼夜交替,自由摄食和饮水。
1.2 仪器与试剂 仪器:XS105 型电子天平(梅特勒-托利多仪器有限公司);HH-4 型数显恒温水浴锅(国华电器有限公司);DHG-9240A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);KQ-700DB 型数控超声波清洗器(昆山市超声仪器有限公司);台式高速冷冻离心机Allegra 64R(美国贝克曼库尔特实验有限公司);Tissue LyserⅡ-Qiegn 型匀浆机(RETSCH产品);XW80A 漩涡混合器(上海医科大学仪器厂);TECAN 型酶标分析仪(SUNRIS 产品)。
试剂:谷草转氨酶(AST)试剂盒、谷丙转氨酶(ALT)试剂盒、丙二醛(MDA)试剂盒、乳酸脱氢酶(LDH)试剂盒、超氧化物歧化酶(SOD)试剂盒、考马斯亮兰总蛋白定量测试盒等均购自南京建成生物工程研究所;联苯双酯滴丸(BPD)购自北京协和药厂(批号:10070104);其它试剂均为分析纯。
2 实验方法
2.1 紫心甘薯总黄酮提取物的制备 紫心甘薯烘干粉碎后,将粉末置于烧杯中,用20 倍量体积分数为70%的乙醇在60℃下超声提取35 min,固定超声电功率为560 W,超声频率为40 kHz,经超声提取后,抽滤,弃去固体残渣,滤液旋转蒸发后,挥干乙醇,浓缩备用,总黄酮含量为50 mg·ml-1。
2.2 动物分组及处理 ICR 小鼠60 只,动物房适应性喂养7 d 后,按体重随机分为6组,每组10 只,分为:空白组(正常组)、CCl4模型组、紫心甘薯总黄酮组(高、中、低剂量分别为400 mg·kg-1、200 mg·kg-1和100 mg·kg-1)和阳性对照组(联苯双酯150 mg·kg-1)。正常组与模型组给予等量体积的生理盐水灌胃,灌胃10 d。于末次给药后1 h,除正常对照组腹腔注射10 ml·kg-1的花生油外,其余各组均腹腔注射体积分数0.1%CCl4花生油溶液10 ml·kg-1,禁食,不禁水。
2.3 指标检测 16 h 后,摘取小鼠眼球取血约0.5 ml,置于1.5 ml 离心管中,3 000 r·min-1离心10 min,吸取上层血清,测定谷丙转氨酶、谷草转氨酶和乳酸脱氢酶。颈椎脱臼法处死小鼠,分别取肝脏和脾脏,用4℃生理盐水漂洗,滤纸吸干血水,称重,计算肝脏、脾脏指数。观察肝脏和脾脏的变化。取相同部位的肝组织0.2 g,放入离心管中,加预冷生理盐水1.8 ml,将肝组织剪碎,加入钢珠,开启组织研磨仪10 min,制成10 g·ml-1肝匀浆,检测肝组织中超氧化物歧化酶和丙二醛含量。血清和肝脏中AST、ALT、LDH、SOD、MDA 的测定,均按试剂盒说明书进行。
2.4 数据处理 采用SPSS 18.0 统计分析软件,所有数据均以平均数±标准差()表示,以one-way ANOVA 分析各组之间的差异;若具有统计学意义(P<0.05),则采用LSD 分析后检验进行统计分析,肝、脾指数与血清和肝脏中各指标的相关性采用Pearson correlation 相关分析,检验水准均为α=0.05。
3 实验结果
3.1 紫心甘薯总黄酮提取物对肝损伤小鼠脏器指数的结果 与空白组相比,模型组中脏器指数显著升高,其中肝脏指数有显著性差异(P<0.05),脾脏指数有极显著性差异(P<0.01),说明小鼠CCl4诱导的急性肝损伤模型建立成功;与模型组相比,紫心甘薯总黄酮400 mg·kg-1、200 mg·kg-1和100 mg·kg-1组中肝脏指数和脾脏指数均有显著降低(P<0.05);与空白组相比,紫心甘薯总黄酮100 mg·kg-1组小鼠的肝脏指数差异显著(P<0.05),紫心甘薯总黄酮400 mg·kg-1、200 mg·kg-1和100 mg·kg-1组小鼠的脾脏指数均有显著性差异(P<0.05)。结果见表1。
表1 紫心甘薯总黄酮对小鼠脏器指数的影响Table 1 Effect of PSPF on organ index in mice(,n=10)
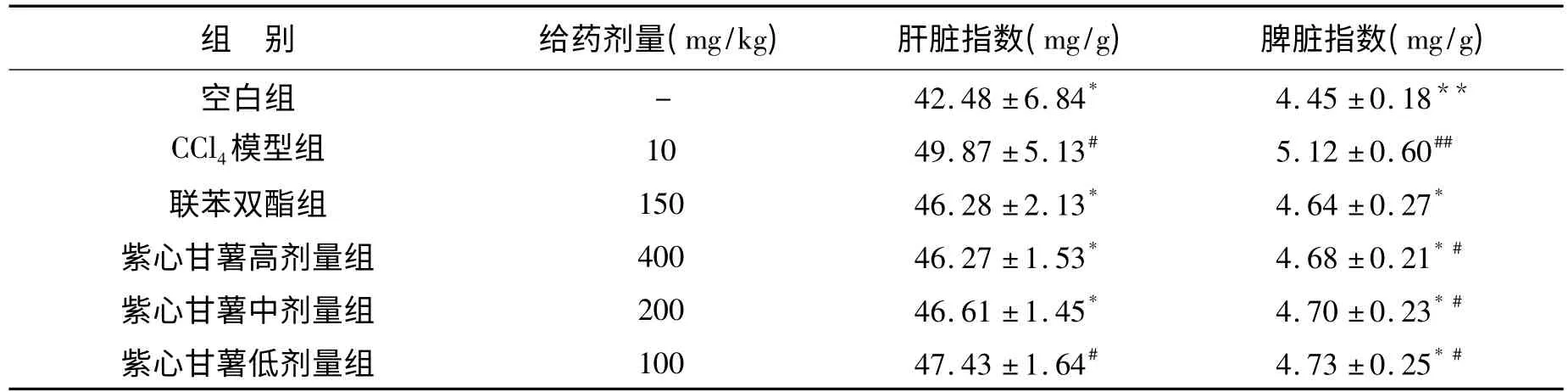
表1 紫心甘薯总黄酮对小鼠脏器指数的影响Table 1 Effect of PSPF on organ index in mice(,n=10)
#:与空白组比较,P<0.05;* :与模型组比较P<0.05;**:与模型组比较,P<0.01;**:与空白组比较,P<0.01.
3.2 紫心甘薯总黄酮提取物对肝损伤小鼠血清中ALT、AST 和LDH 的结果 实验数据经统计分析表明:与空白组相比,模型组小鼠血清中AST、ALT 和LDH 活性明显升高,其中AST 水平有显著性差异(P<0.05),ALT 和LDH 水平有极显著性差异(P<0.01),表明损伤程度显著,即小鼠CCl4诱导的急性肝损伤模型建立成功;与模型组比较,联苯双酯阳性药物组中AST的水平有显著性差异(P<0.05),ALT 和LDH的水平均有极显著性差异(P<0.01),紫心甘薯总黄酮400 mg·kg-1、200 mg·kg-1和100 mg·kg-1组中AST、ALT 的水平均有显著性差异(P<0.05),LDH 的水平均有极显著性差异(P<0.01);与空白组相比,紫心甘薯总黄酮200 mg·kg-1组小鼠血清中的LDH 的差异显著(P<0.05),紫心甘薯总黄酮100 mg·kg-1组小鼠血清中的LDH 水平有极显著性差异(P<0.01)。见表2。
表2 药物等对小鼠血清中AST、ALT 和LDH 的影响Table 2 Effect of drugs on the level of AST,ALT and LDH in serum(,n=10)

表2 药物等对小鼠血清中AST、ALT 和LDH 的影响Table 2 Effect of drugs on the level of AST,ALT and LDH in serum(,n=10)
#:与空白组比较,P<0.05;* :与模型组比较,P<0.05;**:与模型组比较,P<0.01;##:与空白组比较,P<0.01.
3.3 紫心甘薯总黄酮提取物对肝损伤小鼠肝组织中SOD 和MDA 含量的结果 与空白组相比,模型组的SOD 含量有极显著性降低(P<0.01),MDA 含量极显著升高(P<0.01),表明小鼠CCl4诱导的急性肝损伤模型建立成功;各给药组与模型组比较,联苯双酯阳性药物组及紫心甘薯总黄酮400 mg·kg-1、200 mg·kg-1和100 mg·kg-1组小鼠肝组织中SOD 的水平和MDA 的含量均有极显著性差异(P<0.01);与空白组相比,联苯双酯阳性药物组及紫心甘薯总黄酮400 mg·kg-1、200 mg·kg-1和100 mg·kg-1组小鼠肝组织中MDA 的含量均有极显著性差异(P<0.01),且紫心甘薯总黄酮400 mg·kg-1、200 mg·kg-1和100 mg·kg-1组SOD 含量和MDA 含量存在量效关系。见表3。
表3 药物等对小鼠肝组织中SOD 和MDA 的影响Table 3 Effect of drugs on the activity of SOD and the content of MDA in hepatic tissue(,n=10)

表3 药物等对小鼠肝组织中SOD 和MDA 的影响Table 3 Effect of drugs on the activity of SOD and the content of MDA in hepatic tissue(,n=10)
#:与空白组比较,P<0.05;* :与模型组比较,P<0.05;**:与模型组比较,P<0.01;##:与空白组比较,P<0.01.
4 讨论
本实验采用0.1% CCl4花生油溶液建立小鼠急性肝损伤模型,实验结果表明,预先给予紫心甘薯总黄酮提取物的小鼠,经CCl4造模后,与模型组相比肝重指数和脾重指数相对减少,血清中的AST 与ALT 活性显著降低,且LDH的水平也呈现下降,提示紫心甘薯总黄酮对CCl4诱导的肝细胞损伤有明显保护作用。与联苯双酯化学药相比较,紫心甘薯总黄酮具有无毒副作用的优点。
SOD 是细胞内主要的防御性抗氧化酶,能够清除自由基,并可抑制自由基启动的脂质过氧化反应,从而起到保护细胞膜结构和功能的完整作用。实验结果得出给药组小鼠肝组织匀浆中的SOD 活性高于模型组,且400 mg·kg-1组的增加程度较200 mg·kg-1和100 mg·kg-1组明显,呈现出正相关性,表明肝细胞的抗氧化能力增强,可以抵御肝细胞的氧化应激和过氧化,使肝细胞免受损伤。
MDA 是机体通过酶系统与非酶系统产生氧自由基,后者能攻击生物膜中的不饱和脂肪酸,引发脂质过氧化反应,并因此形成脂质过氧化物。MDA 是脂质过氧化反应过程中的最终产物,具有很强的生物毒性,可严重破坏细胞膜结构,导致细胞肿胀、坏死,其含量直接反映了组织氧化损伤的程度。实验中各给药组小鼠肝组织内MDA 含量明显低于模型组,表明紫心甘薯总黄酮可对抗CCl4所致的肝脏脂质过氧化反应,减轻CCl4对肝细胞的损害。并且400 mg·kg-1组MDA 含量的降低程度较200 mg·kg-1和100 mg·kg-1组明显,呈现出正相关性。
综上所述,本实验结果表明紫心甘薯总黄酮对CCl4诱导的肝损伤具有明显的保护作用,其机制可能与清除氧自由基和抗脂质过氧化有关。本实验研究结果为紫心甘薯开发成为肝损伤的辅助治疗药物提供一定的科学依据和实验基础。
[1]LU Guoquan,REN Yun,TANG Zhonghou,et al(陆国权,任 韵,唐忠厚,等).Flavonoid extraction and flavonoid content genotypic variationin sweetpotato storage roots[J].Journal of Zhejiang University:Agriculture & Life Science(浙江大学学报:农业与生命科学版),2005,31(5):541-544.(in Chinese)
[2]YE Xiaoli,LI Xuegang,LI Kunpei,et al(叶小利,李学刚,李坤培,等).Studies on the hue stability of anthocyaninin purple-sweet potato[J].Journal of Southwest China Normal University:Nature Science(西南师范大学学报:自然科学版),2003,28(5):725-729.(in Chinese)
[3]CHEN Yong,ZHANG Qing(陈 勇,张 晴).Study on the Adsorbing and Refining Colorant from Purple Sweet Potato with Macro-porous Resin[J].China Food Additives(中国食品添加剂),2001,1:6-9.(in Chinese)
[4]JIANG Huifang,LI Xiangrong,TANG Chao(姜慧芳,李向荣,唐 超).Effect of purple sweet potato flavonids on metabolism of glucose and lipids in diabetic rats[J].Journal of Zhejiang Uniersity(Medical Science)(浙江大学学报:医学版),2011,40(4):374-379.(in Chinese)
[5]WANG Shan,DENG Zeyuan,CAO Shuwen,et al(王杉,邓泽元,曹树稳,等).Studies on antioxidative functions of purple-fleshed sweetpotato anthocyanin in vivo[J].Acta Nutrimenta Sinica(营养学报),2005,27(3):245-248.(in Chinese)
[6]GAO Liwei,HUI Yuzhuo,LI Xiangrong(高丽威,回玉琢,李向荣).Study on flavonoids purification by macroporous resin and antioxidant activity of flavonoids in purple sweet potato[J].Chin Pharm J(中国药学杂志),2010,45(17):1323-1326.(in Chinese)
[7]KANO M,TAKAYANAGI T,HARADA K,et al.Antioxidative activity of anthocyanins from purple sweet potato,ipomoera batatas cultivar ayamurasaki[J].Bioscience,Biotechnology,and Biochemistry,2005,69(5):979-988.
[8]KOWALCZYK E,KRZESIÑSKI P,KURA M,et al.Anthocyanins in medicine[J].Pol J Pharmacol,2003,55(5):699-702.
[9]ZHANG Zhuo,ZHOU Bo(张卓,周波).Advances in apoptosis of tumor-cell induced by anthocyanidins [J].Journal of International Oncology(国际肿瘤学杂志),2006,33(11):831-835.(in Chinese)
[10]YE Xiao-li,LI Xue-gang,LI Kun-pei(叶小利,李学刚,李坤培).Effect of polysaccharide in purple sweet potato on the antitumor activity of cancer bearing mice [J].Journal of Southwest China Normal University:Natural Science Edition(西南师范大学学报:自然科学版),2005,30(2):332-336.(in Chinese)
[11]YUE Jing,FANG Hong-jun (岳 静,方宏筠).Preliminary study of purple sweet potato color invitro antibacterial activity [J].Liaoning Agricultural Science(辽宁农业科学),2005,(2):47-47.(in Chinese)
[12]JIANG Huifang,LI Xiangrong,CHEN Xiaole,et al(姜慧芳,李向荣,陈晓乐,等).Effect of Purple Sweet Potato Flavonids on Blood Glucose and Oxidative Stress in Diabetic Rats [J].Chinese Pharmaceutical Journal (中国药学杂志),2011,46(20):1570-1573.(in Chinese)
