利用SSR标记分析烤烟轮回选择群体的遗传多样性
2013-11-06焦芳婵高玉龙童治军肖炳光李永平
焦芳婵,高玉龙,童治军,肖炳光,李永平
(云南省烟草农业科学研究院,云南 玉溪 653100)
要解决育种材料遗传基础狭窄的突出问题,实现育种的新突破,除引进和拓宽种质来源外,必须重视和加强群体改良的研究。轮回选择是在遗传基础丰富的群体内,周期性反复的鉴定、选择、重组,增加数量性状有利等位基因的频率,从而定向改变群体的性状表现和配合力结构,使群体得到改良。并且能随着选择的进行从各轮次群体中分离出优良自交系。轮回选择已被有效地应用于大豆、玉米、小麦、水稻等各种作物的群体改良中,其中最成功的例子是美国玉米坚秆综合种(BSSS)群体的轮回选择,从1934年开始一直延续到现在,已成功地从不同轮次的改良群体中分离出B14、B37、B73和B84等在生产上广泛应用的优良自交系[1]。
我国烟草育种基础材料的改良和创新研究严重滞后,育成适于生产上种植的品种种质主要集中在极少数材料上,导致现有品种遗传基础十分狭窄。为了拓宽育种基础材料的遗传变异,必须重视和加强群体改良,轮回选择不失为有效的方法之一。美国从1972年开始在烟草上利用轮回选择进行品质和抗病性的改良,并已取得一定成效。Matzinger等[2]在一个双亲生物碱含量较低的双杂交组合,通过轮回选择提高了生物碱含量。Matzinger等[3]研究了一个遗传基础广泛的烟草群体的表型轮回选择的效果,分别进行了降低植株高度和增加叶片数,通过五轮两性状的选择,直接选择响应表现为线性,且并不因选择而降低遗传变异度,他们的结论是,表型轮回选择对自花授粉作物是很有用的育种方法。Gupton[4]进行了增加单叶重和降低生物碱含量的表现轮回选择。Tedford等[5]通过在综合群体内进行轮回选择,获得提高黑胫病抗性的种质材料。
分子标记可以直接反映种群的基因型,是研究种群遗传多样性的良好工具。尤其是SSR标记,由于其操作简单、结果稳定、共显性等特点,被广泛应用于种质资源的多样性研究鉴定。如刘胜传等[6]利用SSR标记分析了32份代表性烟草种质的遗传多样性,结果表明SSR分子标记技术能较好地从分子水平上揭示烟草种质资源遗传背景和亲缘关系。Moon等[7-9]利用SSR标记分别研究了烟草属中54个品种/系间的遗传多态性、美国近70年内所种植的117个烤烟品种和702份烟草种质资源的遗传多样性。本研究利用SSR标记对烤烟3个轮回世代群体进行分子水平上遗传变异的研究,对轮回群体的遗传变化进行评价,以期为进一步开展轮回选择提供参考。
1 材料与方法
1.1 材料
选用红大、K326、G28、云烟85、云烟317等16个品种(资源)配制64个组合,等量混合F2种子,产生基础群体。2004年开始对基础群体进行选择,并在选定的植株间进行成对杂交,从成对杂交组合中取同等数量的种子混集在一起构成C0群体,在此后两轮选择中进行相似的程序,每个世代配制组合60个左右。
2011年在云南省烟草农业科学研究院赵桅基地种植16个原始材料和C0、C1和C2 3个群体各450株左右,株行距50 cm×120 cm。
1.2 DNA 提取
每个群体于幼苗期随机取46株的鲜嫩叶片组织,利用QIAGEN(德国)DNeasy PlantMini Kit提取DNA。
1.3 分子标记分析
以16个原始材料对350对SSR引物[10]的扩增筛选,从中挑选条带清晰、多态性明显的引物在3个群体中进行扩增。
PCR 扩增总体积 10 μL,其中包括:l× PCR 缓冲液,MgCl21.5 mmol/L,dNTP 各 0.1 mmol/L,酶1 U,引物0.5 mmol/L,基因组DNA 20 ng。PCR反应程序按常规方法进行。PCR产物中加入2 μL 6×Loading Buffer,取3 μL混合液在6%聚丙烯酰胺胶上400 V恒电压下电泳1.5 h左右分离扩增产物,然后银染检测。
1.4 数据分析
每对SSR引物的扩增产物按同一迁移位置上条带在各个材料中的有(记为1)、无(记为0)和缺失(记为-)进行等位基因统计并建立数据矩阵。根据根井正利[11]提出的公式计算位点的基因杂合度:

(1)式中h代表杂合度,fi代表第i等位基因频率。各位点基因平均杂合度的计算公式为:

(2)式中r代表扩增位点,hj代表第j基因杂合度。依据Nei等[12]的公式计算两株间的遗传相似系数(Genetic similarity coefficient,GSij)和遗传距离(Genetic distance coefficient,GDij):

(3)式中Mij是指材料i和j之间共同的等位基因,(Mi+Mj)是2个材料所有的等位基因数目。统计每一群体内不同基因型数量及基因型频率,作为评价遗传多样性的另一个指标。
2 结果与分析
2.1 多态性引物筛选和不同群体多态位点比较
用16个原始亲本为材料,从350对SSR引物中筛选出27对扩增结果稳定,条带清晰,多态性明显的引物在C0、C1、C2 3个轮回群体中进行扩增。
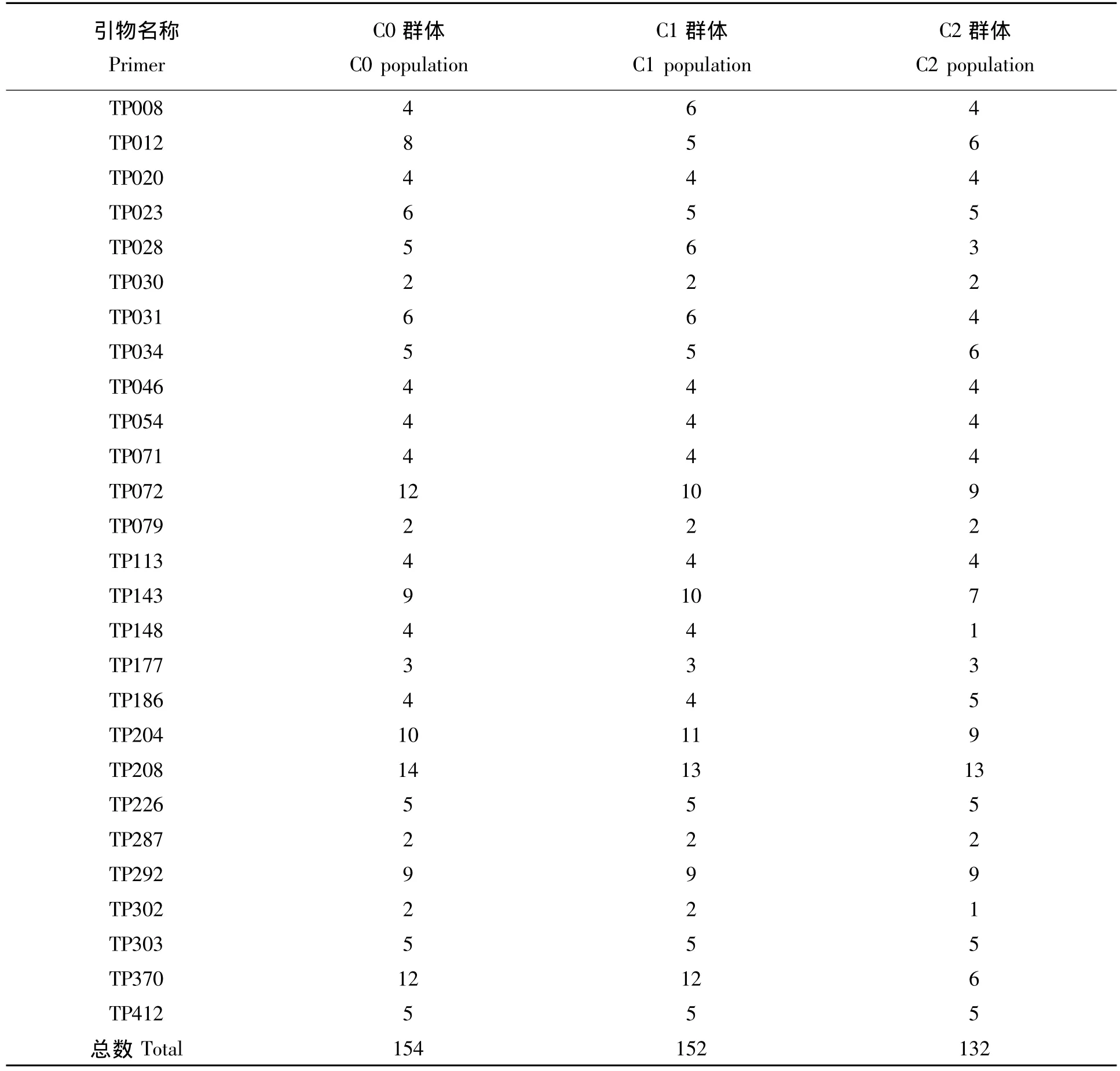
表1 3个群体多态位点比较Tab.1 Comparison of polymorphic loci in three populations
27对引物在3个群体中共扩增出161个等位位点,在C0、C1、C2 3个群体中,多态位点数分别为154,152,132。平均每个引物在3个群体中的多态性位点数分别为5.7,5.63和4.89,与C0群体相比,C2群体多态位点数略少(表1)。随着轮回选择的进行,大部分引物的多态性位点变少,如引物TP012在基础群体C0中有8个多态性位点,在C2群体中有6个多态性位点。此类引物还有TP023、TP028、TP031、TP072等。也有些引物在C2群体中的多态性位点多于在C0群体中的多态性,如TP034、TP186等。
2.2 群体间基因杂合度比较
群体基因杂合度可度量群体内某一基因位点杂合基因型所占的比例,群体基因平均杂合度则可表示某一植株个体整个基因组中杂合基因所占的比例,基因杂合度能有效反映群体的遗传组成变异[13]。本研究中同一对引物在不同群体中的基因杂合度都有差异,这表明同一位点在不同群体里的基因频率是不等的,从而导致各种基因型的种类和比例出现差异。C0群体、C1群体和C2群体的基因杂合度平均为:0.622、0.613和0.569(表2)。整体上来看,通过两轮的选择,改良群体基因杂合度要比其基础群体略小,但变化都很微弱。因此只要选择适度,改良后群体仍可以相对的保持原始群体的遗传变异范围。
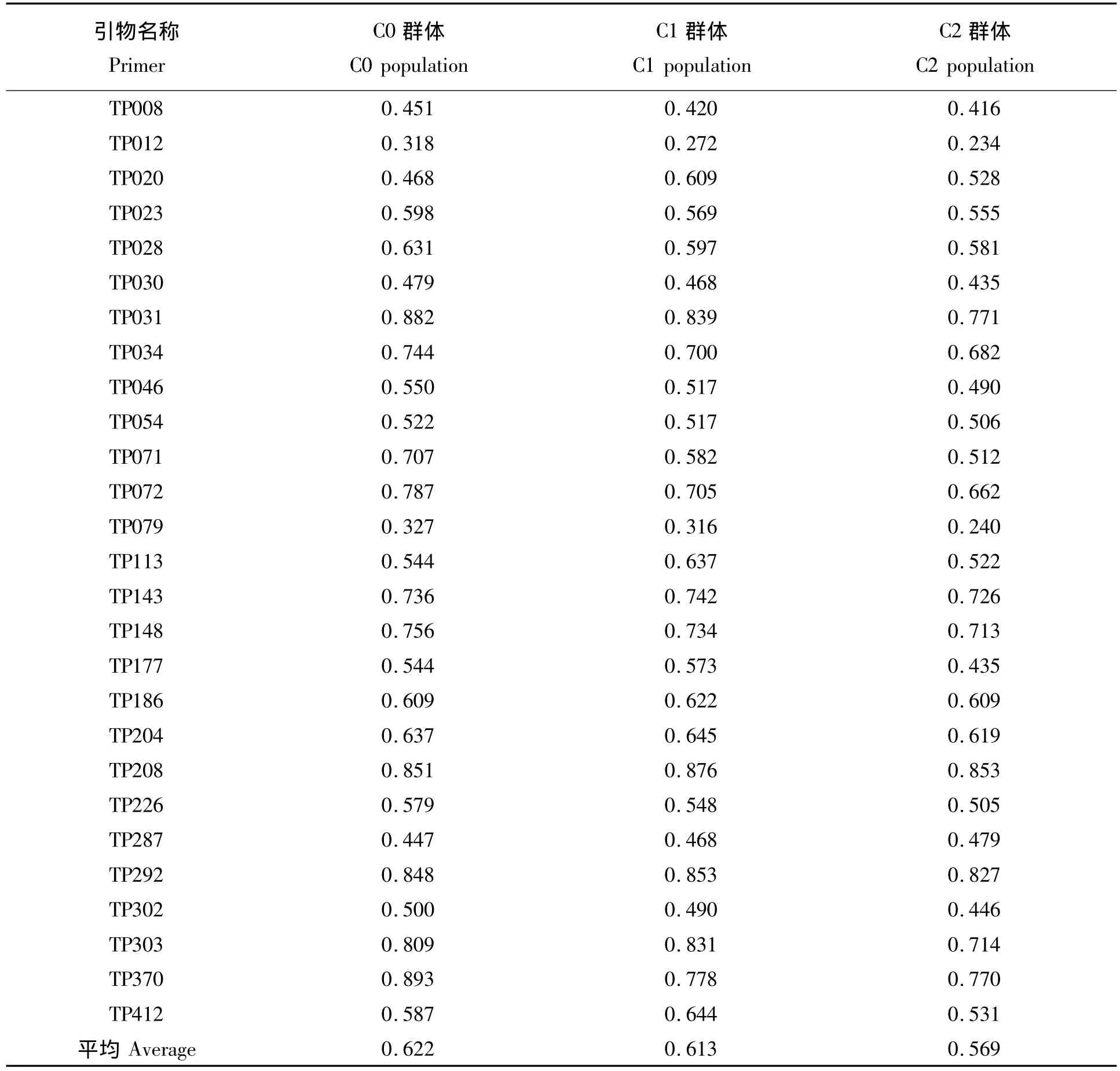
表2 27对引物扩增不同群体的基因杂合度Tab.2 Heterozygosity amplified by 27 pairs of primers in different populations
2.3 群体遗传距离比较
群体内单株间遗传距离是度量群体变异幅度的一个重要指标。根据27对引物计算的每个群体46个单株两两间的遗传距离,C0群体的单株间遗传距离变化范围为0.224 1~0.980 9,平均为0.563 2,标准差为0.182 8;C1群体的单株间遗传距离变化范围为0.259 8~0.977 3,平均为0.546 9,标准差为0.195 9;C2群体的单株间遗传距离变化范围为 0.279 4 ~0.880 9,平均为0.497 8,标准差为0.186 5(表3)。C1和C2群体与C0的平均遗传距离有所减小,但变化不明显,这可能是由于选择的作用减小了基础群体的遗传变异,使C1和C2群体中大部分个体两两间的遗传距离变小。
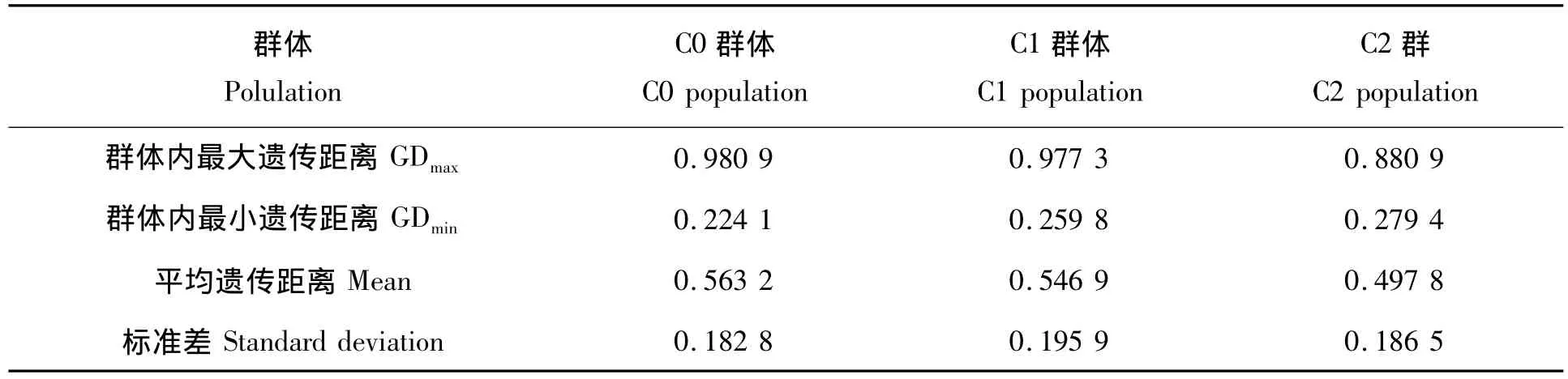
表3 27对引物扩增不同轮回群体的遗传距离Tab.3 Genetic distance amplified by 27pairs of primers in different populations
3 讨论
育种的成效在很大程度上取决于亲本材料的遗传多样性。常规的自交、选择方法能使纯合基因位点迅速固定,但也容易导致群体遗传基础变得狭窄。用轮回选择方法对遗传群体进行改良,是创造和保持群体多样性的一种重要方法。遗传群体内的基因变异可以用多态性位点比例和每个位点的平均杂合度来度量,遗传距离可以比较任意两个个体的差异,反映群体内个体间的异质性[13]。本文用27对SSR引物分析了烤烟C0、C1、C2 3个轮回群体的多态性位点、基因杂合度和群体内单株的遗传距离。整体上来看,通过两轮的选择,改良群体多态性位点数、基因杂合度略微变小及群体内单株的遗传距离比基础群体略小,但变化都很微弱。可见改良群体基本保持了基础群体的遗传多样性。建议利用轮回选择改良遗传群体时,注意选择压要适当,这样既能达到群体改良的目的,又能保持群体的遗传变异范围。
[1]Hallauer A R.Theory and practice of maize recurrent selection[M].Beijing:China Agricultural Press,1989:80 -83.
[2]Matzinger D F,Wernsman E A,Cockerham C C.Recurrent family selection and correlated response in Nicotiana tabacum L.I.‘Dixie Bright244’× ‘Coker139’[J],Crop science,1972,40:40 -43.
[3]Matzinger D F,Cockerham C C,Wernsman E A.Single character and index mass selection with random mating in a naturally self-fertilizing species.Proceedings of the International Conference on Quantitative Genetics[M].Edited by Pollak E,Kempthorne o,and Bailey T B,Iowa State University Press,Ames,Iowa,1977:503 -518.
[4]Gupton C L.Phenotypic recurrent selection for increased leaf weight and decreased alkaloid content of burley tobacco[J].Crop Science,1981,21:921 -925.
[5]Tedford E C,Nielsen M T.Recurrent selection for black shank resistance in a synthetic tobacco population[J].Tobacco International,1990,192(13):75 -77.
[6]刘胜传,刘仁祥,雷红梅,等.利用SSR标记分析部分烟草种质的遗传多样性[J].贵州农业科学,2009,37(7):1-3,9.
[7]Moon H S,Nicholson J S,Lewis R S.Use of transferable Nicotiana tabacum L.microsatellite markers for investigation genetic diversity in the genus Nicotiana[J].Genome,2008,51:547 -559.
[8]Moon H S,Nicholson J S,Heineman A,et al.Changes in genetic diversity of U.S.flue - cured tobacco germplasm over seven decades of cultivar development[J].Crop Science,2009,49:498 -508.
[9]Moon H S,Nifong J M,Nicholson J S,et al.Microsatellite - based analysis of tobacco(Nicotiana tabacum L.)genetic resources[J].Crop Science,2009,49:2149 - 2159.
[10]Tong Z J,Yang Z M,Chen X J,et al,Large - scale development of microsatellite markers in Nicotiana tabacum and construction of a genetic map of flue - cured tobacco[J].Plant Breeding,2012,131(5):674 -680.
[11]根井正利.分子群体遗传学与进化论[M].王家玉,译,北京:中国农业出版社,1983:79-82.
[12]Nei M,Li W H.Mathematical model for studying genetic variation in terms of restriction endonucleases[J].Poc Nat Acad Sci USA,1979,76(10):5256 -5273.
[13]黄素华,滕文涛,王玉娟,等.利用SSR标记分析玉米轮回选择群体的遗传多样性[J].遗传学报,2004,31(1):73-80.
