创伤合并γ射线照射后大鼠脾脏Treg/Th17平衡的变化及其意义
2013-11-02蔡金玲杜丽马琼潘秀颉杨晓云肖凤君崔玉芳
蔡金玲,杜丽,马琼,潘秀颉,杨晓云,肖凤君,崔玉芳
放射损伤复合创伤即放创复合伤(combined wound and radiation,CWR)多见于手术联合放射治疗、核事故以及战时核爆炸等情况,是难愈性创伤的代表性伤类。创面愈合延迟是此类创伤的显著特点,但其难愈机制尚未完全阐明。创伤后机体会产生过多炎性因子,且Th1/Th2平衡向Th2偏移,进而出现过度炎性反应和(或)免疫抑制状态[1]。已知脾脏等免疫组织对电离辐射具有高度敏感性,受到急性辐射损伤后可引起免疫功能受抑,严重影响机体功能恢复[2]。调节性T细胞(regulatory T cells,Tregs)/辅助性T细胞17(T helper 17 cells,Th17)平衡与多种疾病(如移植免疫、肿瘤免疫及自身免疫性疾病等)的发生发展密切相关[3-5],在维持机体免疫内环境稳态方面起重要作用,是现代免疫学关注的重点之一,然而其在放创复合伤中的变化及与伤口愈合的关系目前尚未见报道。据此,本实验观察了创伤合并5Gy ɣ射线全身照射大鼠脾脏Treg细胞和Th17细胞的变化以及Treg/Th17平衡的改变,以期从免疫学角度探索放创复合伤的难愈机制并为该类伤病的防治提供新思路。
1 材料与方法
1.1 实验分组及动物模型制备 清洁级雌性成年Wistar大鼠65只,体重200±20g,购于军事医学科学院实验动物中心。按体重随机分为正常对照组(正常组,n=5)、单纯创伤组(单伤组,n=30)和创伤+5Gy ɣ射线全身照射组(伤照组,n=30)。大鼠经1%戊巴比妥钠腹腔注射麻醉,备皮、局部消毒后,在背部胸段制备直径1.5cm圆形伤口2个,伤口间隔1.5cm,与脊柱平行,对称于两侧,深达皮下组织全层。
1.2 照射方式和剂量 伤照组大鼠在致伤后装入特制的有机玻璃盒内,采用军事医学科学院60Co ɣ射线源一次性全身照射5Gy,源靶距4m,吸收剂量率为160.02cGy/min,正常组和单伤组行假照射。伤照后大鼠单笼饲养于清洁级动物房。
1.3 检测指标及方法
1.3.1 伤口残留面积百分比 将伤照后1、3、7、14、21、28d时间点描记的伤口图像扫描输入Quantimet 970型自动图像分析仪(Cambridge公司,英国)进行面积分析[6]。以致伤时的伤口面积作为原面积,各时间点描记的伤口面积为伤口残留面积,计算伤口残留面积百分比(伤口残留面积/原伤口面积×100%)。
1.3.2 外周血白细胞及淋巴细胞计数 伤照后1、3、7、14、21、28d每组各取5只大鼠,留取尾静脉血,用日本F800型血细胞自动分析仪检测外周血白细胞及淋巴细胞计数。
1.3.3 Treg细胞亚群分析 伤照后1、3、7、14、21、28d每组各取5只大鼠,取脾脏冰浴制成细胞悬液(2×106/L),裂解红细胞,洗涤后加入适量抗大鼠CD4 FITC和CD25 APC抗体(eBioscience公司),4℃孵育30min;洗涤后每管加入1ml新鲜配制的固定液,4℃避光孵育30min;破膜后加入抗大鼠Foxp3 PE抗体(eBioscience公司),4℃避光孵育30min;洗涤重悬后,采用流式细胞仪(BD Calibur,美国BD公司)检测Treg细胞比例,结果采用FlowJo软件进行分析。
1.3.4 Th17细胞亚群分析 伤照后1、3、7、14、21、28d每组各取5只大鼠,取脾脏冰浴制成细胞悬液,红细胞裂解后用含10%胎牛血清的RPMI 1640调整细胞浓度至2×106/ml,然后接种于24孔板,每孔1ml,同时加入刺激剂和蛋白质转运抑制剂复合物(2μl/孔),置于37℃、5% CO2孵箱中培养5h;PBS洗涤后加入适量抗大鼠CD4 FITC抗体(eBioscience公司)4℃孵育30min;固定、破膜后加入抗小鼠IL-17A PE抗体(eBioscience公司),室温避光孵育30min;洗涤重悬后,采用流式细胞仪(BD Calibur,美国BD公司)检测Th17细胞比例,结果采用FlowJo软件进行分析。
1.4 统计学处理 数据结果以x±s表示,组间比较采用SPSS 13.0软件进行方差分析,进一步两两比较方差齐时采用LSD-t检验,方差不齐采用Dunnett's T3法。P<0.05为差异有统计学意义。
2 结 果
2.1 伤口残留面积百分比 伤口残留面积百分比与伤口愈合速度成反比,伤口残留面积百分比越大,表明伤口愈合速度越慢。伤照后1~3d伤照组伤口残留面积百分比与单伤组比较差异无统计学意义,而7~14d时明显高于单伤组(P<0.01),21d时单伤组伤口已基本愈合,而伤照组延迟至28d时才基本愈合(表1)。
表1 伤照后不同时间大鼠伤口残留面积百分比(%,,n=5)Tab. 1 Percentage of residual wound area of rats at different time points after exposure to combined wound and radiation(%, x±s, n=5)
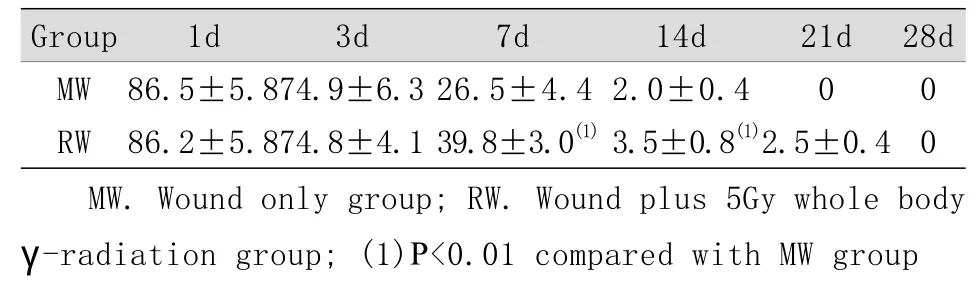
表1 伤照后不同时间大鼠伤口残留面积百分比(%,,n=5)Tab. 1 Percentage of residual wound area of rats at different time points after exposure to combined wound and radiation(%, x±s, n=5)
Group 1d 3d 7d 14d 21d 28d MW 86.5±5.874.9±6.3 26.5±4.4 2.0±0.4 0 0 RW 86.2±5.874.8±4.1 39.8±3.0(1)3.5±0.8(1)2.5±0.4 0 MW. Wound only group; RW. Wound plus 5Gy whole body γ-radiation group; (1)P<0.01 compared with MW group
2.2 外周血白细胞及淋巴细胞的变化 单伤组大鼠外周血白细胞及淋巴细胞计数在伤照后1~7d明显低于正常组,14~28d时与正常组比较差异无统计学意义。伤照组大鼠白细胞及淋巴细胞计数在伤照后1~14d明显低于正常组和单伤组,21~28d时白细胞计数仍明显低于正常组和单伤组,而淋巴细胞计数与单伤组比较未见明显差异,但仍明显低于正常组(图1)。
2.3 大鼠脾脏Treg细胞及Th17细胞的变化 伤照后各时间点单伤组大鼠脾脏Treg细胞及Th17细胞比例与正常组比较未见明显差异。伤照组Treg细胞比例仅在照后3d和7d高于正常组和单伤组(P<0.01),而Th17细胞于伤照后1d即显著增高(P<0.01),3d时升至最高,7~21d时仍显著高于正常组和单伤组,至28d才恢复至正常组和单伤组水平(图2)。

图1 伤照后不同时间大鼠外周血白细胞(A)及淋巴细胞(B)计数比较Fig. 1 Changes of peripheral white blood cell (A) and lymphocyte (B) counts in rats after exposure to combined wound and radiation
2.4 大鼠脾脏Treg/Th17比值的变化 伤照后各时间点单伤组大鼠脾脏Treg/Th17比值与正常组比较未见明显差异。伤照组大鼠Treg/Th17比值于伤照后1d即迅速降低(P<0.01),3d降至最低,直至21d时仍明显低于正常组和单伤组,28d时恢复至正常水平(图3)。
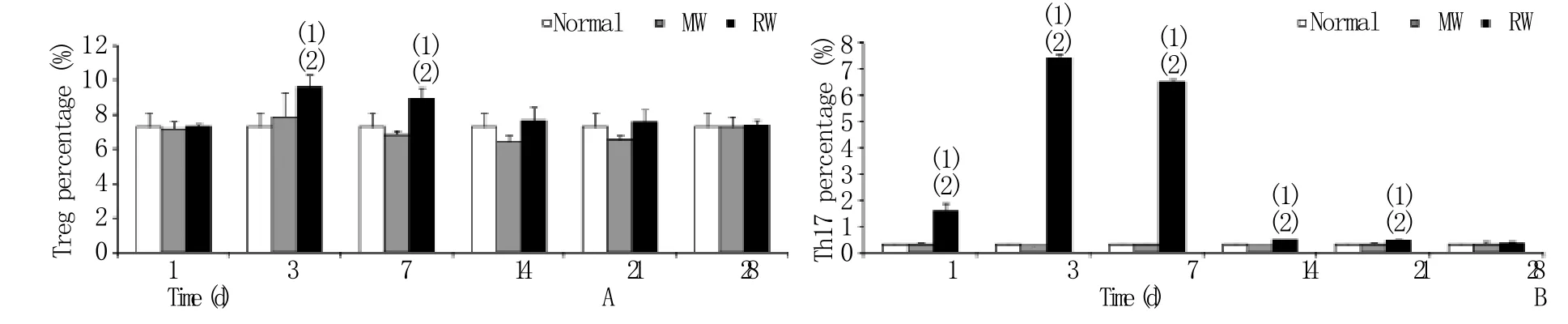
图2 伤照后不同时间大鼠脾脏Treg细胞(A)和Th17细胞(B)比例的变化Fig. 2 Changes of splenic Treg (A) and Th17 (B) percentages in rats after exposure to combined wound and radiation
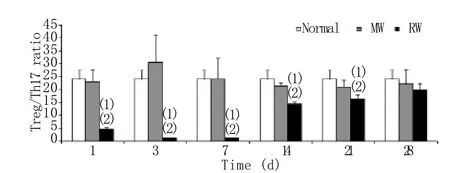
图3 伤照后不同时间大鼠脾脏Treg/Th17 比值的变化Fig. 3 Changes of splenic Treg/Th17 ratio in rats after combined wound and radiation
3 讨 论
创伤合并放射损伤后使创伤和放射损伤均加重,其创伤愈合过程也变得更为复杂。因此,放创复合伤不仅是创伤医学和放射医学重点关注的课题,也是临床救治的难题。虽然目前关于难愈性创伤的机制已有大量报道,但从整体免疫调节方面进行研究的报道较少。据此,本实验观察了创伤大鼠合并5Gy ɣ射线全身照射后Treg/Th17平衡的变化特点,期望能从免疫学角度为放创复合伤深层次损伤机制的研究提供依据。
本研究对伤口残留面积进行定量分析发现,5Gy全身照射后伤口愈合明显延迟,与单伤组比较延迟约1周,而伤照组外周血白细胞计数也一直处于较低水平,与以往实验结果一致[6],表明本实验建立的模型是成功的。Treg细胞是具有免疫抑制活性的T细胞亚群,其最主要的生物学功能是调节抗炎和致炎T细胞之间的平衡,它的免疫活性决定着炎症的方向和转归。Ni Choileain等[7]研究显示,烧伤后7d小鼠淋巴结中Treg细胞活性明显增加;Huang等[8]研究发现,严重烧伤患者外周血中Treg细胞明显增加,而且Treg细胞分泌的TGF-β和IL-10也显著增多。提示烧伤诱发的Treg活性和功能增强,可能有助于拮抗创伤后过度炎症反应的发生。本课题组前期观察到经6Gy ɣ射线照射后,小鼠脾脏等免疫组织Treg细胞比例明显增加[9-10],外周血IL-10和TGF-β抑制性细胞因子含量明显增高[10]。本实验结果显示,与正常组比较,单伤组脾脏中Treg细胞未见明显变化,而伤照后3~7d,伤照组大鼠脾脏中Treg细胞则显著高于正常组和单伤组。上述结果提示,辐射可导致Treg细胞比例增加,引起免疫调节异常,这可能是创伤愈合延迟的重要原因之一。
Th17细胞是近年发现的一种不同于Th1和Th2的CD4+效应性T细胞,主要分泌IL-17、IL-22等促炎因子。Th17可通过直接和间接作用引起炎性细胞浸润及组织损伤,因此在感染或损伤早期的炎症反应中具有至关重要的作用。Sasaki等[11]研究发现,烧伤后3h即可在小鼠烧伤皮肤组织中检测到高水平的IL-17和IL-22,Neely等[12]也发现烧伤后小鼠创面引流淋巴结中Th17比例及数量均显著增高,表明Th17参与了创伤局部早期的炎症反应。本实验结果显示,伤照组大鼠脾细胞中Th17显著高于单伤组。由于Th17急剧升高,导致大鼠脾脏Treg/Th17比值在伤照后的1~21d持续降低,出现Treg/Th17平衡模式向Th17反应漂移的现象。Treg与Th17在分化和功能上互相对抗,Treg/Th17平衡模式对维持机体免疫内环境稳定具有至关重要的作用,一旦平衡失调,可引起全身或局部免疫应答异常。
综上所述,本研究结果提示创伤合并辐射损伤后Treg/Th17平衡模式向Th17免疫反应漂移,致使机体持续处于以过度炎症反应为主的免疫紊乱状态,进而影响局部创伤的修复,这很可能是辐射导致创伤难愈的深层次免疫学机制之一。
[1]Chen YQ, Sun TS. Progression of immunological researches on severe trauma[J]. Acad J PLA Postgrad Med Sch, 2011, 32(7):771-774.
[2]Cui YF, Du L. Radiation immune injury and its protection[J].Rad Prot Bull, 2009, 29(5): 19-24.
[3]Li Y, Shi Y, Huang Z, et al. CNI induced Th17/Treg imbalance and susceptibility to renal dysfunction in renal transplantation[J].Int Immunopharmacol, 2011, 11(12): 2033-2038.
[4]Zhang Y, Ma D, Zhang Y, et al. The imbalance of Th17/Treg in patients with uterine cervical cancer[J]. Clin Chim Acta, 2011,412(11/12): 894-900.
[5]Ma JJ, Lu N, Chen BL. Regulatory effect of transcription factors RORɣt on the Th17/Treg balances in pregnant asthma mice[J].Med J Chin PLA, 2012, 37(6): 561-568. [马佳佳, Nick Lu, 陈必良. 转录因子RORɣt对妊娠期哮喘模型小鼠Th17/Treg平衡的调节作用[J]. 解放军医学杂志, 2012, 37(6): 561-568.]
[6]Zhang QL, Cui YF, Shen XN, et al. Influences of different radiation modalities on wound healing of rats injured by combined radiation wound[J]. Infect Inflam Rep, 2009, 10(1):11-14. [张庆林, 崔玉芳, 莘旭妮, 等. 不同照射方式对放射复合伤大鼠伤口愈合的影响[J]. 感染、炎症、修复, 2009,10(1): 11- 14.]
[7]Ni Choileain N, MacConmara M, Zang Y, et al. Enhanced regulatory T cell activity is an element of the host response to injury[J]. J Immunol, 2006, 176(1): 225-236.
[8]Huang LF, Yao YM, Dong N, et al. Association between regulatory T cell activity and sepsis and outcome of severely burned patients: a prospective, observational study[J]. Crit Care, 2010, 14(1): R3.
[9]Du L, Ma Q, Cui YF, et al. Changes and significance of CD4+CD25+regulatory T cells in ɣ-ray irradiated mice[J]. Chin J Radiol Med Prot, 2011, 31(1): 21-24. [杜丽, 马琼, 崔玉芳,等. ɣ射线照射后小鼠CD4+CD25+调节性T细胞的变化及其意义[J]. 中华放射医学与防护杂志, 2011, 31(1): 21-24.]
[10]Du L, Ma Q, Cui YF, et al. Influence and significance of ɣ-rays on the function of mice regulatory T cells and related cytokines[J]. Scientia Sinica Vitai, 2011, 41(10): 951-957. [杜丽, 马琼, 崔玉芳, 等. ɣ射线对小鼠调性T细胞功能及相关细胞因子的影响及意义[J]. 中国科学:生命科学, 2011,41(10): 951-957.]
[11]Sasaki JR, Zhang Q, Schwacha MG. Burn induces a Th-17 inflammatory response at the injury site[J]. Burns, 2011, 37(4):646-651.
[12]Neely CJ, Maile R, Wang MJ, et al. Th17 (IFNɣ-IL17+) CD4+T cells generated after burn injury may be a novel cellular mechanism for postburn immunosuppression[J]. J Trauma,2011, 70(3): 681-690.
