黄芪对IgA肾病大鼠肾组织α-SMA和FN的影响
2013-10-31彭晓杰黄玉辉吴小川郑卫民傅睿李群苗静齐海峰
★ 彭晓杰 黄玉辉 吴小川 郑卫民 傅睿 李群 苗静 齐海峰
(1.江西省儿童医院 南昌 330006;2.中南大学湘雅二医院 长沙 410008)
黄芪对IgA肾病大鼠肾组织α-SMA和FN的影响
★ 彭晓杰1*黄玉辉1**吴小川2郑卫民1傅睿1李群1苗静1齐海峰1
(1.江西省儿童医院 南昌 330006;2.中南大学湘雅二医院 长沙 410008)
目的:探讨黄芪对IgA肾病大鼠肾组织α-平滑肌肌动蛋白(α-SMA)、纤维连接蛋白(FN)表达的影响,以观察黄芪对对IgA肾病的治疗作用及抗肾间质纤维化的机理。方法:复制IgA肾病大鼠模型,并给予黄芪治疗,分析肾脏病理改变,采用免疫组织化学技术检测各组大鼠肾组织中α-SMA、FN的表达情况。结果:IgA肾病模型组大鼠肾小球系膜区、肾小管、肾间质病理损害较正常对照组和黄芪治疗组明显加重,模型组大鼠肾小球系膜区IgA免疫荧光明显增强,与正常对照组(P<0.001)和黄芪治疗组(P<0.001)比较均有统计学意义。正常组肾组织有少量α-SMA和FN的表达,而IgA肾病模型组大鼠肾组织中α-SMA和FN表达明显增强,与正常对照组和黄芪治疗组α-SMA(P<0.05)和FN(P<0.05)比较差别有统计学意义。结论:黄芪可以抑制IgA肾病大鼠肾组织中α-SMA和FN的表达,从而干预肾间质纤维化,减轻肾脏病理改变,延缓IgA肾病的发生发展。
黄芪;IgA肾病;大鼠;α-SMA;FN
IgA肾病发病机制尚不明,故目前无治疗的重大进展。西药对本病目前尚无特殊有效的治疗方法和措施。黄芪是中医传统补气药,具有强大的免疫调节作用,许多研究显示,其在治疗肾病综合症、蛋白尿、慢性肾炎等方面有显著疗效。本研究观察黄芪对IgA肾病大鼠肾组织α-平滑肌肌动蛋白(α-SMA)、纤维连接蛋白(FN)改变的情况,明确黄芪对肾脏的作用和机制,为临床上缓解IgA肾病的发生发展提供实验依据。
1 材料与方法
1.1 实验动物及分组
健康成年SD纯种大鼠32只,雌性,体重(150±15)g,全部购自中南大学湘雅二医院动物实验中心,合格证号为SYXK(湘)-2008-0013,动物饲养室符合二级标准。所有大鼠实验前3d,均做尿蛋白、尿潜血(试纸法)检查,以排除非健康实验动物对实验结果的影响。按随机数字表法随机分为3组:空白对照组8只,模型组和黄芪治疗组各12只。
1.2 造模用药
牛血清白蛋白(北京夏斯生物技术有限公司)、脂多糖(SIGMA公司)、四氯化碳、蓖麻油。
1.3 主要试剂
好好黄芪颗粒(四川百利药业有限责任公司)、小鼠抗大鼠α-SMA单克隆抗体(美国R&D公司)、小鼠抗大鼠FN单克隆抗体(美国R&D公司)、羊抗大鼠IgA单克隆抗体(Southern生物技术公司)、抗小鼠二抗试剂盒(北京中杉)。
1.4 实验方法
模型组大鼠予隔日口服牛血清白蛋白(400mg/kg),皮下注射四氯化碳(蓖麻油0.5mL+CCl4 0.10mL, 每周1次,持续9周)并加用脂多糖(LPS)(第6、8周予0.05mg)尾静脉注射[1]然后观察至第12周末。黄芪治疗组造模方法同模型组,第8周开始口服黄芪颗粒剂,剂量为成人每日每kg体重10倍量,直到12周末。空白对照组只隔日口服和静脉注射生理盐水,直到12周末。
1.5 检测指标
观察实验大鼠肾组织病理变化(HE染色、PAS染色、IgA免疫荧光),并用免疫组化检测肾组织α-SMA和FN的表达量。采用多功能真彩色病理分析系统(由北京航空航天大学图像中心提供)进行免疫组化分析:计算每张切片10个200倍视野下染色区域面积占整个肾组织面积的百分比,以均值表示表示每例肾组织阳性面积信号。IgA免疫荧光参考目前国内外通用的5级法分级。
1.6 统计学分析
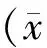
2 结果
2.1 一般情况
除正常组外,各实验组大鼠于造模时均有不同程度的食欲减少,精神萎靡,注射脂多糖后第二天情况加重。部分大鼠出现皮毛蓬乱,或出现腹泻,于8-10d自行缓解。模型组死亡3只,黄芪治疗组死亡2只,均已从实验中剔除。
2.2 肾组织IgA荧光强度变化
正常组大鼠肾小球系膜区无IgA沉积,模型组肾小球系膜区有较强的团块状黄绿色强IgA荧光或颗粒状中等强度IgA荧光,两者相比较有非常显著的统计学差异(P<0.001),表明IgA肾病模型复制成功。黄芪治疗组大鼠肾小球系膜区IgA荧光强度明显减弱(P<0.001),表现为肾小球系膜区内散在的线状或颗粒状的IgA轻度沉积(见图1)。提示黄芪可以降低实验IgA肾病大鼠肾组织IgA荧光强度(见表1)。

表1 各组大鼠肾组织IgA强度的比较
2.3 临床指标及肾脏病理的变化
研究提示黄芪有降低实验IgA肾病大鼠尿红细胞和尿蛋白水平,且可抑制IgA肾病大鼠肾脏系膜细胞和系膜基质的增生(见图1)。
2.4 肾组织α-SMA和FN变化
免疫组化结果显示:α-SMA正常少量表达肾小管上皮细胞的胞浆和胞膜,另少量表达于肾小球及肾间质,FN少量表达于肾近曲、远曲间质内,在血管内皮细胞无表达。与正常组比较,模型组大鼠肾脏组织内α-SMA和(P<0.01)和FN(P<0.05)表达明显增强,差别均有统计学意义(见表2)。黄芪治疗组与正常组比较肾脏组织内α-SMA和FN表达轻度增强,但差别无统计学意义。提示黄芪可以明显降低IgA肾病大鼠肾组织内α-SMA和FN的表达。

表2 各组大鼠肾组织α-SMA和FN表达面积比较

A为正常组;B为模型组;C为治疗组
3 讨论
儿童IgA肾病是儿童常见的原发性肾小球疾病之一,约有20%-30%的患儿在起病20-30年后发展为慢性肾功能衰竭。[2]但由于IgA肾病发病机制不明,故目前尚无治疗的重大进展。本实验采用隔日口服大剂量的牛血清白蛋白,皮下注射四氯化碳加尾静脉注射脂多糖复合方法塑造IgA肾病模型,免疫荧光示IgA在肾小球系膜区呈弥散性颗粒状或线状沉积,肾小球系膜细胞和系膜基质增生,符合IgA肾病的病理变化,表明实验性IgA肾病大鼠模型复制成功。
IgA肾病肾小管-间质纤维化的发病机理之一是肾小管上皮转分化为α-平滑肌肌动蛋白(α-SMA)阳性的肌成纤维细胞、游离肾小管而致肾小管萎缩。[3]研究发现,[4]肾小球系膜细胞、肾小管上皮细胞转分化后均表达间充质细胞的标志蛋白-α-SMA,异化为肌成纤维细胞(MF),MF具有比成纤维细胞更强大的增殖、分泌能力,其分裂增生及分泌能力增强,合成大量细胞外基质成分如纤维连接蛋白(FN)、I、III、IV型胶原(Col l、III、IV)、层粘连蛋白(LN),沉积于肾间质,最终导致肾间质纤维化。[5]α-SMA的表达可以反映肌成纤维细胞的变化。FN可精确反应肾脏纤维化程度,两者的表达变化在一定程度上反应肾功能损害程度与所用药物存在的相关性。[6]正常情况下,FN在肾脏表达不明显,在肾间质病变时表达增强。[7]我们的实验发现IgA肾病大鼠肾组织α-SMA、FN的表达明显升高,α-SMA主要表达肾小管上皮细胞的胞浆和胞膜,另少量表达于肾小球及肾间质,FN主要表达于肾近曲、远曲间质内;表明α-SMA、FN参与了IgA肾病的发病过程。同时发现黄芪治疗组α-SMA及FN表达较模型组明显减弱,表明黄芪可以明显抑制IgA肾病大鼠肾组织中α-SMA、FN的表达,提示黄芪在治疗IgA肾病时可通过减少肾组织中α-SMA、FN的表达,从而抑制细胞外基质的合成,来延缓IgA肾病的硬化。肾脏病理亦证实,黄芪治疗组系膜基质、系膜细胞和系膜区IgA沉积明显减少。
本实验表明黄芪可以抑制IgA肾病大鼠肾组织中α-SMA和FN的表达,从而干预肾间质纤维化,减轻肾脏病理改变,延缓IgA肾病的发生发展。黄芪是否还有其他机制,还有待进一步研究。
[1]汤颖,娄探奇,成彩联,等.实验性IgA肾病模型的改进[J].中山大学学报,2006,27(2):184-187.
[2]Barratt J, Feehally J. IgA nephropathy[J].J Am Soc Nephrol,2005, 16(7):2 088-2 097.
[3]Eddy AA. Molecular insights into renal interstitial fibrosis[J].J Am Soc Nephro, 1996,7(12):2 495-2 508.
[4]Ng YY, Huang TP, Yang W C, et al Tubular epithelial-myofibroblast transdifferentiation in progressive tubulointerstitial in 5/6 nephrectomized rats[J].Kidney Int, 1998,54(3):864-876.
[5]YamasakiS, Nakashima T, Kawakami A, et al. Cytokines regulate fibroblast-1ike synovial cell differentiation to adipocyte-like cells[J].Rheumatology, 2004, 43(4):448-452.
[6]程虹,堪贻撲.肾脏细胞外基质代谢的调控[J].国外医学内科学分册,2003,11(30):477-480.
[7]Geleilete TJ, Melo GC, Costa RS, et al. Role of myofibroblasts, maeroPhages, transforminggrowthfactor-betal endothelin, angiotensin- II , and fibroneetin in the Progression of tubulointerstitial nephritis induced by gentamiein[J].Nephrol, 2002,15(6):633-642.
TheInfluenceofAstragalusonα-SMAandFNinratwithIgANephropathy
PENGXiao-jie1*,HUANGYu-hui1**,WUXiao-chuan2,ZHENGWei-min1,FURui1,LIQun1,MIAOJing1,QIHai-feng1
1.JiangxiChildren'shospital,Nanchang330006;2.XiangyaNo.2hospitalofZhongnanUniversity,Changsha410008
Objective:To study the influence of Astragalus on α-SMA and FN in rat with IgA nephropathy so as to observe the mechanism of the astragalus in its therapy function and its resistance mechanism of renal interstitial fibrosis. Methods: Rat IgA nephropathy (IgA N) model was established. The rats was treated with astragalus. Albuminuria ,haematuria and pathological chang of renal tissue were measured. The distribution of α-SMA and FN in renal tissue was detected in rat IgA nephropathy model by immunohistochemical staining. Results: The pathological change of glomerular mesangium, nephric tubule and renal interstitial became serious in rat IgA nephropathy model, when compared with normal control group and astragalus treatment group. Immumofluorescence showed renal IgA density in rat IgA nephropathy model make a contrast to the normal control group(P<0.001) and astragalus treatment group(P<0.001). The result of histochemistry showed that the distribution of α-SMA and FN in normal renal tissue was small. The distribution of α-SMA and FN in IgA nephropathy model dramatically potentialized in normal control group (P<0.05)and astragalus treatment group(P<0.05). Conclusion: Astragalus can prevent the express of α-SMA and FN of rat with IgA nephropathy, in addition it can interfere with the interstitial fibrosis of kidney and pathological changes to delay the development and progression of IgA nephropathy.
Astragalus;IgA nephropathy;Rat;α-SMA;FN
彭晓杰,男,主治医师,E-mail:wuxuan1028@163.com。
**通讯作者:黄玉辉,男,副主任医师,E-mail:hyh691212@163com。
R285.5
B
2013-10-12)
