温度对相同引种地三个秋茄居群遗传多样性的影响
2013-10-28马小伟章宏琼宋佳楠朱忆思梦张洪勤施孟如
杨 娟,马小伟,章宏琼,周 云,宋佳楠,朱忆思梦,张洪勤,施孟如
(1. 杭州师范大学发育与再生研究所,浙江 杭州 310036;2. 温州医科大学仁济学院,浙江 温州 325035;3. 温州医科大学生物学实验教学中心,浙江 温州 325035)
温度对相同引种地三个秋茄居群遗传多样性的影响
杨 娟1,马小伟2,章宏琼2,周 云2,宋佳楠2,朱忆思梦2,张洪勤2,施孟如3
(1. 杭州师范大学发育与再生研究所,浙江 杭州 310036;2. 温州医科大学仁济学院,浙江 温州 325035;3. 温州医科大学生物学实验教学中心,浙江 温州 325035)
秋茄是世界分布最北的红树植物,研究温度对其遗传多样性的影响有助于阐明其抗冻机制.文章同时应用RAPD和ISSR分子标记技术,对3个不同纬度地区秋茄居群的遗传多样性和遗传分化进行分析,根据RAPD 和 ISSR 数据计算遗传距离并进行聚类分析.2种方法均显示3个居群分为2大支:西门岛和象山港两居群之间遗传距离最小,两者之间的遗传一致度最大,首先聚为一类;漳江口和象山港居群之间的遗传距离最大,两者之间的遗传一致度最小,因此单独为一支.由于温度的原因对引种的秋茄进行了筛选,导致遗传多样性减少.
秋茄;RAPD;ISSR;遗传多样性
红树林是处于亚热带、热带海洋与陆地过渡带的特殊生态系统,是海岸带的生态关键区,具有抵抗海啸和台风、调节区域气候、维护生物多样性等重要生态功能[1].秋茄(Kandeliacandel)是中国分布最广的常见红树植物,其天然分布最北至福建福鼎市,人工种植最北至宁波象山港,全世界最北分布的红树植物也是秋茄[2].国内外学者对秋茄在生态学[3-4]、生理学[5-6]、生物化学[7]、药物学[8]、耐盐机理[9]、分子[10]等多个方面开展了大量研究.林盛昌等[11]采用月最低温度这一指标,以温差2 ℃ 划分,并结合野外考察资料,把中国红树植物分为7个耐寒等级序列,其中秋茄自然分布纬度最高,具有极强的适应能力,为最耐寒的种类.但向高纬度移植时经常发生的极端低温对其成功越冬产生了威胁[12].对此,各有关国家开展了各方面研究,但大多集中在生物化学、生态学、生理学[13]等领域, 而关于分子生物学的研究也十分必要.
本研究选择秋茄作为研究对象,采用随机扩增多态性 (Randomly amplified polymorphism DNA,RAPD)和简单序列重复间区(inter-simple sequence repeat,ISSR)分子标记技术,探讨温度对来源于同一地区3个秋茄居群的遗传多样性和遗传分化的影响,为高纬度选育抗冻秋茄品种提供技术理论基础.
1 材料与方法
1.1 样品的采集与处理
秋茄叶片采自厦门漳江口、温州西门岛和宁波象山港(表1).在选定的3个不同纬度居群中每隔 5~10 m选择长势良好的植株,每树采集当年生的展开完全的幼嫩叶片(倒二叶)10片,用棉花蘸取足够的水分包住茎枝条的基部,保持叶片新鲜不变质,迅速放冰上保存,处理待测,并于-20 ℃冰箱内保存.

表1 取样地基本情况Tab. 1 Basic information of sample area
1.2 主要实验仪器及试剂
NANODROP 2000为Thormal公司产品;Gel Doc电泳凝胶成像系统,DTC200PCR仪均为Bio-Rad公司产品;UV 2800紫外可见分光光度计为上海尤尼柯公司产品;5417R低温离心机为Eppendorf产品.
ISSR引物、RAPD引物、1 Kbp DNA Ladder Marker购自上海捷瑞生物公司,Taq酶购自大连宝生物.
1.3 方法
秋茄叶片总DNA采用改良后的CTAB法[14]提取,获得的DNA 由NANODROP 2000测定其浓度及纯度.根据基因组 DNA 浓度值将样品稀释至20 ng/μL 用于RAPD和ISSR分析.

表2 RAPD和ISSR引物序列和最佳退火温度Tab. 2 Primers and annealing temperature screened for RAPD and ISSRamplification
RAPD-PCR反应对15个RAPD引物进行筛选,从中选取8个扩增条带清晰、重复性稳定的引物用于RAPD-PCR的扩增(表2).扩增体系为每25 μL反应体积含:2.5 μL 10×PCR Buffer(Mg2+free)、2.0 μL dNTP mixture(2.5 mmol/L)、1.5 μL MgCl2(25 mmol/L)、2.0 μL prime(10 μmol/L),1.0 μL DNA(30~50 ng),1.5 μL TaKaRa Taq(5 U/μL),加ddH2O至25 μL,用漩涡混合器对所加的各组分进行混合;扩增程序:94 ℃预变性5 min,之后进行40个循环,每个循环包括94 ℃变性1 min、36 ℃退火1 min,72 ℃延伸2 min,最后于72 ℃再延伸7 min.将扩增产物用琼脂糖凝胶电泳鉴定.
ISSR-PCR反应对15个ISSR引物进行了筛选,从中选取9个扩增条带清晰、重复性较好的引物用于PCR扩增(表2).扩增体系为每25 μL反应体积含:2.5 μL 10×PCR Buffer(Mg2+free)、2.0 μL dNTP mixture(2.5 mmol/L)、1.5 μL MgCl2(25 mmol/L)、2.0 μL prime(10 μmol/L),1.0 μL DNA(30~50 ng),1 U TaKaRa Taq(5 U/μL),加ddH2O至25 μL;扩增程序:94 ℃预变性5 min,之后进行45个循环,每个循环包括94 ℃变性45 s、52 ℃退火45 s,72 ℃延伸90 s,最后于72 ℃再延伸7 min.将扩增产物用琼脂糖凝胶电泳鉴定.
重复扩增和电泳2次,选取清晰的条带进行统计分析.电泳图谱的每条带DNA片段均为1个分子标记代表1个引物的结合位点,根据分子标记的迁移率及有无来统计所有的二元数据.有带显性记为“1”, 无带隐性记为“0”. PopGen32软件计算各数据,并根据Nei’s遗传距离进行UPGMA聚类分析,构建系统树.
2 实验结果
2.1 不同纬度秋茄居群的遗传多样性
2.1.1 RAPD实验结果的分析
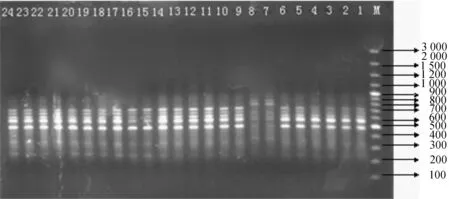
Marker:100 bp Plus DNA Ladder;泳道1~8:象山港居群8株不同秋茄样品;泳道9~16:西门岛居群8株不同秋茄样品;泳道17~24:漳江口居群8株不同秋茄样品.图1 RAPD引物S58的扩增结果Fig. 1 RAPD-PCR results of primer S58
用筛选出的8个RAPD随机引物在3个纬度秋茄居群24个个体间扩增,得到的条带为0.3 ~3 kb.共扩增出1 152个条带,多态性条带为 30条,图1为引物S58的扩增结果.根据RAPD扩增结果计算,3个居群的多态位点百分率在17.46%~53.97%,平均值为39.15%(表3).每个位点的平均等位基因数为1.346 1±0.460 0.Nei’s基因多样性指数(H)是衡量群体遗传多样性的指标.3个居群的H指数为0.075 8 ~ 0.226 5,总基因多样度(Ht)和居群内基因多样度(Hs)分别为0.255 6和0.166 8.计算基因分化系数(Gst)为0.347 4,其中居群间的遗传变异占总的遗传变异的34.74%,居群内的遗传变异占总变异的65.26%,表明居群内存在较高的遗传分化.3个居群之间的基因流(Nm)为1.276 6,表明温秋茄居群间的基因交流较高.3个居群的Shannon’s信息指数(I)为0.108 7~0.327 6,平均值为0.290 9,居群间的I指数为0.328 1(表3).3个居群中,漳江口居群表现出相对较高的遗传多样性,象山港居群和西门岛居群表现出较低的遗传多样性.
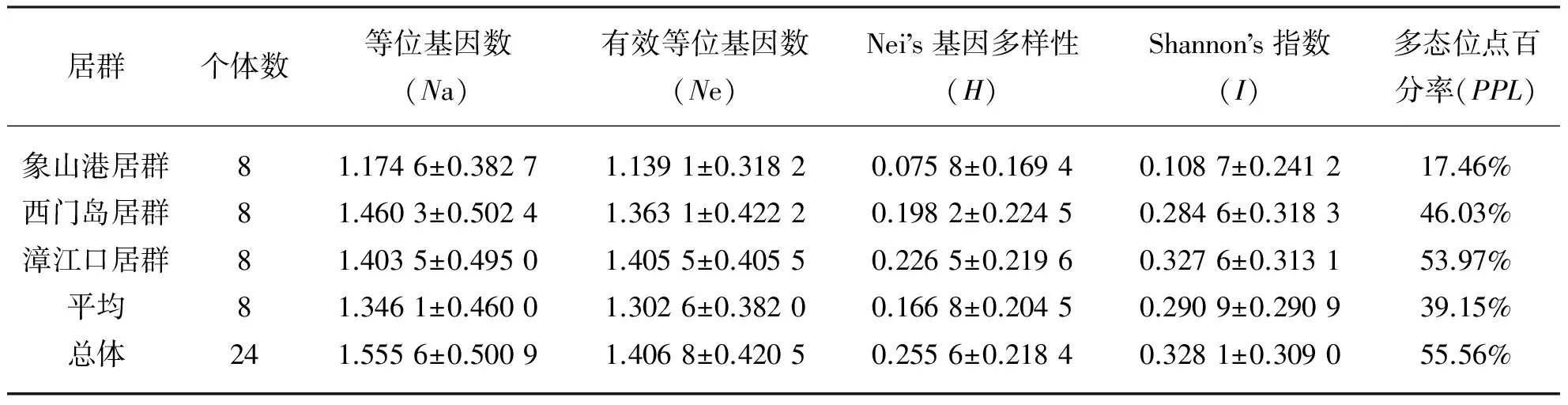
表3 RAPD标记的秋茄3个居群的遗传多样性Tab. 3 Genetic variations in three populations of Kandelia candel by RAPD
2.1.2 ISSR实验结果的分析
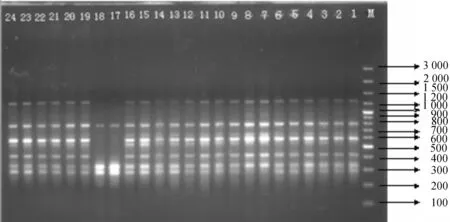
Marker:100 bp Plus DNA Ladder;泳道1~8:象山港居群8株不同秋茄样品;泳道9~16:西门岛居群8株不同秋茄样品;泳道17~24:漳江口居群8株不同秋茄样品.图2 ISSR引物BW09481HAP的扩增结果Fig. 2 ISSR-PCR results of primer BW09481HAP
9个ISSR随机引物扩增3个秋茄居群共24个个体.扩增的条带为0.15~2.2 kb,共扩增出1 368个条带,多态性条带为22条.图2为引物BW09481HAP扩增结果.3个居群的多态位点百分率为29.82%~54.39%,平均值为41.52%(表4).每个位点的平均等位基因数为1.415 2±0.444 4.本实验中,3个居群的H指数为0.096 2~0.245 3,总基因多样度和居群内基因多样度分别为0.230 0和0.171 7.基因分化系数为0.253 5,其中居群间的遗传变异占总遗传变异的25.35%,居群内的遗传变异占总变异的74.65%,表明居群内存在较高的遗传分化.3个居群之间的基因流为1.622 8,表明温秋茄居群间的基因交流较高.3个居群的I指数为0.145 0~0.347 4,平均值为0.247 2,居群间的I指数为0.349 5.3个居群中,漳江口居群表现出较高的遗传多样性,象山港居群和西门岛居群表现出较低的遗传多样性,此结果与RAPD实验结果一致.

表4 ISSR标记的秋茄3个居群的遗传多样性Tab. 4 Genetic variation in three populations of Kandelia candel by ISSR
2.2 遗传相似性分析

表5 RAPD标记的秋茄居群间的Nei’s无偏差遗传距离(对角线以下)及遗传相似系数(对角线以上)Tab. 5 Nei’s genetic distance(below diagonal) and geneticidentity(above diagonal) by RAPD
遗传分化指数只能对居群分化的程度作出评价,却不能判定居群间相互关系的远近,而遗传相似系数和遗传距离的度量则可以说明每个居群间彼此关系的远近.用popgene32软件分析RAPD与ISSR实验结果,计算秋茄居群间的Nei’s无偏差遗传距离(D)和遗传一致度.
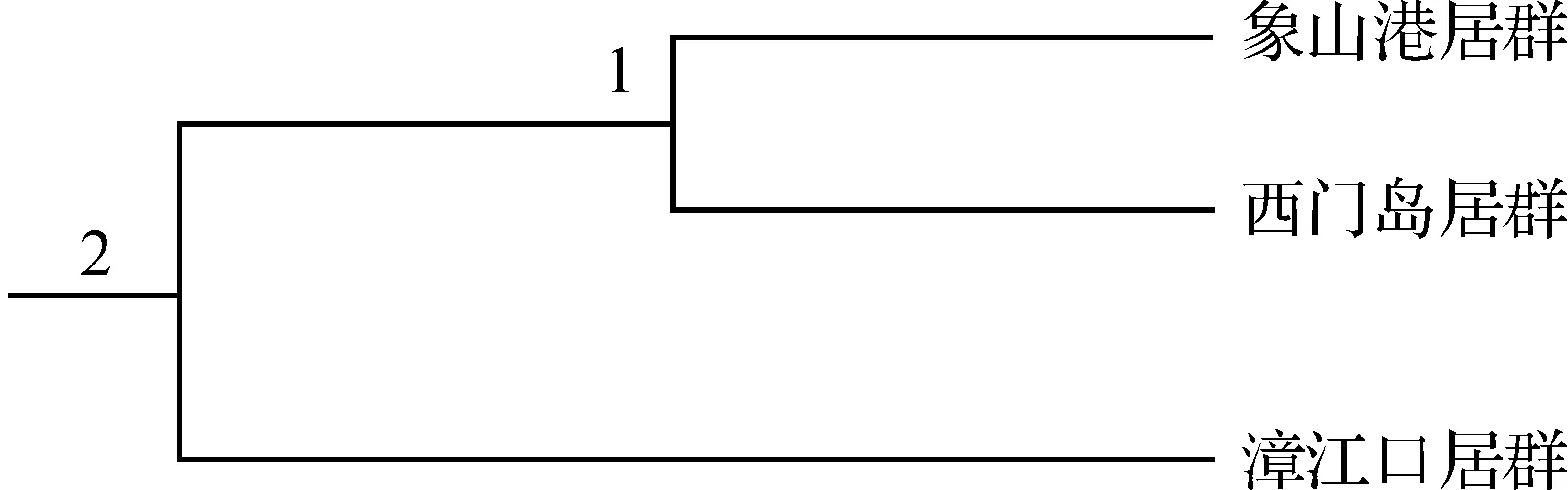
图3 RAPD标记的秋茄居群间Nei’s无偏差的UPGMA 聚类图Fig. 3 Nei’s Unbiased Measures of Biosystematic dengrogram of Kandelia candel populations by RAPD
表5为根据RAPD结果计算所得秋茄居群间的Nei’s无偏差遗传距离(D)和遗传一致度.结果显示:3个秋茄居群间的Nei’s无偏差遗传距离在0.014 6~0.140 8;其中西门岛和象山港两居群之间遗传距离最小(0.014 6),两者之间的遗传一致度最大(0.985 5);漳江口和西门岛之间的遗传距离最大(0.140 8 ),两者之间的遗传一致度最小(0.868 6).依据Nei’s的遗传距离对不同居群进行UPGMA 聚类,分析结果(图3)表明:3个居群分为2大支,象山港与西门岛两个居群的遗传距离最小,首先聚为一类;漳江口居群与其它居群遗传距离最远,单独为一支.
ISSR结果用popgene32软件计算秋茄居群间的Nei’s无偏差遗传距离(D)和遗传一致度.由表6结果可知: 3个秋茄居群间的Nei’s无偏差遗传距离在0.069 3~0.137 3;其中西门岛和象山港两居群之间遗传距离最小(0.069 3),两者之间的遗传一致度最大(0.933 1);漳江口和象山港之间的遗传距离最大(0.137 3),两者之间的遗传一致度最小(0.871 7).依据Nei’s的遗传距离对不同居群进行UPGMA聚类分析,结果表明:3个居群分为2大支,象山港与西门岛两个居群的遗传距离最小,首先聚为一类;漳江口居群与其它居群遗传距离最远,单独为一支(图4).
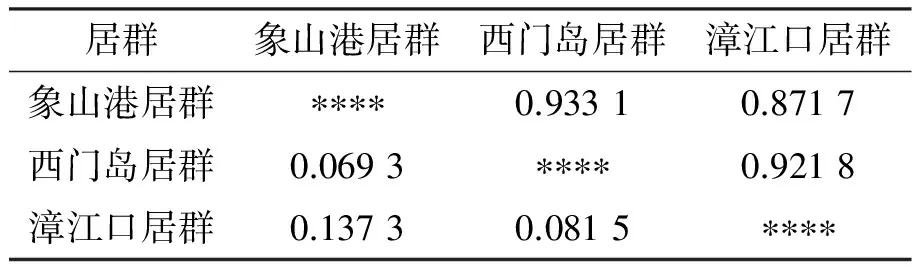
表6 ISSR标记的秋茄居群间的Nei’s无偏差遗传距离(对角线以下)及遗传相似系数(对角线以上)

图4 ISSR标记的不同纬度秋茄居群间Nei’s无偏差的UPGMA 聚类图Fig. 4 Nei’s Unbiased Measures of Biosystematic dengrogram of Kandelia candel populations by ISSR
3 讨 论
遗传多样性的产生是由于遗传信息在外界或内在因素作用下,在复制过程中出现差错(如DNA片段的缺失、倒位、转座或易位等),从而导致了各种不同的遗传变异.植物居群遗传变异的分布与该物种的地理分布情形、 生态特征有关[15],植物群体遗传多样性水平表明了一个物种在特定环境中基因的丰富程度,是物种适应环境和遗传进化的基础.
物种的遗传多样性水平可以为其现状和保护价值的评估以及迁地保护提供非常重要的信息.本实验结果表明3个居群内存在较高的遗传分化.而居群的遗传结构从一定意义上说是基因流和遗传漂变两种力量相互作用的结果.居群间存在的基因流的强弱对群体遗传分化具有重要影响,当Nm>1时,基因流能发挥其均质化作用,可防止由遗传漂变引起的居群间的遗传分化;如果Nm<1,基因流成为遗传分化的主要原因,低水平的基因流可能造成群体对局部生态环境的适应,进而促使群体间的遗传隔离,导致种群间明显的遗传分化.植物居群间的基因流是借助于花粉、种子、孢子、植株个体以及其他携带遗传物质的物体为媒介进行的,其中花粉和种子扩散是自然植物种群最主要的基因流.而地理隔离是阻止花粉和种子扩散等基因流的最主要因素.本研究中居群间的Nm均远大于1,可能是不同居群地理间隔不大,尤其是西门岛居群与象山港居群从漳江口居群引种,所以不同居群间发生基因交流的频率较高.加上本实验采样地的限制,从而造成种群间的分异不明显.
多态位点百分率可以作为遗传多样性高低的指标[16].本研究RAPD和ISSR分析结果均显示, 3个居群的多态位点百分率依次为漳江口居群>西门岛居群>象山港居群,表明3个居群中,漳江口居群具有较高的遗传多样度.秋茄基因组的多样性是其广泛适应性的决定因素,许多研究表明,低温是限制红树植物向高纬度分布的重要因子[17],秋茄在高纬度引种过程中,主要的环境制约因子是温度,特别是最低月均温.而本研究所采用的西门岛及象山港秋茄样品均由漳江口引种,由于三地纬度及平均温度等自然环境条件差异较大,其居群经自然选择,不适应低温秋茄植株被淘汰,而适应低温的秋茄保留下来并产生了相应的适应性.聚类分析结果表明:3个居群分为2大支,西门岛和象山港两居群首先聚为一类;漳江口居群单独为一支.实验结果符合3个秋茄居群的地理分布.
本研究结果表明,向更高纬度地区引种红树植物时可选择与抗冻秋茄遗传关系和生理特性接近的树种.由于温度的影响,同地引种的秋茄在遗传多样性上已经发生了一定的变化,生产在温度较低地方的秋茄居群遗传多样性更小,但同时为低纬度引种筛选出有着优良遗传基因的品种.
[1] Nagelkerken I, Blaber S J M, Bouillon S,etal. The habitat function of mangroves for terrestrial and marine fauna: a review[J]. Aquatic Botany,2008,89(2):155-185.
[2] 仇建标,黄丽,陈少波,等.强潮差海域秋茄生长的宜林临界线[J].应用生态学报,2010,21(5):1252-1257.
[3] Chen G Z, Mao S Y, Tame N F Y,etal. Effect of synthetic wastewater on youngKandeliacandelplants growing under greenhouse conditions[J]. Hydrobiologia,1995,295:263-273.
[4] Bandaranayake W M. Traditional and medicinal uses of mangroves[J]. Mangroves and Salt Marshes,1998,2(3):133-148.
[5] 王文卿,林鹏.红树植物体内元素分布特点与抗盐机理[J].林业科学,2003,39(4):30-36.
[6] 叶庆华,吴韩志,彭兴跃,等.用流式细胞仪研究秋茄叶肉细胞大小和叶绿素含量与海水盐度的关系[J].海洋科学,2003,27(8):67-71.
[7] Huang W,Fang X D,Li G Y,etal. Cloning and expression analysis of salt responsive gene fromKandeliacandel[J]. Biologia Plantarum,2003,47(4):501-507.
[8] Khan N I, Suwa R,Hagihara A,etal. Interception of photosynthetic photon flux density in a mangrove stand ofKandeliacandel(L.) Druce[J]. J For Res,2004,9:205-210.
[9] 陈鹭真,王文卿,林鹏.潮汐淹水时间对秋茄幼苗生长的影响[J].海洋学报,2005,27(2):141-147.
[10] Khan N I, Suwa R,Hagihara A,etal.Allometric relationships for estimating the aboveground phytomass and leaf area of mangroveKandeliacandel(L.) Druce trees in the Manko Wetland, Okinawa Island, Japan[J]. Trees,2005,19:266-272.
[11] 杨盛昌,林鹏.潮滩红树植物抗低温适应的生态学研究[J].植物生态学报,1998,22(1):60-67.
[12] 陈鹭真,王文卿,张宜辉,等.2008年南方低温对我国红树植物的破坏作用[J].植物生态学报,2010,34(2):186-194.
[13] 周涵韬,林鹏.中国红树科7种红树植物遗传多样性分析[J].水生生物学报,2001,25(4):362-369.
[14] Rogers O S,Bendich A J.Extraction of DNA plant tissue,plant molecular[M]//Gelvin S B,Schilpe R A,Verna D S. Plant molecular biology manual. Dordecht: Kluwer Academic Publishiers,1988:1-10.
[15] Loveless M D, Hamrick J L. Ecological determinants of genetic structure in plant populations[J] . Annu Rev Ecol Syst,1984,15:65-95.
[16] 张文彪,金则新,李均敏.不同生境夏蜡梅群体遗传多样性的RAPD分析[J].植物研究,2007,27(3):313.
[17] 林鹏.红树林[M].北京:海洋出版社,1984:1-104.
TheEffectsofTemperatureontheGeneticDiversityofThreeKandeliaCandelPopulationsinSympatricIntroducingSite
YANG Juan1, MA Xiaowei2, ZHANG Hongqiong2, ZHOU Yun2, SONG Jianan2,ZHU Yisimeng2, ZHANG Hongqin2, SHI Mengru3
(1.Insitute of Developmental and Regenerative Biology, Hangzhou Normal University, Hangzhou 310036, China; 2.Renji College,Wenzhou Medical University, Wenzhou 325035, China;3.Experimental Teaching Center of Biology, Wenzhou Medical University,Wenzhou 325035, China)
Kandeliacandelis the northernmost distribution of mangrove in the world. The study about the effects of temperature on the genetic diversity of threeKandeliacandelpopulations in sympatric introducing site is useful to clarify the antifreeze mechanism. RAPD and ISSR molecular markers were used to detect the genetic diversity and genetic differentiation of threeKandeliacandelpopulations in three different latitudes, and the genetic distances were calculated and clustering analyzed with the data of RAPD and ISSR. Both of the two methods showed that these three populations were separated to two groups. Ximen Island and Xiangshangang populations were clustered into one group, because the smallest genetic distance and the maximum genetic identity were found between them. Zhangjiangkou population was clustered into a group, because the largest genetic distance and the minimum genetic identity were found between Zhangjiangkou and Xiangshangang populations. The reason why the genetic diversity drops off is that the fall of temperature.
Kandeliacandel; Randomly amplified polymorphism DNA; inter-simple sequence repeat; genetic diversity
2013-05-22
施孟如(1979—),女,实验师,主要从事蛋白质组学和分子生物学研究.E-mail:dreamlike007@163.com
10.3969/j.issn.1674-232X.2013.06.013
Q948
A
1674-232X(2013)06-0544-06
