臭氧处理对番茄采后品质的影响
2013-10-28童智莹赖童飞
潘 洁,黄 焰,童智莹,李 燕,赖童飞,周 婷
(杭州师范大学生命与环境科学学院,浙江 杭州 310036)
臭氧处理对番茄采后品质的影响
潘 洁,黄 焰,童智莹,李 燕,赖童飞,周 婷
(杭州师范大学生命与环境科学学院,浙江 杭州 310036)
以破色期番茄(Solanumlycopersicumcv. Ailsa Craig)为实验对象,研究了常温O3处理对采后番茄果实生理、生化指标以及品质的影响.结果表明,利用3±0.5 μL/L的O3处理果实3 h,能延迟番茄果实的呼吸跃变,降低乙烯释放量;延缓番茄果实品质的下降,维持果实较高的超氧化物歧化酶、过氧化氢酶、过氧化物酶活性,但对抗坏血酸氧化酶影响较小;同时O3能够有效抑制Botrytiscinerea的生长发育,对番茄灰霉病有一定的防治效果.
臭氧;番茄;Botrytiscinerea;贮藏保鲜;抑菌作用
臭氧(O3)是一种具有特殊气味、不稳定的淡蓝色气体,氧化能力极强,可用于多种环境的消毒灭菌.与其他化学消毒防腐处理相比,O3杀灭病原菌范围广、效率高、速度快,而且分解不会残留任何有害物质,2001年被美国食品及药物管理局(US-FDA)列入可直接与食品接触的添加剂范围.同时,作为冷杀菌技术,O3能够避免加热杀菌时热敏性物质的变性,并能渗透到紫外线杀菌照射不到的部分[1],因此,O3在食品行业得到了广泛应用.
果实贮藏保鲜是农业生产的延续,寻找安全有效的果实采后保鲜技术具有重要的意义.报道表明,O3可以通过气体或液体以连续或非连续的形式处理采后果蔬,其效果根据处理强度及对象的不同而不同.Horvitz等发现0.7 μL/L O3处理能够延缓采后贮藏过程中灯笼椒的代谢,延长货架期[2];Boonkorn等利用200 μL/L O3处理柑橘果实,对其品质无显著影响[3];Rodoni等发现10 μL/L O3处理番茄果实10 min,能够降低果胶甲基酯酶的活性,延缓果实细胞壁的降解及果实的软化[4];Alothman等研究表明,O3处理显著提高香蕉和菠萝中总酚和类黄酮的含量,降低抗坏血酸含量[5];Hildebrand等利用50±10 μL/L O3配合低温处理胡萝卜,引起胡萝卜表皮褪色,但对其营养成分没有影响[6];Hassenberg等使用臭氧水处理生菜,造成生菜中抗坏血酸及糖含量的损失[7];Wang 等发现臭氧处理能使香菜在贮藏期维持较高的品质及其独特芳香[8].
O3还可以有效抑制Botrytiscinerea[9]、Penicilliumdigitatum、Penicilliumitalicum[3,9]、Sclerotiniasclerotiorum[10]、Escherichiacoli、Bacilluscereus[11]、Salmonella[12]、Alternariaalternata、Colletotrichumcoccodes[13]等果蔬的主要采后病原菌,减少果蔬的腐烂,并延长其货架期.抑制效果与病原菌种类、O3浓度、处理时间以及果实自身的响应有关.此外,O3还能依靠其强氧化性,破坏有机农药的化学键,去除农药残留[1,14].
番茄是典型的呼吸跃变型果实,具有明显的后熟现象,果实采后衰老很快,贮藏过程中也易受到微生物(如B.cinerea、C.coccodes、S.sclerotiorum等)的侵染而致病,导致果实商品性下降[10].因此,番茄采后贮藏过程中果实的品质保持及病害抑制是生产实践中亟待解决的一个难题.目前已有O3应用于番茄保鲜的研究,大多集中于O3的防腐效果以及与其他非热杀菌方式如次氯酸钠、电子束照射的比较,或配合低温对鲜切番茄及整果品质的影响[13].但模拟零售环境,研究常温下O3处理对番茄生理、生化指标及贮藏品质影响的报道相对较少.
因此,本研究利用O3处理破色期番茄,研究了常温O3处理对采后番茄果实生理、生化指标及品质的影响,以及常温O3处理对番茄采后主要病害B.cinerea的抑制效果.研究结果将为O3在采后番茄及其他呼吸跃变型果蔬贮藏保鲜过程中的应用提供理论支持.
1 材料和方法
1.1 果实与处理
供试果实为大小均匀,无病、虫害及机械损伤的破色期番茄(Solanumlycopersicumcv. Ailsa Craig),在2%次氯酸钠溶液中浸泡2 min,流水冲洗,自然风干.果实随机分成两组装入水果筐(45 cm×35 cm×30 cm),每组3筐,每筐50个果实.筐外罩两层PE塑料袋,对照组密封,处理组预留通气口,连接臭氧发生器CFK-3A(杭州荣欣电子设备有限公司)臭氧送风口,以空气为气源,控制空气流量为0.25 m3/h,运行2 min后密封处理组通气口,碘量法检测O3为3±0.5 μL/L.处理3 h后将两组塑料袋打开,20 ℃、95%相对湿度条件下贮藏,每隔48 h拍照、保存样品.
1.2 果实乙烯释放量的测定
取15个番茄果实,排水法测量总体积,称重后置于容积为1.6 L的干燥器中,平衡30 min后密封2 h,利用50 mL注射器抽取容器内气体,通过气相色谱(SQ-206型气相色谱仪,北京分析仪器厂)检测乙烯及CO2含量.乙烯测定条件为:FID检测器,柱温80 ℃,汽化室温度150 ℃,GDX-502不锈钢填充柱,无分流进样,载气:N2(0.05 MPa),燃气:H2(0.04 MPa),助燃气:空气(0.05 MPa);CO2的测定条件为:汽化室温度380 ℃,辅气流量为30 mL/min.对照及处理果实各设3组重复(果实固定不更换),每组取3管气样,每隔48 h测量一次.
1.3 果实采后品质检测
番茄果皮颜色检测使用WSC全自动测色色差计(北京光学仪器厂),在果实赤道部每隔90°测量一次,结果以CIE-XYZ标准色度系统的三刺激值X、Y、Z表示(在红、绿、蓝三色系统中与待测光达到色匹配所需的3种原刺激的量);果实硬度检测使用TMS-Touch质构仪(Food Technology Corporation, USA),在每个番茄果实赤道部相对位置进行测量;用打孔器(直径10 mm)取果实中部、两侧的果肉,并用榨汁器榨取果肉的果汁,使用Abbe Refractometer(10481 S/N,USA)测量可溶性固形物含量(soluble solids content, SSC);可滴定酸(titratable acid, TA)参考Lai等方法,将5 g新鲜果肉匀浆并用去离子水稀释至25 mL,0.01 mol/L NaOH滴定至pH8.3[15];膜渗透率测量利用Conductivity meter(Model EC 215,Italy),用打孔器(直径10 mm)从10个果实上取10片果皮,去离子水漂洗3次,加入到含有30 mL去离子水的三角瓶中,25 ℃孵育3 h后,检测最初的电解质泄露值(D1),然后将混合物在95 ℃孵育30 min,测量得到总电解质泄露值(D2),膜渗透率=(D1/D2)×100%.
1.4 抗氧化酶活性测量
抗氧化酶活性测量参照Chan等[16]方法,从10个果实中取10 g果肉,立即放入25 mL冰水预冷的提取缓冲液中.过氧化氢酶(CAT)、过氧化物氧化酶(POD)、抗坏血酸氧化酶(APX)的提取缓冲液均为0.1 mol/L磷酸钾缓冲液(含1 mmol/L的EDTA,pH 7.0),超氧化物歧化酶(SOD)的提取缓冲液为0.1 mol/L磷酸钾缓冲液(含1 mmol/L的EDTA,pH 7.8).用打浆机将果肉打成浆液,离心(17 000 r/min, 60 min,4 ℃)后取上清液用于酶活性分析.
1.5 果实抗病性检测
将病原菌Botrytiscinerea接种在马铃薯葡萄糖琼脂培养基(PDA)上,25 ℃培养箱中培养两周,按1.1所述方法O3处理病原菌后,用含有0.05%Tween-20的无菌水收集孢子,4层无菌纱布过滤.将孢子悬浮液加入到含有100 mL马铃薯葡萄糖液体培养基(PDB)的250 mL三角瓶中,孢子终浓度为1.0×106spores/mL,25 ℃、200 r/min振荡培养8 h,期间每隔2 h收集孢子,光学显微镜下统计孢子萌发率,测量芽管长度.用消毒接种针在无任何处理的番茄果实赤道部刺0.3 mm深的伤口,接种10 μL上述浓度为1×104spores/mL的Botrytiscinerea孢悬液,将果实置于塑料筐内,20 ℃保存,用塑料薄膜覆盖以保持95%相对湿度.每隔24 h统计发病率及病斑面积.
1.6 数据分析
实验中数据为3个或3个以上样本平均值,利用SPSS 11.5软件进行分析.采用单因素方差分析,Duncan's检验和Dunnett's T3检验进行多重比较.P<0.05时具统计学意义.
2 实验结果
2.1 O3处理延缓采后番茄果实果皮变红
采后O3处理可以有效延缓采后番茄果实果皮的转红过程.常温贮藏6 d,对照果实果皮基本转为粉红色或红色,而O3处理果实的果皮颜色还保持着较大面积的黄色.当贮藏10 d后,对照果实果皮全部转为深红色,而O3处理的果实果皮颜色还没有完全转红(图1).


CIE⁃XYZ对照臭氧处理0d对照臭氧处理2d对照臭氧处理4dX15.07±1.02a15.07±1.02a17.08±2.35a16.27±0.65a19.28±2.95a16.13±2.29aY16.30±1.68a16.30±1.68a16.25±2.92a17.98±0.87a18.50±3.38a15.98±2.33aZ10.14±1.07a10.14±1.07a8.36±1.75a10.41±0.42a8.74±1.22a8.49±1.48aCIE⁃XYZ对照臭氧处理6d对照臭氧处理8d对照臭氧处理10dX16.63±0.47a17.82±1.84a14.08±0.82a16.72±1.28b12.51±0.71a17.25±1.44bY12.86±0.50a15.91±2.25b10.30±0.75a13.89±1.71b8.86±0.63a14.13±2.63bZ5.85±0.52a7.65±1.02b5.35±0.34a7.14±0.51b5.34±0.35b6.49±1.45a
图1O3处理对采后番茄果实果皮颜色的影响
Fig.1TheeffectofO3treatmentonpericarpcolorofpostharvesttomatofruit
2.2 O3处理抑制采后番茄果实的乙烯释放及呼吸速率
番茄是典型的呼吸跃变型果实,通过乙烯释放量的检测发现,对照果实乙烯释放量在第4 天急剧上升,随后显著下降,而O3处理后,乙烯释放量虽然也逐渐升高,但在第8 天才达到顶点,同时峰值相比对照也下降了20%左右(图2 a).通过对番茄呼吸速率的检测发现,对照和处理都呈现先上升后下降的趋势,对照果实的呼吸高峰在4 d左右出现,而O3处理后呼吸高峰延迟了2 d,且呼吸强度略有降低(图2 b).

图2 O3处理对采后番茄果实乙烯释放量(a)及呼吸速率(b)的影响Fig. 2 The effect of O3 treatment on ethylene production (a) and respiration rate (b) of postharvest tomato fruit
2.3 O3处理延缓采后番茄果实品质的下降
番茄果实软化过程是果胶物质溶液化同时伴随着细胞壁中胶层的溶解和初生壁的破坏,是果实成熟的判断标准之一.在贮藏前期,对照及O3处理的番茄果实抗压能力差异不大,但在贮藏6 d后,O3处理的番茄果实维持了较高的硬度(图3 a),有利于维持果实的商品性;TA是反映果实风味的重要因素之一,伴随贮藏时间的增加表现出降低趋势,O3处理延缓了番茄果实TA的下降速度,尤其在贮藏后期表现更为明显(图3 b);SSC是指果汁中能溶于水的糖、酸、维生素、矿物质等所有化合物的总称,O3处理明显延缓了番茄果实SSC含量的上升,常温贮藏10 d后,对照果实的SSC为7.5%,O3处理果实的SSC值在5.5%左右(图3 c);膜渗透率是反映膜系统状况的一个指标,通过胞内膜相对电导率检测发现,贮藏10 d后,对照果实膜渗透率上升至44%,处理果实的膜渗透率仍保持在33%左右,表明O3处理果实的细胞质膜完整性好于对照(图3 d).综上所述,O3能够维持采后番茄果实的品质,延缓番茄果实的成熟与衰老.
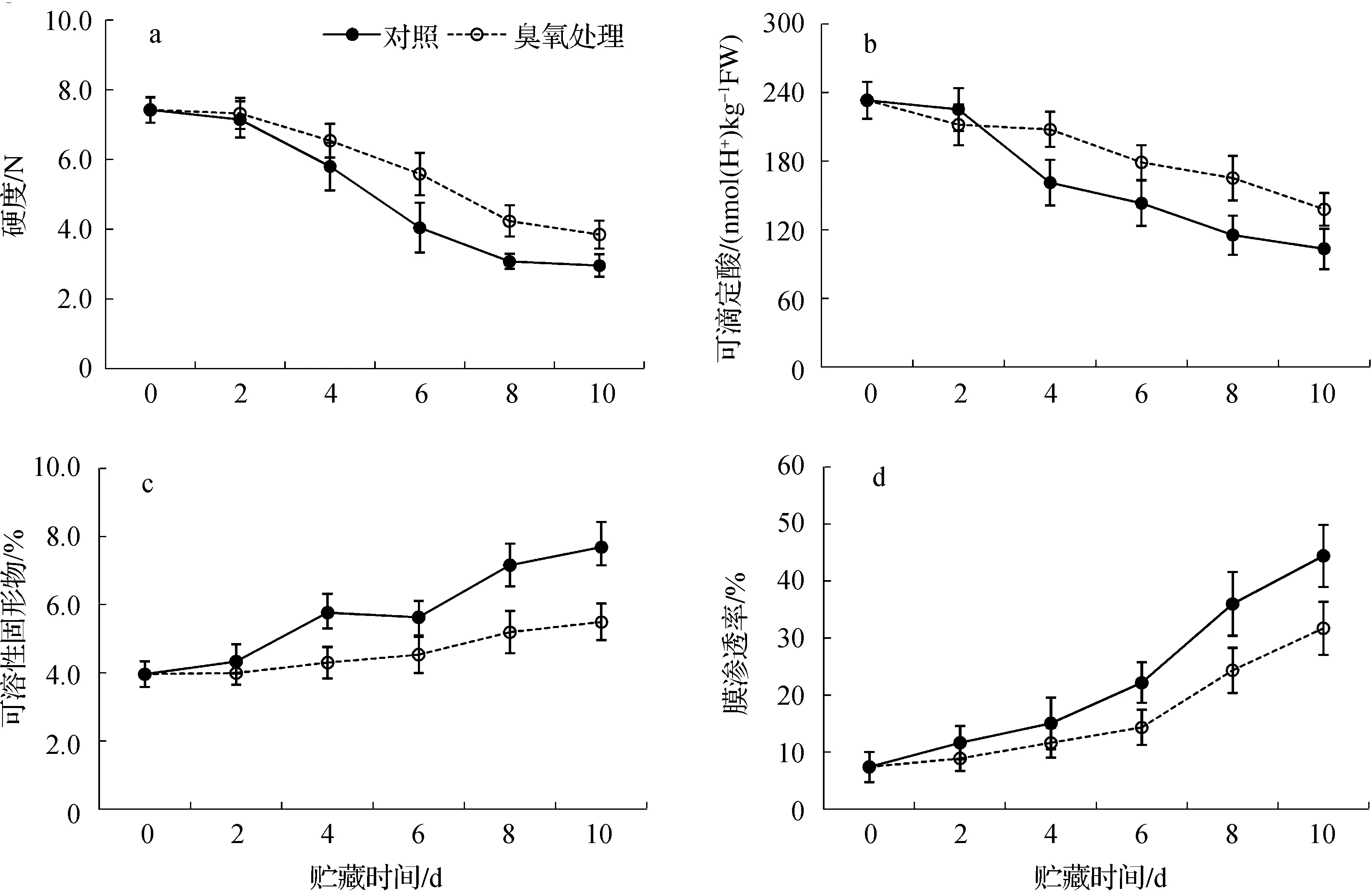
图3 O3处理对采后番茄果实硬度(a)、可滴定酸(b)、可溶性固形物含量(c)及膜渗透率(d)的影响Fig. 3 The effect of O3 treatment on firmness (a), titratable acid (b), soluble solids content (c) and membrane permeability (d) of postharvest tomato fruit
2.4 O3处理延缓采后番茄果实抗氧化酶活性下降
采后果实的衰老与活性氧的积累密切相关,在植物体内有效清除活性氧的酶促脱毒系统包括SOD、CAT、POD以及APX等.实验结果表明,在采后番茄贮藏期间,对照果实的SOD活性早期维持稳定,4 d后逐渐下降,O3处理果实的SOD活性则先呈上升趋势,2 d后逐渐下降,且各时间点活性明显高于对照(图4 a);无论是对照还是O3处理,果实中CAT的活性均呈现先上升后下降的趋势,前期二者酶活性水平变化不大,但是在贮藏后期,O3处理果实的CAT活性明显高于对照(图4 b);贮藏番茄果实中POD的活性检测结果与CAT的变化趋势较为相似,先上升再下降,贮藏后期略有波动,但O3处理果实的POD活性整体上高于对照(图4 c);APX活性在番茄果实贮藏期间表现出逐渐下降的趋势,O3处理果实的APX活性在前4 天明显高于对照,但随着贮藏时间的增加,与对照果实APX活性的差异不显著(图4 b).以上结果表明,O3处理使番茄果实维持了较高的抗氧化酶活性,有利于延缓番茄果实的成熟与衰老.
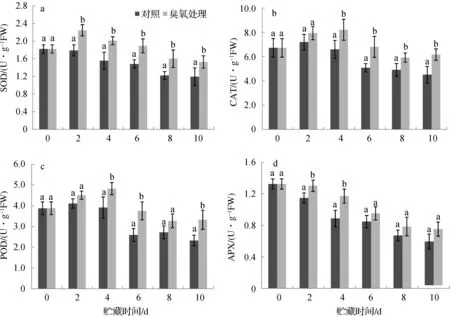
图4 O3处理对采后番茄果实SOD(a)、CAT(b)、POD(c)及APX(d)活性的影响Fig. 4 The effect of O3 treatment on SOD (a), CAT (b), POD (c) and APX (d) enzyme activities of postharvest tomato fruit
2.5 O3处理降低番茄灰霉病菌的危害
O3作为一种物理杀菌剂能够抑制霉菌的萌发和生长.在本实验中,利用3 μL/L O3处理B.cinerea孢子3 h后转移至PDB培养基中培养.结果表明,培养4 h后,对照孢子的体积和萌发率明显大于处理孢子,培养8 h后,90%以上的对照孢子均已萌发,而O3处理的孢子的萌发率仅为30%左右.培养8 h后,比较已萌发的孢子,发现对照孢子的芽管长度是O3处理孢子1.5倍以上.随后将O3处理的B.cinerea孢子进行活体接种,结果表明,相对于对照组100%的发病率,处理组番茄灰霉病的发病率显著降低,50%以上的果实没有发病.同时,处理组病斑的扩展速度明显低于对照组,接种4 d后,对照组病斑面积达到4.5 cm2,而处理组病斑面积仅为3.4 cm2(表1).以上结果表明,O3处理对番茄采后主要病害B.cinerea有明显的抑制作用.
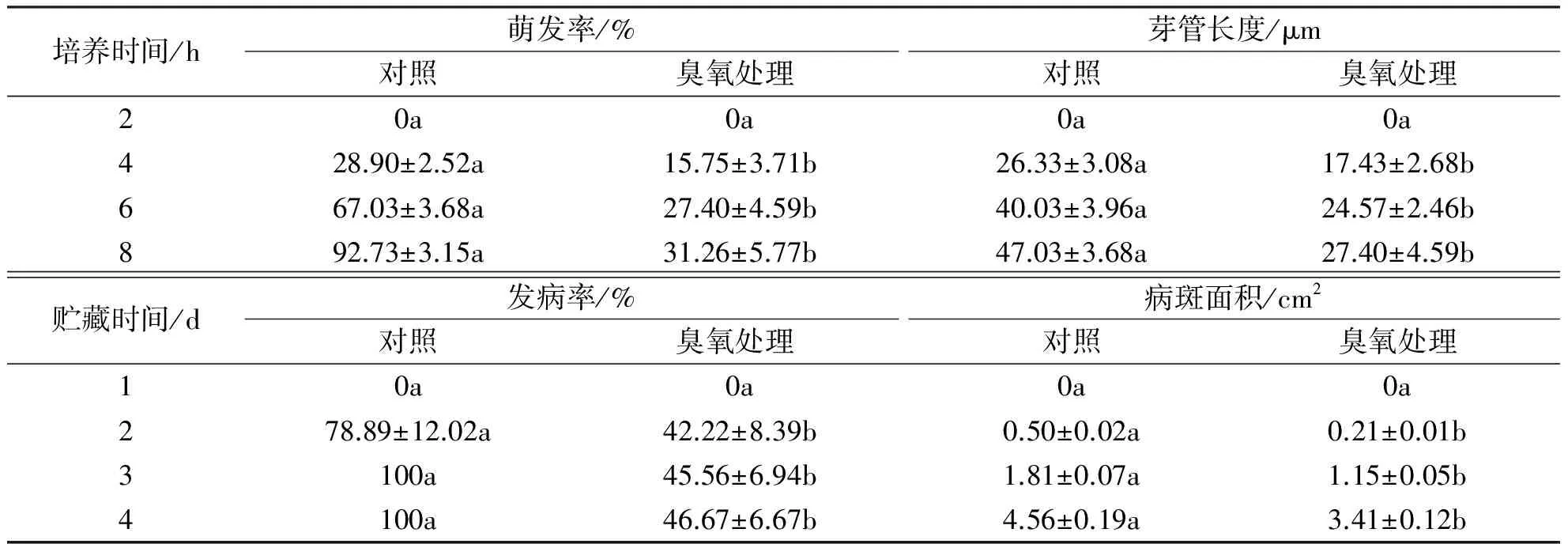
表1 O3处理对Botrytis cinerea生长及采后番茄灰霉病的抑制作用Tab. 1 The inhibitory effect of O3 treatment on Botrytis cinerea growth and gray mold disease of postharvest tomato fruit
3 讨 论
番茄果实采后损失主要来自两方面,一是果实后熟衰老过程中导致的品质劣变,二是微生物和病虫害引起的腐烂.本实验在常温下利用3±0.5 μL/L的O3处理破色期番茄,发现处理组番茄果实的乙烯释放量显著下降,并且果实的呼吸高峰和乙烯释放高峰均有推迟(图2),这与Hildebrand等研究结果一致.一方面O3快速分解具有催熟作用的乙烯气体,降低果实新陈代谢进程,减慢衰老过程,进而延长果蔬货架期[6].同时O3抑制1-氨基环丙烷-1-羧酸(ACC)合酶表达,导致果实内源乙烯合成中间产物ACC含量降低[17].
SSC、TA、果实色泽及硬度的变化,是反映果实品质变化的最常见指标.本研究结果表明,O3处理可延缓番茄果实贮藏过程中的果皮的转红(图1),同时延缓了SSC的上升、硬度下降,并使果实维持了一定酸度(图3a,b,c),这与Zambre等的研究结果是一致的,其原因可能是O3处理抑制了果实的呼吸强度,使作为呼吸基质的TA含量得到一定的保持[18].另外,有资料报道O3能抑制细胞壁降解相关酶类(果胶甲酯酶、多聚半乳糖醛酸酶和纤维素酶等)活性,减少了细胞壁水解酶作用引起的果实硬度下降[4].
番茄果实采后成熟衰老过程伴随着膜脂过氧化作用的发生、细胞膜结构的破坏及膜透性的增加.本研究发现O3处理后,番茄果实膜的完整性优于对照(图3d).此外,处理后果实保持较高的SOD、POD、CAT活性(图4a,b,c),这与Boonkorn等[3]的结果一致.抗氧化酶是果蔬细胞组织内主要的酶促过氧化物防御系统,它们协同作用以防御活性氧或其它过氧化物自由基对细胞膜系统的伤害.适当的O3处理能诱导果蔬的抗氧化酶活性,减弱膜脂过氧化作用,保持膜的稳定性,抑制膜透性的上升,减少果实腐烂[19].
Botrytiscinerea是番茄果实采后的主要病害,本研究结果表明O3能有效抑制B.cinerea孢子的萌发以及芽管伸长,并且显著降低番茄灰霉病的发病率及病斑面积(表1).O3通过与微生物细胞膜磷脂分子中的蛋白质或不饱和脂肪酸发生氧化反应,使微生物细胞膜的渗透性增大,细胞内容物外渗,从而致使微生物组织死亡[2,20].O3还可以快速渗入细胞内部,破坏微生物组织结构,致使DNA、RNA等大分子物质和与呼吸相关的酶类失活,从而达到杀菌的作用[9].
综上所述,O3能有效延缓破色期番茄果实常温贮藏过程中的后熟衰老,并对Botrytiscinerea导致的灰霉病有一定的抑制效果,保持了果实的商品性,延长了货架期.
[1] Karaca H, Velioglu Y S. Ozone applications in fruit and vegetable processing[J]. Food Reviews International,2007,23(1):91-106.
[2] Horvitz S, Cantalejo M J. Effects of ozone and chlorine postharvest treatments on quality of fresh-cut red bell peppers[J]. International Journal of Food Science & Technology,2012,47(9):1935-1943.
[3] Boonkorn P, Gemma H, Sugaya S,etal. Impact of high-dose, short periods of ozone exposure on green mold and antioxidant enzyme activity of tangerine fruit[J]. Postharvest Biology and Technology,2012,67:25-28.
[4] Rodoni L, Casadei N, Concellon A,etal. Effect of short-term ozone treatments on tomato (SolanumlycopersicumL.) fruit quality and cell wall degradation[J]. Journal of Agricultural and Food Chemistry,2010,58(1):594-599.
[5] Alothman M, Kaur B, Fazilah A,etal. Ozone-induced changes of antioxidant capacity of fresh-cut tropical fruits[J]. Innovative Food Science & Emerging Technologies,2010,11(4):666-671.
[6] Hildebrand P D, Forney C F, Song Jun,etal. Effect of a continuous low ozone exposure (50 nL·L-1) on decay and quality of stored carrots[J]. Postharvest Biology and Technology,2008,49(3):397-402.
[7] Hassenberg K, Idler C, Molloy E,etal. Use of ozone in a lettuce-washing process: an industrial trial[J]. Journal of the Science of Food and Agriculture,2007,87(5):914-919.
[8] Wang Hua, Feng Hao, Luo Yaguang. Microbial reduction and storage quality of fresh-cut cilantro washed with acidic electrolyzed water and aqueous ozone[J]. Food Research International,2004,37(10):949-956.
[9] Ozkan R, Smilanick J L, Karabulut O A. Toxicity of ozone gas to conidia ofPenicilliumdigitatum,Penicilliumitalicum, andBotrytiscinereaand control of gray mold on table grapes[J]. Postharvest Biology and Technology,2011,60(1):47-51.
[10] Sharpe D, Fan Lihua, McRae K,etal. Effects of ozone treatment onBotrytiscinereaandSclerotiniasclerotiorumin relation to horticultural product quality[J]. Journal of Food Science,2009,74(6):250-257.
[11] Akbas M Y, Ozdemir M. Effect of gaseous ozone on microbial inactivation and sensory of flaked red peppers[J]. International Journal of Food Science & Technology,2008,43(9):1657-1662.
[13] Tzortzakis N, Singleton I, Barnes J. Impact of low-level atmospheric ozone-enrichment on black spot and anthracnose rot of tomato fruit[J]. Postharvest Biology and Technology,2008,47(1):1-9.
[14] Karaca H, Walse S S, Smilanick J L. Effect of continuous 0.3 μL/L gaseous ozone exposure on fungicide residues on table grape berries[J]. Postharvest Biology and Technology,2012,64(1):154-159.
[15] Lai Tongfei, Wang Yuying, Li Boqiang,etal. Defense responses of tomato fruit to exogenous nitric oxide during postharvest storage[J]. Postharvest Biology and Technology,2011,62(2):127-132.
[16] Chan Zhulong, Tian Shiping. Induction of H2O2-metabolizing enzymes and total protein synthesis by antagonistic yeast and salicylic acid in harvested sweet cherry fruit[J]. Postharvest Biology and Technology,2006,39:314-320.
[17] Wu Jiguo, Luan Tiangang, Lan Chongyu,etal. Removal of residual pesticides on vegetable using ozonated water[J]. Food Control,2007,18(5):466-472.
[18] Zambre S S, Venkatesh K V, Shah N G. Tomato redness for assessing ozone treatment to extend the shelf life[J]. Journal of Food Engineering,2010,96(3):463-468.
[19] Vicente A R, Martinez G A, Chaves A R,etal. Effect of heat treatment on strawberry fruit damage and oxidative metabolism during storage[J]. Postharvest Biology and Technology,2006,40(2):116-122.
[20] Alexopoulos A, Plessas S, Ceciu S,etal. Evaluation of ozone efficacy on the reduction of microbial population of fresh cut lettuce(Lactucasativa) and green bell pepper(Capsicumannuum)[J]. Food Control,2013,30(2):491-496.
TheEffectsofOzoneTreatmentontheQualityofPostharvestTomatoFruit
PAN Jie, HUANG Yan, TONG Zhiying, LI Yan, LAI Tongfei, ZHOU Ting
(College of Life and Environmental Sciences, Hangzhou Normal University, Hangzhou 310036, China)
Tomatoes(Solanumlycopersicumcv. Ailsa Craig)at break stage were taken as raw materials in this research, and the effects of ozone with 3±0.5 μL/L for 3 h on the physiological and biochemical parameters as well as the quality of postharvest tomato fruit at room temperature were discussed. The results show that the ozone treatment can delay the respiratory climacteric, reduce the ethylene production, and maintain the quality of tomato fruit. The ozone treatment also results in the activities retention of antioxidant enzymes, such as superoxide dismutase (SOD), catalase (CAT) and peroxidase (POD), but has little effect on the ascorbate peroxidase (APX) activity. At the same time, the ozone treatment can remarkably inhibit the growth ofBotrytiscinereain vitro, and prevent the development of grey mold in vivo.
ozone; tomato;Botrytiscinerea; storage and preservation; fungistasis
2013-06-02
浙江省自然科学基金项目(LQ12C02005);浙江省教育厅基金项目(Y201225407).
周 婷(1983—),女,讲师,博士,主要从事农产品贮藏与加工技术研究.E-mail: zt20100061@163.com
10.3969/j.issn.1674-232X.2013.06.010
TS255
A
1674-232X(2013)06-0528-07
