水滑石负载手性席夫碱催化酮不对称硅氢加成
2013-10-28彭家建厉嘉云肖文军来国桥
王 磊,彭家建,白 赢,厉嘉云,肖文军,陈 峰,来国桥
(杭州师范大学有机硅化学及材料技术教育部重点实验室,浙江 杭州 311121)
水滑石负载手性席夫碱催化酮不对称硅氢加成
王 磊,彭家建,白 赢,厉嘉云,肖文军,陈 峰,来国桥
(杭州师范大学有机硅化学及材料技术教育部重点实验室,浙江 杭州 311121)
以水滑石为载体,负载一系列手性α-氨基酸席夫碱来催化潜手性酮硅氢加成反应,继而水解得到手性二级醇.结果表明,在催化苯乙酮和三乙氧基硅烷的硅氢加成反应中,转化率达95%以上,ee值达57%.
不对称催化硅氢加成; 潜手性酮; α-氨基酸席夫碱; 水滑石
光学活性醇在药物、农药、香料等精细化工方面的应用十分广泛,找到一种经济高效的合成方法是一项非常有意义的研究.又由于潜手性酮是一类非常常见的还原底物,因此潜手性酮不对称还原制备光学活性醇引起了学术研究和工业应用的浓厚兴趣[1-4].潜手性酮的不对称硅氢加成反应是潜手性酮不对称还原方法之一,即潜手性酮在催化剂作用下先和含氢硅烷形成硅醚,然后经过水解作用,得到高纯度、高立体选择性的二级醇.与以铑作催化剂的不对称催化加氢反应和以手性硼氢烷或手性噁唑硼氢试剂还原酮的两种成熟方法相比,不对称硅氢加成反应表现出操作程序简便、氢硅烷便宜、稳定、无毒等优异性能[5].在潜手性酮的不对称催化方面,已经研发出了多种不对称硅氢加成反应金属催化剂,此类方法具有条件温和、转化率高、无需耐高压技术、可操作性强等优点,已经得到了一定程度上的工业应用[6-9].已有的研究结果表明,水滑石负载叔丁醇钾对苯乙酮硅氢加成反应有很好的催化效果.水滑石中加入锌、铜元素可以明显提高催化剂活性.当n(Zn)∶n(Mg)∶n(Al)为2∶1∶1时,Zn-Mg-Al-O-t-Bu催化苯乙酮硅氢加成的转化率达到99.0%.当n(Cu)∶n(Mg)∶n(Al)=2∶1∶1时,Cu-Mg-Al-O-t-Bu催化苯乙酮的转化率达到98.0%[10].本课题组的研究表明α-氨基酸水杨醛席夫碱配体与二乙基锌催化剂体系催化苯乙酮的不对称硅氢加成反应时,立体选择性可以达到96%,这是目前锌催化体系催化苯乙酮的不对称硅氢加成反应中最高的光学选择性,同时产率也达到了71%[11].
本文报道以水滑石为载体负载α-氨基酸水杨醛席夫碱催化潜手性酮不对称硅氢加成,继而水解合成手性二级醇,详细考察了反应温度、溶剂、不同硅烷等对硅氢加成反应的影响.
1 实验部分
1.1 主要试剂及仪器
1H NMR和13C NMR在Bruker400MHz(用DMSO-d6为溶剂,TMS为内标,以ppm为单位)上测定.红外色谱用Nicolet-5700 FT-IR测定.气相色谱仪使用上海科创色谱仪器有限公司生产的GC9800,毛细管柱为CP-ChiralSil-Dex CB 柱.高效液相色谱用Waters公司的高效液相色谱仪测定,手性柱为Chiralcel OD.
3,5-二叔丁基水杨醛和所有的α-氨基酸均购自安耐吉试剂公司,叔丁醇钾、硝酸镁、硝酸铝、氢氧化钠、硝酸锌、硝酸铜等以及所需溶剂均从国药集团化学试剂有限公司购置,硅胶(100~200 mesh)产自青岛海洋化工有限公司.
1.2 Zn-Mg-Al水滑石的制备[10,12]
将一定量的硝酸锌、硝酸镁和硝酸铝混合物(物质的量比为2∶1∶1)溶解在100 mL蒸馏水中.室温,氮气保护下,搅拌状态下滴加2 mol/L的NaOH溶液,直至溶液pH为10.搅拌反应2 h,然后过滤,80 ℃干燥即制备得到水滑石.
1.3 α-氨基酸席夫碱的制备[11]
席夫碱1~6(图1)的制备:以L-缬氨酸3,5-二叔丁基水杨醛席夫碱为例介绍1~6的合成方法.在100 mL的烧瓶中,加入0.31 g (5.5 mmol) KOH和15 mL甲醇搅拌使其溶解,并保持在冰水浴中,再向溶液中加入5.5 mmol的 L-缬氨酸,充分搅拌使其全部溶解.加入5 mmol 3,5-二叔丁基水杨醛甲醇(15 mL)溶液,溶液立刻变成亮黄色,再继续搅拌2 h停止反应.反应液用旋转蒸发仪旋干,所得固体用正己烷(10 mL)-乙醚(10 mL)混合液溶解,过滤除去不溶的杂质,滤液旋蒸除去溶剂,得到亮黄色粉末状固体L-缬氨酸水杨醛席夫碱,把配体贮存于CaCl2的干燥器中.

图1 Schiff 碱结构Fig. 1 Structures of Schiff base ligands prepared
2 结果与讨论
2.1 合成产物的核磁表征
氨基酸席夫碱的氢谱和碳谱数据如下.
席夫碱1:Yellow powder, Yield, 1.5 g (81%);1H NMR (DMSO-d6, 400 MHz) δ 8.253 (s, 1H), 7.161 (d,J= 2.4 Hz, 2H), 3.375 (d,J= 5.2 Hz,1H), 2.191~2.289 (m, 1H), 1.361 (s, 9H), 1.233 (s, 9H), 0.859 (bm, 3H), 0.841 (bm, 3H);13C NMR (DMSO-d6, 100 MHz), δ 173.14, 164.77, 162.48, 137.58, 137.01, 126.28, 117.54, 79.08, 35.04, 34.14, 31.77, 31.40, 29.78, 20.8, 18.92.
席夫碱2:Yellow powder, Yield, 1.5 g (81%);1H NMR (DMSO-d6, 400 MHz) δ 8.251 (s, 1H), 7.160 (d,J= 2.4 Hz, 2H), 3.374 (d,J= 5.2 Hz, 1H), 2.191~2.289 (m, 1H), 1.360 (s, 9H), 1.232 (s, 9H), 0.859 (s, 3H), 0.841 (s, 3H);13C NMR (DMSO-d6, 100 MHz), δ 173.12, 164.75, 162.49, 137.55, 137.01, 126.26, 117.53, 79.07, 35.04, 34.13, 31.76, 31.40, 29.76, 20.8, 18.92.
席夫碱3:Yellow powder, Yield, 1.6 g (83%);1H NMR (DMSO-d6, 400 MHz) δ 8.267 (s, 1H), 7.163 (d,J= 2.0 Hz,2H), 3.457 (d,J= 5.6 Hz, 1H), 1.978~2.040 (m, 1H), 1.358 (s, 9H), 1.232 (s, 9H), 1.025~1.069 (m, 2H), 0.855 (m, 3H), 0.838 (m, 3H);13C NMR (DMSO-d6, 100 MHz), δ 173.45, 164.75, 162.33, 137.63, 136.97, 126.24, 117.60, 78.56, 38.05, 35.01, 34.09, 31.74, 29.78, 25.27, 16.94, 12.01.
席夫碱4:Yellow powder, Yield, 1.3 g (76%);1H NMR (DMSO-d6, 400 MHz) δ 8.335 (s, 1H), 7.164 (d,J= 2.4 Hz,2H), 3.757 (t,J= 6.8 Hz,1H), 1.358 (s, 9H), 1.358 (bm, 3H), 1.236 (s, 9H);13C NMR (DMSO-d6, 100 MHz), δ 173.89, 164.19, 162.83, 137.44, 137.20, 126.61, 126.40, 117.42, 66.67, 35.04, 34.15, 31.77, 29.79, 20.92.
席夫碱5:Yellow powder, Yield, 1.5 g (78%);1H NMR (DMSO-d6, 400 MHz) δ 8.342 (s, 1H), 7.179 (d,J= 2.4 Hz,2H), 3.701 (dd,J1= 4.8 Hz,J2= 4 Hz, 1H), 1.572~1.731 (m, 2H), 1.468~1.571 (m, 1H), 1.354 (s, 9H), 1.233 (s, 9H), 0.879 (d,J= 6.8 Hz, 3H), 0.842 (d,J= 6.4 Hz, 3H);13C NMR (DMSO-d6, 100 MHz), δ 174.14, 164.76, 161.54, 137.97, 136.74, 126.30, 117.78, 71.30, 43.47, 34.99, 34.12, 31.76, 29.77, 25.07, 23.93, 22.12.
席夫碱6:Yellow powder, Yield, 1.6 g (83%);1H NMR (DMSO-d6, 400 MHz) δ 8.342 (s, 1H), 7.179 (d,J= 2.4 Hz,2H), 3.701 (d,J= 4.8 Hz,1H), 1.572~1.730 (m, 1H), 1.468~1.570 (m, 1H), 1.354 (s, 9H), 1.233 (s, 9H), 0.879 (d,J= 6.8 Hz, 3H), 0.841 (d,J= 6.4 Hz, 3H);13C NMR (DMSO-d6, 100 MHz), δ 173.34, 164.77, 161.48, 137.58, 136.71, 126.30, 117.77, 71.30, 43.47, 34.98, 34.12, 31.75, 29.78, 25.06, 23.92, 22.12.
2.2 合成水滑石的红外表征
合成的水滑石的红外表征如图2所示.
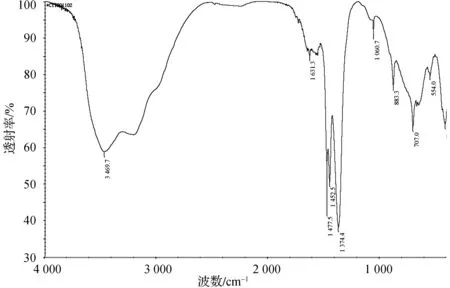
图2 制备水滑石红外测试图Fig. 2 IR of hydrotalcite
3 催化酮的不对称硅氢加成反应

图3 酮的硅氢加成反应式Fig. 3 Asymmetric hydrosilylation of ketone with silan
3.1 催化剂的制备
将制备的水滑石、α-氨基酸水杨醛席夫碱以及叔丁醇钾按照一定的比例(1.0 g水滑石+1.0 g配体+0.3 g叔丁醇钾)在THF溶液中搅拌5 h,减压除去溶剂即可得到催化剂.
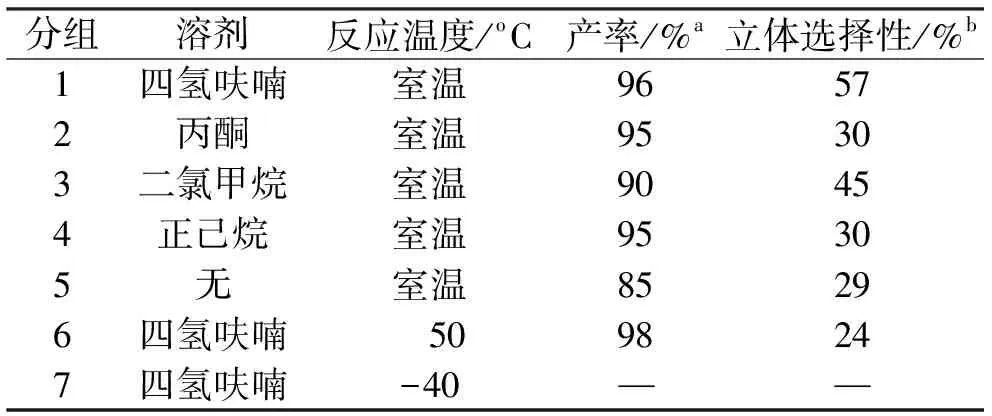
表1 不同溶剂和温度对硅氢加成反应的影响Tab. 1 Solvent and temperature screening for the asymmetrichydrosilylation
反应条件:苯乙酮1.0 mmol,三乙氧基硅烷2.5 equiv.,催化剂0.03 g,四氢呋喃/叔丁醇(V(四氢呋喃)/V(叔丁醇),3∶0.4),室温下反应,24 h;a:分离产率;b:立体选择性,用装有CP-ChiralSil-Dex CB柱的气相测得.
3.2 不同溶剂和温度对硅氢加成反应的影响
以三乙氧基氢硅烷为氢源、THF/t-BuOH(V(THF)/V(t-BuOH)=3∶0.4)为溶剂的条件下,用缬氨酸席夫碱/Zn-Mg-Al水滑石催化苯乙酮的不对称硅氢加成反应,结果列于表1.可见,不同溶剂对苯乙酮的不对称硅氢加成反应有一定的影响.四氢呋喃作为溶剂时,效果最好,这大概和四氢呋喃的极性适中有关.无溶剂时,苯乙酮加氢反应的产率和立体选择性都较差,这可能是反应物不能充分接触所致.表中结果还表明高温对于立体选择性有较大影响,而低温下催化剂活性很低,在室温下效果最佳,这也是该系列催化剂的一大亮点.
3.3不同席夫碱制备的催化剂对硅氢加成反应的催化性能
以三乙氧基氢硅烷为氢源,THF/t-BuOH(V(THF)/V(t-BuOH)=3∶0.4)为溶剂,在室温下,用席夫碱1~6/Zn-Mg-Al水滑石催化苯乙酮的不对称硅氢加成反应,结果列于表2.可以发现这类催化剂表现出优异的催化性能,席夫碱扮演着非常重要的作用,其中以1和2的催化效果最好,不对称选择性分别达到57%和52%,而其它的立体选择性则相对差一些.

表2 不同席夫碱/水滑石催化剂催化硅氢加成反应
反应条件:苯乙酮1.0 mmol,三乙氧基硅烷2.5 equiv.,催化剂0.03 g,四氢呋喃/叔丁醇(V(四氢呋喃)/V(叔丁醇),3∶0.4),室温下反应,24 h;a:分离产率;b:立体选择性,用装有CP-ChiralSil-Dex CB柱的气相测得.
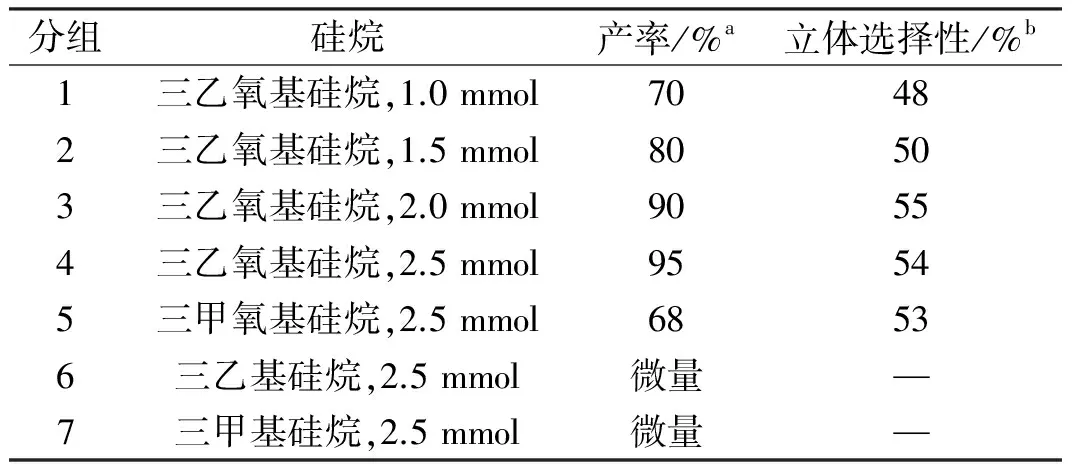
表3 三乙氧基氢硅烷用量及其它不同氢硅烷对反应的影响
反应条件:苯乙酮1.0 mmol,催化剂 0.03 g,四氢呋喃/叔丁醇(V(四氢呋喃)/V(叔丁醇),3∶0.4),室温下反应,24 h;a:分离产率;b:立体选择性,用装有CP-ChiralSil-Dex CB柱的气相测得.
3.4 三乙氧基氢硅烷用量及其它不同氢硅烷对反应的影响
选用席夫碱1/水滑石,在室温条件下催化苯乙酮的不对称硅氢加成反应,考察三乙氧基硅烷用量及不同氢硅烷对反应的影响,结果见表3.结果表明,苯乙酮的转化率随着三乙氧基硅烷用量的增加而增加,n(三乙氧基硅烷)/n(苯乙酮)=2.5时,苯乙酮产率达到71%.三乙氧基硅烷、三甲氧基硅烷与苯乙酮加成反应具有较高的产率,并且反应的不对称选择性没有太大的区别,而三乙基硅烷、二甲基苯基硅烷和苯乙酮没有反应.这可能是因为相对于乙基、甲基而言,三乙氧基、三甲氧基更加容易使Si上的氢解离.
4 结 论
本研究合成了一系列新型的α-氨基酸水杨醛席夫碱,并将其负载到水滑石,进而催化潜手性酮不对称硅氢加成反应.结果发现这类催化剂有较高的催化活性和立体选择性,尤其是当使用L-缬氨酸与3,5-二叔丁基水杨醛合成的席夫碱作为配体,与Zn-Mg-Al水滑石组成的负载型催化剂催化苯乙酮的不对称硅氢加成反应时,不对称选择性ee值可以达到57%,产率达到95%.同时探究了反应温度、不同硅烷和溶剂对催化反应的影响.这一类新型的席夫碱/水滑石催化体系具有廉价、合成简单、催化效率(产率和光学选择性)高、反应条件温和、较环保等一系列优点.
[1] Beller M, Bolm C.Transition metals for organic synthesis: Vol 2[M]. Weinheim: Wiley-VCH,2004.
[2] Wishka D G,Graber D R, Seest E P,etal. Stereoselective synthesis of furo[2,3-c]pyridine pyrimidine thioethers, a new class of potent HIV-1 non-nucleoside reverse transcriptase inhibitors[J]. J Org Chem,1998,63(22):7851-7859.
[3] Collins A N,Sheldrake G N,Crosby J.Chirality in industry II:developments in the manufacture and applications of optically active compounds[M]. New York: Wiley,1997:99.
[4] Mimoun H,de Saint Laumer J Y,Giannini L,etal. Enantioselective reduction of ketones by polymethylhydrosiloxane in the presence of chiral zinc catalysts[J]. J Am Chem Soc,1999,121(26):6158-6166.
[5] Patai S, Rappoport Z.Chemistry of organic silicon compounds:Vol 2[M]. New York: Wiley,1998:1687-1792.
[6] Malacea R, Poli R, Manoury E. Asymmetric hydrosilylation, transfer hydrogenation and hydrogenation of ketones catalyzed by iridium complexes[J]. Coord Chem Rev,2010,254(5):729-752.
[7] Trost B M, Fleming I.Comprehensive organic synthesis:Vol 8[M]. New York: Pergamon,1991:139.
[8] Junge K,Schröder K,Beller M. Homogeneous catalysis using iron complexes: recent developments in selective reduction[J]. Chem Commun,2011,47(17):4849-4859.
[9] Rossiter K J. Structure-odor relationships[J]. Chem Rev,1996,96(8):3201-3240.
[10] Chen Yaoyun,Bai Ying,Peng Jiajian,etal. Hydrosilylation of ketones catalyzed with Mg-Al-O-t-Bu hydrotalcite[J]. Synth Commun,2011,41(24):3689-3694.
[11] Liu Shuai,Peng Jiajian,Yang Hu,etal. Highly efficient and convenient asymmetric hydrosilylation of ketones catalyzed with zinc schiff base complexes[J]. Tetrahedron,2012,68(5):1371-1375.
[12] Choudary B M, Kantam M L, Kavita B,etal. Aldol condensations catalysed by novel Mg-Al-O-t-Bu hydrotalcite[J]. Tetrahedron Lett,1998,39(21):3555-3558.
AsymmetricHydrosilylationofProchiralKetoneCatalyzedwithSchiffBaseSupportedonHydrotalcite
WANG Lei, PENG Jiajian, BAI Ying, LI Jiayun, XIAO Wenjun, CHEN Feng, LAI Guoqiao
(Key Laboratory of Organosilicon Chemistry and Material Technology of Ministry of Education, Hangzhou Normal University,Hangzhou 311121, China)
The exploration for economical and effective synthesis methods of chiral alcohols is a rewarding research, owing to the numerous applications in the fields of pharmaceuticals, flavors, cosmetics and agrochemicals. Using a new method with a series of chiral α-amino acid schiff base supported on hydrotalcite as catalyst to catalyze the prochiral ketones hydrosilylation reaction, chiral secondary alcohols were obtained after the hydrolysis. The results indicate that the conversation rate is above 95% andeevalue is up to 57% in the hydrosilylation of catalyzing acetophenone and triethoxysilane.
catalytic asymmetric hydrosilylation; prochiral ketones; α-amino acid schiff base; hydrotalcite
2013-09-11
国家自然科学基金青年科学基金项目(21203049).
彭家建(1966—),男,研究员,博士,主要从事催化化学研究.E-mail:jjpeng@hznu.edu.cn
10.3969/j.issn.1674-232X.2013.06.001
TQ426.6
A
1674-232X(2013)06-0481-05
