植酸酶高产菌株的选育
2013-10-28李彦芹李春青周洁芳庞志多王凤华
李彦芹,李春青,周洁芳,庞志多,王凤华
(河北大学 生命科学学院,河北 保定 071002)
植酸酶高产菌株的选育
李彦芹,李春青,周洁芳,庞志多,王凤华
(河北大学 生命科学学院,河北 保定 071002)
从土壤中分离到1株植酸酶高产菌株Pe0,初步鉴定为米曲霉.为了提高植酸酶活力,对Pe0菌株分别进行紫外线和亚硝基胍诱变处理,经初筛、复筛、遗传稳定性能检测,得到1株酶活相对较高、性状相对稳定的菌株Pe2#,酶活稳定在10.66 U/mL,较原始菌株提高到3.34倍.另对其发酵条件进行优化,确定最适接种量为4%,最适pH为5.5,最适培养时间为6.5 d.在此基础上进行培养基正交优化,结果表明:葡萄糖质量浓度为25 g/L,蛋白胨质量浓度为4 g/L,(NH4)2SO4质量浓度为2 g/L,MgSO4·7H2O质量浓度为0.1 g/L时所得菌株产酶活力最高.
植酸酶;诱变;选育;发酵优化
植酸(肌醇六磷酸)及其盐类是植物种子中磷普遍存在的形式,是植酸性饲料中普遍存在的一种抗营养因子,因其在吸收过程中易于和动物肠道内的金属离子,如Ca2+,Zn2+,Fe2+,Cu2+等,以及与蛋白质形成不溶性络合物[1],所以在生物体内的利用率很低.植酸酶(phytase)是催化植酸和植酸盐水解成肌醇和六磷酸的一类酶的总称,系统名称为肌醇六磷酸酶,是一类特殊的酸性磷酸酶,可以抑制植酸对矿物质和蛋白质的亲和,解除植酸的抗营养作用,增加磷的利用率,降低农业生态负担.目前在婴儿食品、饲料的添加剂、废弃物处理等领域发挥重要作用.本实验对分离纯化的菌株Pe0进行诱变选育,获得产酶活力高的突变株,并对其进行性状稳定性研究及发酵条件优化,旨在得到产酶活力较高、性状相对稳定的菌株,以期对生产实践及科学研究提供一定的参考.
1 材料
1.1菌种
菌株Pe0,本实验室分离纯化菌种.
1.2试剂及培养基
甲酰胺,亚硝基胍,三重蒸馏水, pH 5.5的醋酸缓冲液,植酸钠溶液,钼酸铵试剂,钒酸铵试剂,钒钼酸铵显色/终止液,乳酸石炭酸棉蓝染液;查氏培养基,初筛产酶培养基[2],液体发酵培养基[2].
1.3实验仪器
ZHWY-2102型双层大容量全温度恒温培养振荡器(上海智城分析仪器);TDL-5型台式低速离心机(上海安亭科学仪器厂);722E可见分光光度计(上海光谱仪器).
2 方法
2.1鉴定
将Pe0菌株根据《中国真菌志》[3]进行菌种鉴定,观察其菌落、分生孢子穗、分生孢子等的特征.
2.2酶活测定
取4支10 mL离心管,其中1支作空白对照,分别加入3.0 mL植酸钠溶液,置于37 ℃水浴锅中预热5 min,然后每隔1 min依次在反应管中加入1.0 mL植酸酶提取液,在37 ℃水浴锅中温育30 min,每隔1 min加入4.0 mL钒钼酸铵显色/终止液,然后在空白管中加入1.0 mL植酸酶提取液,混合摇匀,4 000 r/min离心10 min.于415 nm波长处测吸光度,参照磷标准曲线计算酶活[4].
植酸酶酶活定义:在温度为37 ℃,pH 5.5 的条件下,每min从浓度为5.0 mmol/L 植酸钠溶液中释放1 μmol无机磷,即为1个植酸酶活性单位,以U 表示[5].磷浓度标准曲线见图1.
酶活力单位定义:在37 ℃、pH 5.5条件下,在植酸钠溶液中每min释放1 nmol无机磷所需要的酶量为1个酶活力单位.
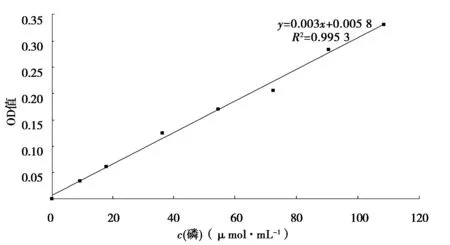
图1 磷标准曲线
2.3诱变处理
将菌株Pe0转接到查氏培养基上28 ℃培养7 d进行活化.制备1~5×106mL-1的孢子悬液,分别进行紫外线(15 W紫外灯30 cm处充分照射3,5,7,9 min)和亚硝基胍(300,400,500,600 μg / mL)的单因子诱变.经过中间培养,初筛、复筛并采用钒-钼酸铵法测酶活力,筛选酶活更高的菌株.
2.4菌株产酶稳定性测定
将复筛得到的酶活高的菌株接种到液体发酵培养基上传代培养5代,每代测定其酶活,判断其遗传稳定性.
2.5发酵条件优化
对获得的遗传性能稳定的菌株分别进行接种量、pH、发酵时间[6]及培养基成分的优化.
3 结果及讨论
3.1菌种鉴定
将菌株Pe0接种于查氏固体培养基,28 ℃培养4 d后,菌落直径平均为2.0 cm.最初菌落质地疏松,为白色,后转为黄色、黄褐色.分生孢子头呈放射状,其分生孢子梗有横隔,分生孢子为球形或椭圆形(图2).根据《真菌鉴定手册》初步鉴定为米曲霉(Aspergillusoryzae).
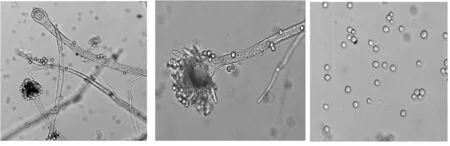
图2 菌丝及孢子形态
3.2菌株的诱变
诱变得到200个菌株,对其中透明圈与菌落直径比值较大的9株进行复筛,其酶活测定结果见表1.

表1 菌株选育结果
诱变前后对比,菌落形态发生了一些变化:经紫外线诱变后的平板菌落比原始菌平板菌落大且厚实.这说明菌体经紫外线诱变作用,菌体基因确实受到影响,内在基因的变化导致菌体表观的改变,诱变效果较明显.经亚硝基胍处理的菌落形态无明显变化.
紫外线诱变使植酸酶酶活由原来的3.19 U/mL最大增加到18.00 U/mL,为原始菌株的5.61倍;经亚硝基胍诱变后,植酸酶酶活由原来的3.19 U/mL最大增加到22.81 U/mL,为原始菌株的7.15倍.由此可见,透明圈与菌落直径比与酶活有一定的关系,但不完全是正相关.综合比较舍弃Pe1#,Pe1,Pe3.
3.3遗传稳定性
将筛选出的Pe2#,Pe3#,Pe4#,Pe2,Pe4,Pe5菌株进行遗传稳定性检测,其结果如表2所示.
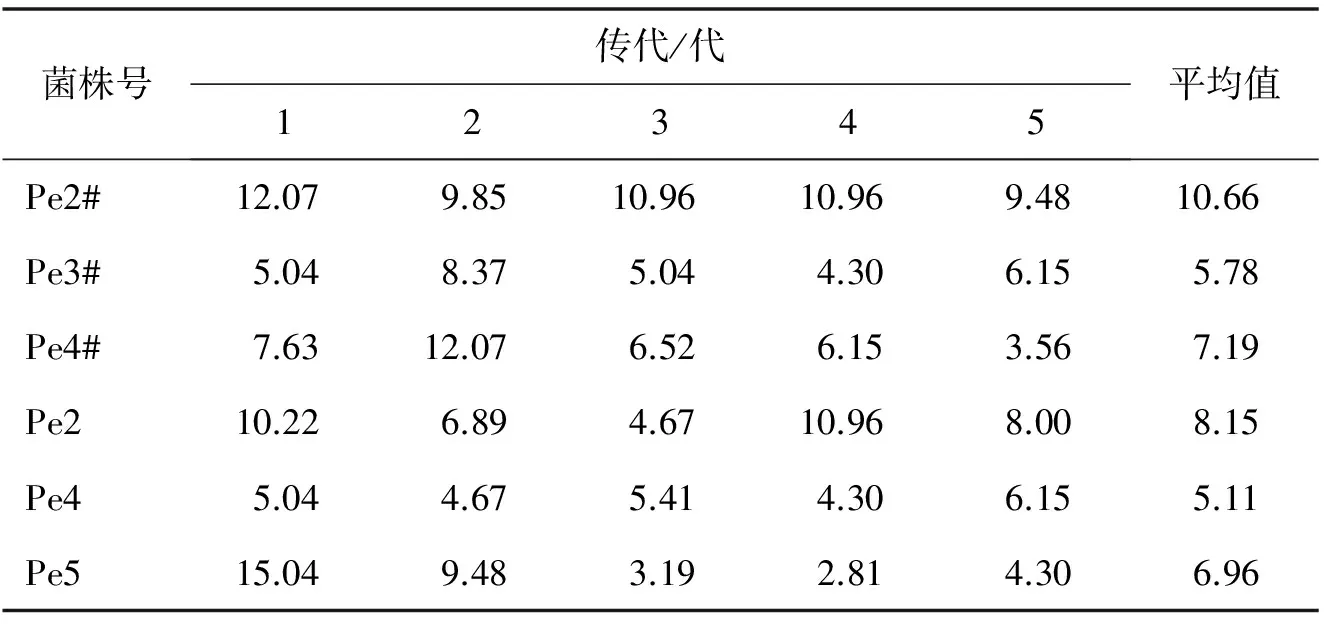
表2 遗传稳定性检测结果
比较表2各菌株传代的平均酶活,并进行方差分析,其稳定性最好的菌株为Pe2#,结果如表3,表4.
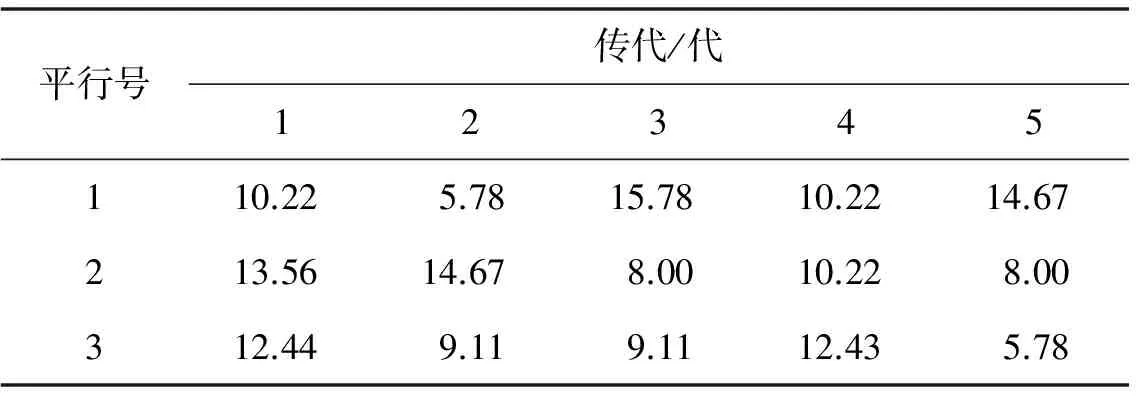
表3 诱变菌株Pe2#的稳定性
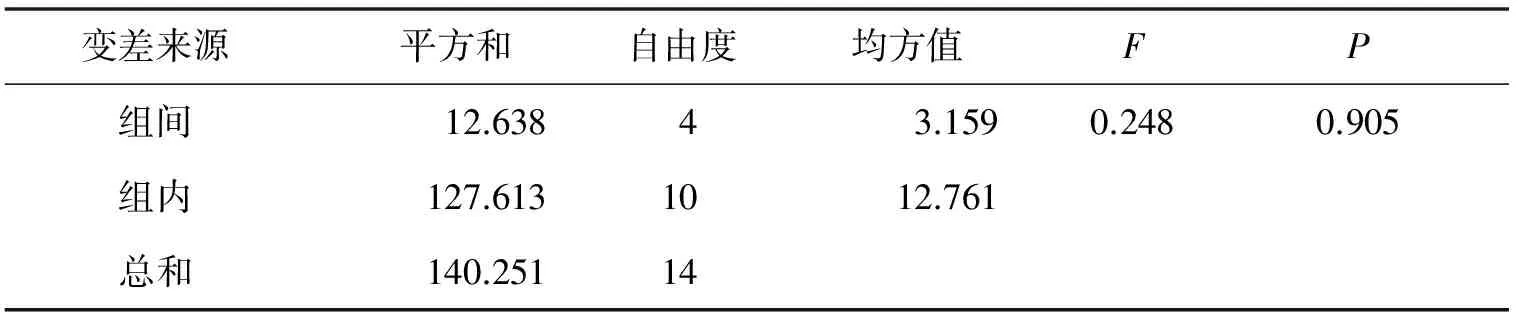
表4 Pe2#菌株传代次数的方差分析
由表4的均方值看出,Pe2#菌株具有较好的遗传稳定性.通过方差分析,其组间差异的P值远远大于0.05,说明传代次数对酶活性变化影响不显著,即传代次数未对其产酶活性产生影响,表明其具有稳定的遗传性,因此对该株菌进行下一步的研究.
3.4发酵条件优化
3.4.1 最适接种量、pH、发酵时间的确定
由图3可知,随接种量增加,酶活也不断地增加,接种量为4%时,酶活达到最高,接种量接近7%时,酶活很低,可能由于接种量过大引起菌种内部竞争,营养物质缺乏,产酶能力降低.
由图4可以看出,最适pH为5.5.当pH低于5.5时,酶活在pH 4.5时高于pH 5,可能是由于粗酶液中含有植酸酶多种同功酶所致.当处于碱性环境中,基本不产酶,但在pH 6.5时出现1个小峰值,可能是在此条件下酶活部分恢复所致[7].
由图5可知,4~6 d,酶活逐渐增加,培养至6.5 d时,酶活显著提高并达到最高,随着培养时间的增长,酶活反而降低.所以其最适培养时间为6.5 d.
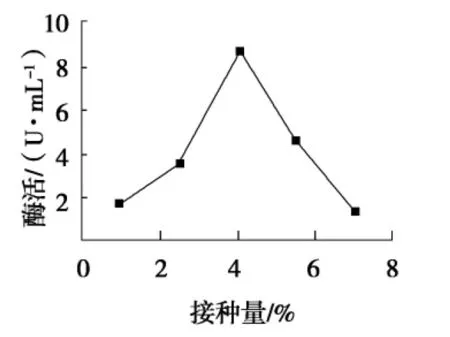
图3 接种量对酶活的影响
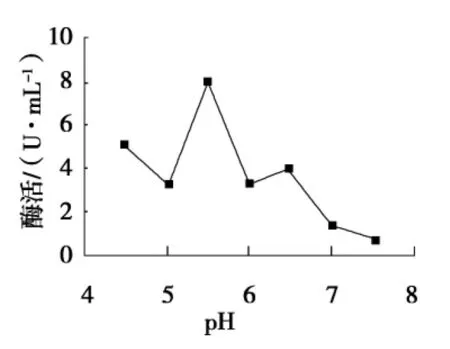
图4 pH对酶活的影响
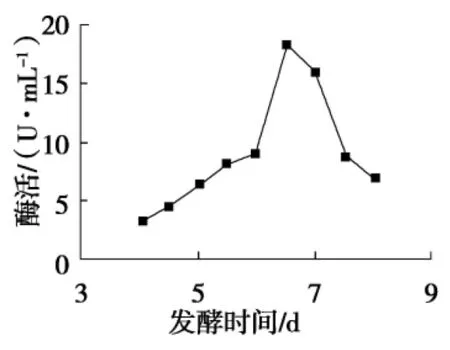
图5 发酵时间对酶活影响
3.4.2 培养基成分优化的正交实验结果及分析
采用L9(34)正交实验(表5)测定培养基中葡萄糖(A),蛋白胨(B),(NH4)2SO4(C),MgSO4·7H2O(D),对Pe2#菌株产酶的影响.

表5 正交实验因素水平
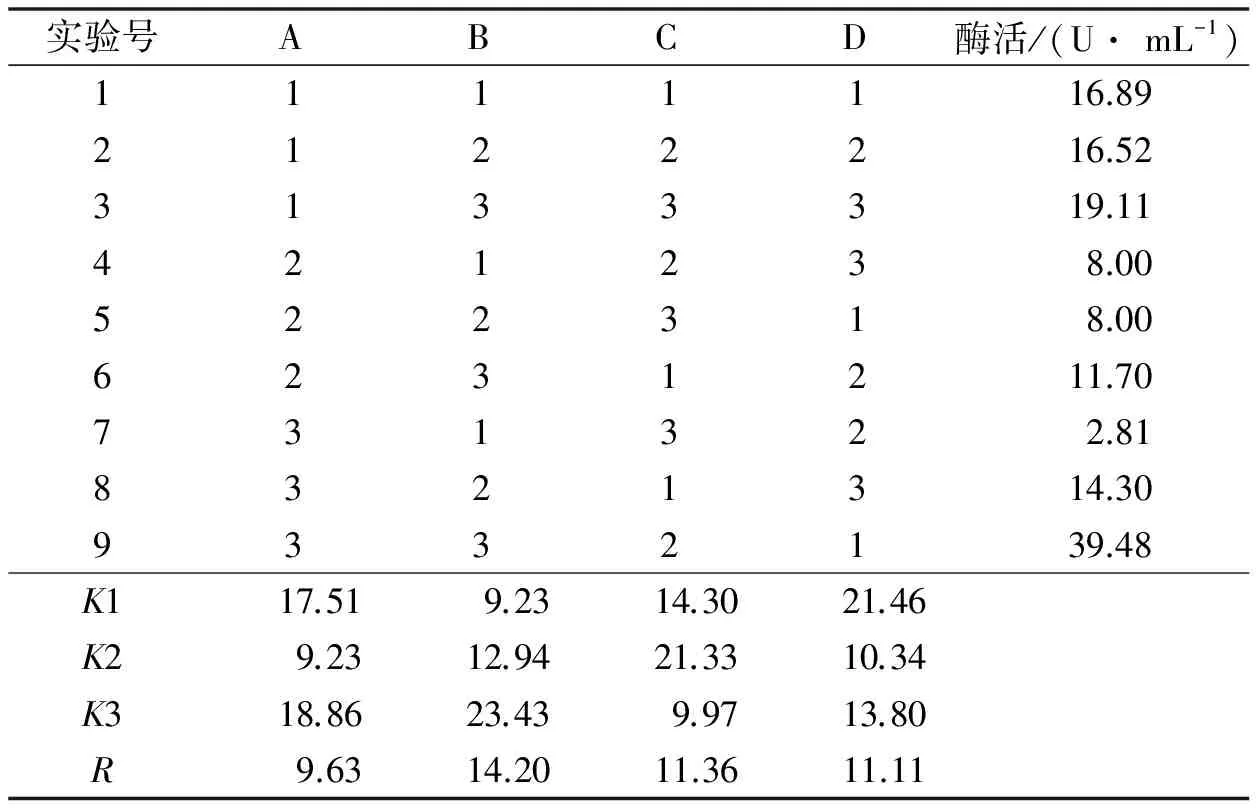
表6 L9(34)正交表及实验分析
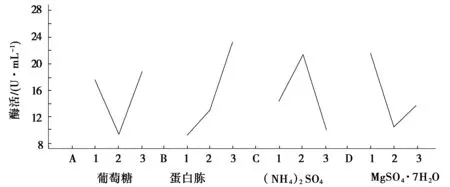
图6 正交各因素水平效应
由表6的R值数据及图6综合分析,各因素对产酶影响的大小依次为蛋白胨(B)>(NH4)2SO4(C)>MgSO4·7H2O(D)>葡萄糖(A),其最佳组合为A3B3C2D1,即葡萄糖的质量浓度为25 g/L,蛋白胨质量浓度为4 g/L,(NH4)2SO4的质量浓度为2 g/L,MgSO4·7H2O的质量浓度为0.1 g/L .
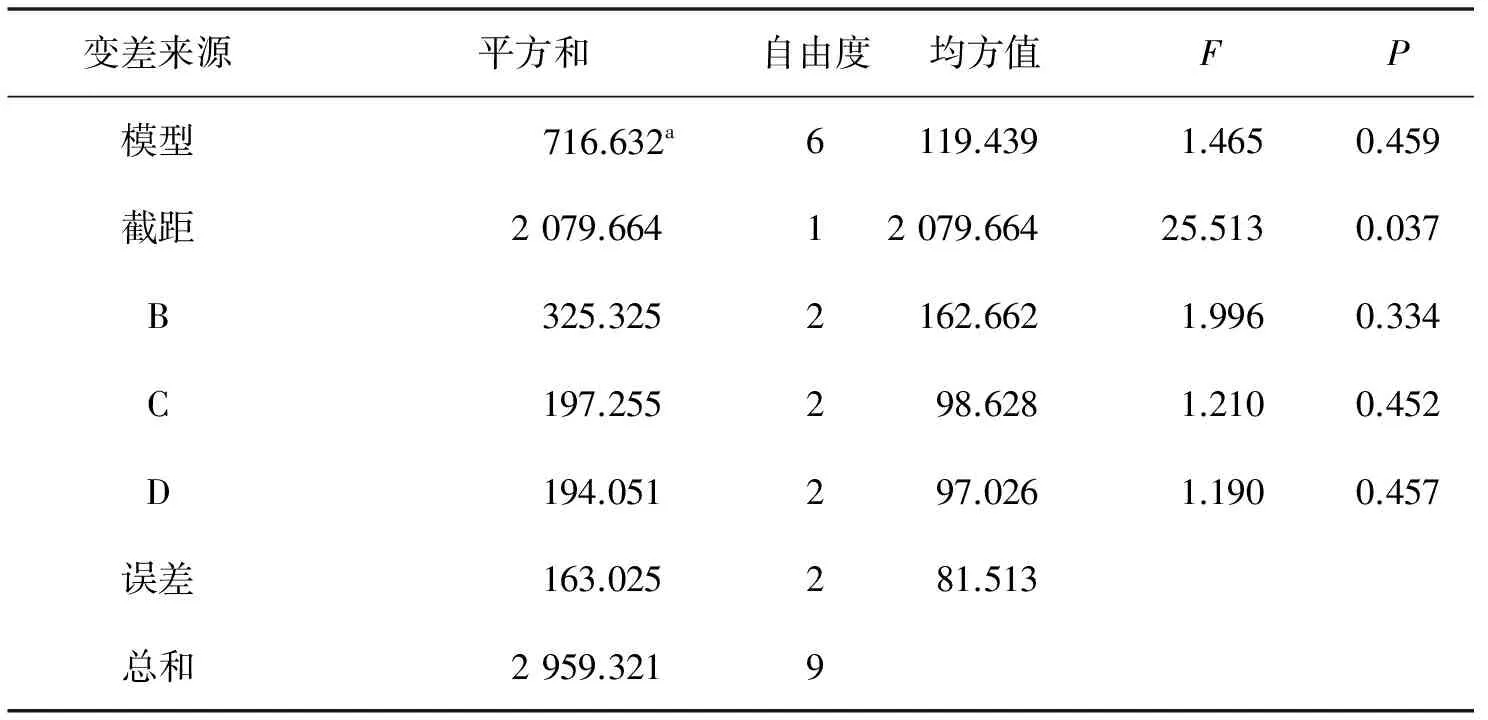
表7 正交实验方差分析
经计算,发现A(葡萄糖)的极差(R=9.63)、均方差值相对于因素B(蛋白胨)、C因素((NH4)2SO4)和D(MgSO4·7H2O)的极差、均方差很小,F值不显著,故对A不做方差分析,将其作为误差项.因素B(蛋白胨)、C((NH4)2SO4)和D(MgSO4·7H2O)的均方差相对较大(表7),说明其对米曲霉的产酶影响很大.
4 结论
本实验从土壤中分离到1株植酸酶高产菌株Pe0,初步鉴定为米曲霉,对Pe0菌株分别进行紫外线和亚硝基胍诱变处理,经初筛、复筛、遗传稳定性检测,得到1株酶活相对较高、性状相对稳定的菌株Pe2#,酶活稳定在10.66 U/mL,较原始菌株提高到3.34倍,相较于张卫兵[7]、王尊生等[8]实验得到的植酸酶活力提高1~3倍,并较常见曲霉属微生物内植酸酶的酶活显著提高了10倍.另对其发酵条件进行优化,确定最适接种量为4%,最适pH为5.5,最适培养时间为6.5 d.在此基础上进行培养基正交优化,结果表明,葡萄糖质量浓度为25 g/L,蛋白胨质量浓度为4 g/L,(NH4)2SO4质量浓度为2 g/L,MgSO4·7H2O质量浓度为0.1 g/L时所得菌株产酶活力最高.本研究为该菌株更好地服务于饲料、食品等行业提供了一定的参考依据.
[1]蔡鸿杰,李卫春,侯世洁,等.植酸酶分泌菌株的筛选研究[J].天津师范大学学报:自然科学版, 2006,26(2):19-22.
CAI Hongjie, LI Weichun, HOU Shijie, et al. Screening of strains secreting phytase[J]. Journal of Tianjin Normal University:Natural Science Edition, 2006,26(2):19-22.
[2]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:132-135.
WEI Jingchao. Fungal identification[M]. Shanghai: Shanghai Science and Technology Press, 1979:132-135.
[3]施安辉,王光玉,王秋霞.植酸酶高产菌株的选育及固态产酶条件的优化[J].山东食品发酵,2002,126(3):19-21.
SHI Anhui, WANG Guangyu,WANG Qiuxia. The phytase producing strain breeding and solid state fermentation conditions optimization [J]. Shandong Food Fermentation, 2002,126(3): 19-21.
[4]彭益强.植酸酶高产菌株的诱变选育和融合筛选[D].泉州:华侨大学,2002.
PENG Yiqiang. Phytase high yield strains by induced mutation and screening fusion [D]. Quanzhou:Huaqiao University,2002.
[5]中国国家标准化管理委员会.GB/T 18634—2009 [S].北京:中国标准出版社,2009.
[6]SUNITHA K, KIM Y O, LEE J K. Statistical optimization of seed and inductions to enhance phytase production by recombinantEscherichiacoli[J]. Biochemical Engineering Journal, 2000,5: 51-56.
[7]张卫兵.高产植酸酶菌株的选育和培养条件的研究[D].西安:西北大学,2004.
ZHANG Weibing. Screening of phytase-producing strainand studies of culture conditions[D]. Xi’an:Xibei University, 2004.
[8]王尊生,王升厚,佟泽.青霉植酸酶的初步研究[J].微生物学杂志,2001(3): 59-60.
WANG Zunsheng, WANG Shenghou, TONG Ze. Preliminary study of peniciliium producing phytase[J]. Journal of Microbiology,2001(3): 59-60.
Screeningofphytase-producingstrain
LIYanqin,LIChunqing,ZHOUJiefang,PANGZhiduo,WANGFenghua
(College of Life Sciences, Hebei University, Baoding 071002, China)
In order to get the mutant strain which was stable and high production of phytase, the originalAspergillusoryzaestrain Pe0 isolated in our laboratory was the staring strains, which were mutagenized separately by UV and nitrosoguanidine. By preliminary screening, rescreening and the detection of genetic stability, Pe2# was obtained which had a relatively high activity and stable characteristics. Its stable activity was 10.66 U/mL, which increased 3.34 times comparing with original strain. To determine the optimum conditions for its enzyme productions, the fermentation conditions were optimized. The composition of the optimum medium were 25 g/L glucose, 4 g/L peptone,2 g/L (NH4)2SO4and 0.1 g/L MgSO4·7H2O.
phytase;mutagenesis;screening;fermentation optimization
10.3969/j.issn.1000-1565.2013.04.011
2011-11-20
国家海洋公益性行业科研专项经费资助项目(201305001)
李彦芹(1965-),女,河北满城人,河北大学副教授,主要从事微生物和免疫学研究.
E-mail:liyanqin88@yahoo.com.cn
Q935
A
1000-1565(2013)04-0394-07
(责任编辑赵藏赏)
