超高效液相色谱-质谱法测定猪肉中9种β-受体激动剂残留量
2013-10-27
(中国热带农业科学院农产品加工研究所,湛江524001)
β-受体激动剂(β-agonists),是一类人工合成的药物,在药学上称为β-肾上腺素受体兴奋剂[1]。主要用于防治人、兽的支气管哮喘和支气管痉挛等症状。根据苯环取代基及其结构,β-受体激动剂可分为苯胺型(克伦特罗、西马特罗)、苯酚型(沙丁胺醇)、间苯二酚型(特布他林、莱克多巴胺、非诺特罗)[2]。研究表明,在动物饲料中添加β-受体激动剂具有营养再分配作用,可以明显提高动物瘦肉率,因而常被非法用于动物饲养中[3]。长期食用含有β-受体激动剂残留的食品会对人体健康产生极大的危害,甚至危害生命。目前,我国对该类药物在动物饲养及相关产品中的使用都有严格的规定,并已将β-受体激动剂类列为动物源性食品中的重点监控药物,农业部和各省市农业主管部门均有相关机构对畜禽产品中β-受体激动剂进行监测。
目前已报道的β-受体激动剂检测方法主要有酶联免疫法[4-6]、高效液相色谱法[7,8]、气质联用法[9-11]和液质联用法[12-14]等。各个方法均有其优缺点,其中酶联免疫法程序简单,分析速度快,检测成本低,但考虑到样品复杂的基质体系,易出现假阳性或假阴性,从而造成误判或漏判,仅作为初筛方法被应用;而液相色谱法虽然定量结果准确度高,但灵敏度相对较低,对复杂基质条件中低含量待测物质的定性存在一定困难;气质联用法需要使用N,O-双三甲基硅烷三氟乙酰胺(BSTFA)[11]等衍生试剂进行衍生化处理,步骤较为繁琐;超高效液相色谱-质谱联用法具有分析时间短、确证能力强、灵敏度高、抗干扰能力强等优点,已逐渐成为分析测试的重要手段之一,将其应用于食品中β-受体激动剂的检测具有重要的现实意义。
由于β-受体激动剂在畜禽产品中与葡萄糖醛酸、硫酸酯蛋白等成分相结合[12],有机溶剂直接浸提法可以较好的提取游离态的β-受体激动剂,但不能将结合态目标物提取出来,也就不能准确反映样品中待测物质的实际含量,因此须将结合态的β-受体激动剂转化为游离态再进行检测。目前的研究主要集中在酸法水解[15]和酶法水解[16],酸水解较为剧烈,且水解随意性大,水解后产物众多,可能增加测定时的基质干扰。而酶水解过程相对温和,由于酶具有专一性的特点,在合适的酶解条件下酶解样品既能使结合态的β-受体激动剂转化为游离态,又可以尽量避免产生过多的酶解产物干扰测定。目前我国相关质检机构在畜禽产品中β-受体激动剂质量安全专项中较多使用的是《农业部1025号公告-18-2008》方法[16],该方法需加酶酶解16h将结合的β-受体激动剂释放出来,检测过程耗费时间较长,对监督和执法等工作带来了滞后性和不便性,因此需要进一步研究酶解的最佳作用条件,并建立超高效液相色谱-质谱联用检测方法,在准确定性、定量测定目标物的前提下缩短前处理和分析时间,以适应快速检测的发展趋势。本实验拟优化提取猪肉中β-受体激动剂的酶解条件,建立猪肉中9种β-受体激动剂残留的超高效液相色谱-串联质谱检测方法,为猪肉样品中9种β-受体激动剂的快速确证和定量分析提供方法依据。
1 材料与方法
1.1 材料与试剂
猪肉购买于湛江市农贸市场;特布他林、西马特罗、沙丁胺醇、氯丙那林、非诺特罗、莱克多巴胺、克伦特罗、喷布特罗、妥布特罗,沙丁胺醇-D3、莱克多巴胺-D6及克伦特罗-D9(色谱纯,德国Dr.Ehrenstorfer公司);乙腈(色谱纯,美国Spectrum公司);乙酸铵(色谱纯,美国DIMA公司);甲酸(色谱纯,Merck公司); β-盐酸葡萄糖醛苷酶/芳基硫酸酯酶(100000 U/mL, Merck公司);高氯酸、乙酸乙酯及异丙醇(分析纯);Oasis©MCX固相萃取柱(3 mL/60 mg,美国 Waters公司);实验用水为超纯水。
1.2 仪器与设备
ACQΜITY UPLCTM-TQD超高效液相色谱-串联质谱(配有电喷雾离子源(ESI)及Masslynx数据处理软件,美国Waters公司);T25高速均质机、MS3 涡旋混合器(德国IKA公司);Milli-QA10 超纯水仪(美国Millipore公司);CR22GⅢ 离心机(日本HITACHI公司);E120H超声波仪(德国Elma公司);SWB-2000恒温水浴摇床(天津奥特赛恩斯公司)。
1.3 实验方法
1.3.1 标准溶液的配制
单标储备液:分别准确称取特布他林、西马特罗、沙丁胺醇、氯丙那林、非诺特罗、莱克多巴胺、克伦特罗、喷布特罗、妥布特罗标准品10 mg,用甲醇超声溶解并定容于100 mL容量瓶中,配制成100 μg/mL的单标储备溶液, -18℃避光保存。
混合标准中间液:分别准确吸取9种单标贮备液1.0 mL于100 mL容量瓶中,加甲醇定容,配制成1.0 μg/mL的混合标准中间液。
混合内标工作液:分别吸取适量沙丁胺醇-D3、莱克多巴胺-D6、克伦特罗-D9标准溶液,用甲醇配成100 ng/mL的混合内标液。
1.3.2 标准曲线溶液的配制
吸取混合标准中间液和混合内标工作液适量,配制成9种β-受体激动剂质量浓度分别为0.25、1、2、5、10 μg/L的系列标准工作溶液,其中3种内标的质量浓度均为1 ng/mL,依次进样10 μL,并绘制标准工作曲线。
1.3.3 样品预处理1.3.3.1 样品前处理
将购买回的猪肉去脂肪,取瘦肉部分充分绞碎,备用。
1.3.3.2 样品的酶解
称取2 g绞碎样品于50 mL塑料离心管中,加入8 mL 0.2 mol/L乙酸铵缓冲溶液(pH为5.2),8000 r/min高速匀浆30 s,再加入适量β-盐酸葡萄糖醛苷酶/芳基硫酸酯酶,涡旋混匀,放置在37 ℃水浴摇床恒温振荡适当时间。
1.3.3.3 样品的提取
酶解到达预定时间后取出,放置至室温并充分涡旋,5000 r/min离心8 min,吸取上清液,加入内标工作液及0.1 mol/L高氯酸溶液5 mL,充分涡旋混合,用高氯酸调节溶液pH值为1.0±0.2,以8000 r/min高速离心8 min去除沉淀,移取上清液并用10 mol/L和1 mol/L的氢氧化钠溶液调pH至11。加入10 mL饱和氯化钠溶液,用10 mL异丙醇-乙酸乙酯(6:4)溶液提取两次,涡旋混匀10 min,8000 r/min离心8 min后取有机相置于40 ℃水浴下氮气吹干。吹干后的残留物用5 mL 0.2 mol/L乙酸铵缓冲溶液(pH为5.2),超声溶解备用。
1.3.3.4 样品的净化
Oasis©MCX固相萃取柱先用2 mL甲醇、2 mL去离子水活化。取上述提取液全部过柱,再依次用2 mL去离子水、2mL 2%甲酸溶液淋洗,真空泵负压下抽干,用5%氨水甲醇溶液2.5 mL洗脱,洗脱液在40 ℃水浴下氮气吹干。残渣用1.0 mL含0.1%甲酸的甲醇水溶液(5:95,v/v)溶解,超声混匀后全部转移至2 mL离心管中,15000 r/min高速离心8 min,取上清液经0.2 μm滤膜过滤后供液相色谱-串联质谱仪测定。
1.4 色谱及质谱条件
1.4.1 色谱条件
色谱柱:ACQUITY UPLC BEH C18柱(50×2.1 mm,1.7 μm);流动相:A(乙腈)-B(0.1%甲酸水溶液);流速:0.3 mL/min ;柱温:40 ℃;进样量:1 μL。梯度洗脱:0 min~2 min,维持5%的A;2 min~10 min, 5%的A线性变化到60%A;10 min~12 min,60%的A线性变化到5%A;12 min~13 min,维持5%的A。
1.4.2 质谱条件
离子源:电喷雾电离源(ESI);扫描方式:正离子模式;毛细管电压:3.0 kV;离子源温度:110 ℃;脱溶剂气温度:350 ℃;脱溶剂气流量:750 L/h;锥孔反吹气流量:50 L/h;扫描方式:多反应监测(MRM)。
2 结果与分析
2.1 质谱条件的选择
采用电喷雾电离源,分别将质量浓度为0.5 μg/mL的β-受体激动剂单标标准溶液注入质谱仪进行全扫描,找出准确的[M+H]+峰,并以其为母离子进行轰击获得二次碎裂产生的碎片离子,分别找出2个信号较强的碎片离子与母离子组成监测离子对,并分别对锥孔电压、碰撞能量等参数进行优化。优化获得的多反应监测模式离子对及质谱条件见表1。
2.2 色谱条件的选择
采用超高效液相色谱仪和ACQUITY UPLC BEH C18柱对样品进行分离,在流动相的选择上比较了甲醇-水溶液、乙腈-0.1%甲酸水溶液、乙腈-5mmol/L乙酸铵溶液对目标物质的分离效果。结果表明3种流动相均可以分离9种β-受体激动剂,但使用乙腈-0.1%甲酸水溶液能更好分离待测组分,而且色谱柱的柱压更低,各色谱峰的信噪比更高,峰形更好,因此选择用乙腈-0.1%甲酸水溶液作为流动相。比较乙腈含量从2%~60%的出峰时间和分离效果,优化了流动相梯度洗脱的程序,确定流动相初始浓度为乙腈-0.1%甲酸水溶液(5/95,v/v),在此梯度洗脱条件下出峰时间合适,峰形好,9种β-受体激动剂的MRM色谱图见图1。

表1 β-受体激动剂测定的质谱条件
注:*为定量离子
2.3 酶解条件的选择
动物体在吸收β-受体激动剂,经过代谢后大多数会与硫酸酯蛋白和葡萄糖醛酸作用,以硫酸轭合物和葡萄糖醛酸轭合物等结合态形式存在,因此需要将其转化为游离态进行检测。采用β-盐酸葡萄糖醛苷酶/芳基硫酸酯酶对猪肉样品进行酶解,以9种β-受体激动剂的总峰面积为指标,考察了在37℃,pH=5.2的条件下β-盐酸葡萄糖醛苷酶/芳基硫酸酯酶的添加量和酶解时间对β-受体激动剂残留测定结果的影响(图2,图3)。
从图2和图3可以看出,随着酶添加量的增加和酶解时间的延长,9种β-受体激动剂的总峰面积呈现先增加后降低的规律,在分别对9种β-受体激动剂峰面积进行分析后发现这主要是由于非诺特罗和喷布特罗两种成分峰面积降低所致。一方面,在酶解的前期随着酶加量和酶解时间的延长,呈结合态的β-受体激动剂被释放出来,各待测组分的测定值均增加。但另一方面,随着酶解的深入,酶解的产物增多,基质组分变得更加复杂,可能对非诺特罗和喷布特罗产生较大基质抑制效应,使得其测定值降低。因此,在37℃和pH=5.2的条件下,每克猪肉样品中β-盐酸葡萄糖醛苷酶/芳基硫酸酶的适宜添加量为2500U,酶解时间为6.0h。

图1 优化条件下β-受体激动剂的MRM色谱图(进样体积为10μL,浓度为5μg/L)

图2 酶添加量对9种β-受体激动剂总峰面积的影响(37℃,pH=5.2,酶解8.0h)

图3 酶解时间对9种β-受体激动剂总峰面积的影响(37℃,pH=5.2,每克样品酶加量为2500U)
2.4 方法的线性范围和检出限
在优化的色谱和质谱条件下考察了9种β-受体激动剂的线性关系。以目标化合物质量浓度与相应内标物质量浓度的比值为横坐标,目标化合物定量离子峰面积与相应内标物峰面积的比值为纵坐标,绘制待测物质标准曲线(表2)。由表2可见,9种β-受体激动剂在0.25~10 μg/L质量浓度范围内均有良好的线性关系。采用空白样品基质加标的方法,以S/N≥3时目标物的含量为该方法的检出限,以S/N≥10时目标物的含量为该方法的定量限。经计算本方法测定9种β-受体激动剂的检出限为0.2 μg/kg,定量限为0.5 μg/kg。
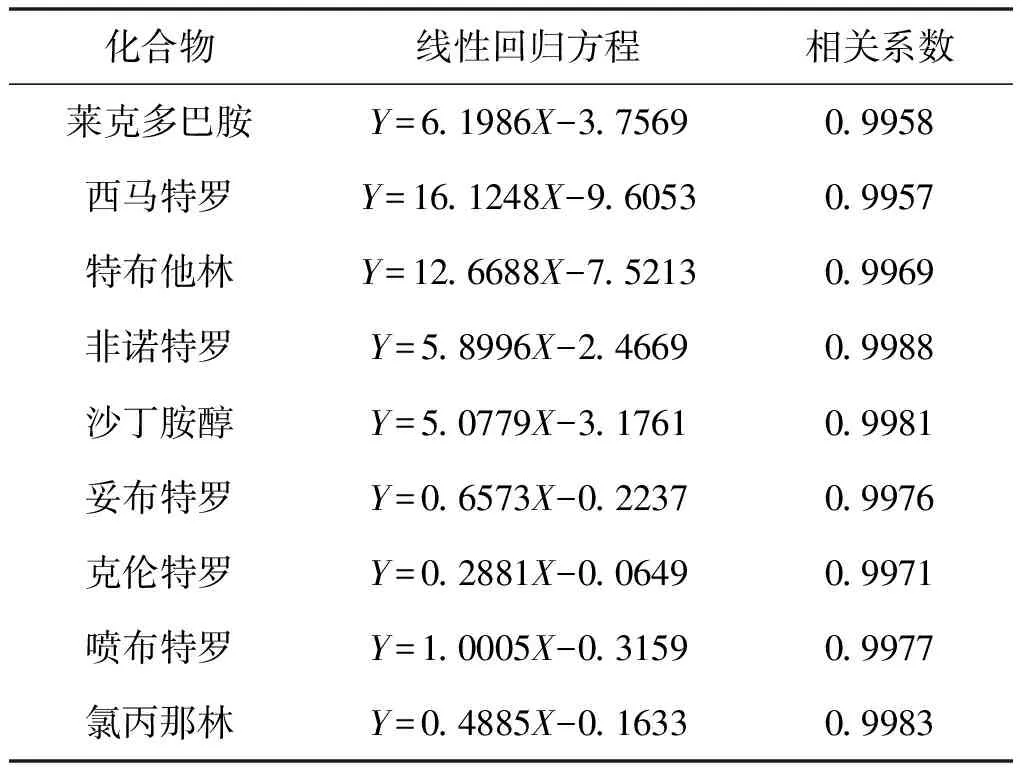
表2 9种β-受体激动剂的线性回归方程和相关系数
2.5 方法的回收率和精密度
在空白猪肉样品中添加标准溶液进行添加回收率实验,添加水平分别为0.5、1.0、5.0 μg/kg,每个添加水平进行6次重复实验,加标回收率和精密度结果见表3。从表3可以看出,9种β-受体激动剂的回收率在80.4%~110.3%之间,相对标准偏差≤6.7%。
3 结 论
本研究优化了提取猪肉中9种β-受体激动剂的酶解条件,并建立了同时测定猪肉中9种β-受体激动剂的超高效液相色谱-串联质谱检测方法。在37℃和pH=5.2时,β-盐酸葡萄糖醛苷酶/芳基硫酸酯酶的最佳酶解条件为每克猪肉中酶添加量为2500 U,酶解时间为6.0 h。9种β-受体激动剂以乙腈-0.1%甲酸水溶液为流动相进行分析,样品运行时间为13 min即可获得满意的分离效果。采用内标法定量,在添加水平分别为0.5、1.0、5.0 μg/kg的条件下9种β-受体激动剂的回收率在80.4%~110.3%之间,相对标准偏差≤6.7%。该方法的样品前处理时间和上机分析时间较短,且灵敏度高,回收率和重现性等均能满足定量分析要求,结果准确可靠。适于猪肉中特布他林、西马特罗、沙丁胺醇、氯丙那林、非诺特罗、莱克多巴胺、克伦特罗、喷布特罗、妥布特罗标的同时测定,尤其适合大批量样品的快速确证和定量分析。

表3 空白样品中β-受体激动剂的添加回收率及相对标准偏差(n=6)
[1]翟福丽,赖克强,张衍亮,等.动物性食品中β-兴奋剂残留概述[J].食品科学,2011,32(5):351-356.
[2]许志刚,练海贤,李攻科,等. β2-兴奋剂的样品前处理与分析检测方法研究进展[J].分析测试学报,2011,30(4):465-472.
[3]孙雷,张骊,毕言锋,等.猪肝中β-受体激动剂残留检测能力验证结果分析[J].中国兽药杂志,2011,45(2):35-38.
[4]王俊平,赵云襄,王硕,等.沙丁胺醇直接酶联免疫快速检测的方法[J].食品研究与开发,2011,32(2):97-100.
[5]申宏丹,窦 红,高春平,等. 直接竞争酶联免疫法检测莱克多巴胺研究[J].动物医学进展,2009,30(8):58-63.
[6]农业部1025号公告-6-2008 动物性食品中莱克多巴胺残留检测酶联免疫吸附法[S].
[7]戴华,袁智能,黄志强,等. 饲料中盐酸克伦特罗、沙丁胺醇高效液相色谱测定[J].分析测试学报,2003,22(3):57-59.
[8]林奕芝,刘奋,戴京晶,等. 高效液相色谱法测定肉与肉制品中盐酸克伦特罗残留量[J].中国卫生检验杂志,2002,12(2):180-181.
[9]王培龙,范理,苏晓鸥,等.分子印迹固相萃取-气相色谱-质谱法测定猪尿中4种β-受体激动剂[J].分析化学,2012,40(3):470-473.
[10]Caban M,Stepnowski P,Kwiatkowski M,et al. Determination of β-blockers and β-agonists using gas chromatography and gas chromatography-mass spectrometry-A comparative study of the derivatization step[J]. Journal of Chromatography A,2011,1218(44):8110-8122.
[11]农业部958号公告-4-2007 动物组织及动物尿液中莱克多巴胺残留检测方法气相色谱-质谱法[S].
[12]郭伟,杨丽君,时文春,等. 高效液相色谱-串联质谱测定猪肉中3种β-受体激动剂残留量[J].分析试验室,2010,29(4):92-98.
[13]Lee H B,Sarafin K,Peart T E. Determination of β-blockers and β2-agonists in sewage by solid-phase extraction and liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A,2007,1148(2):158-167.
[14]Sardela V F,Deventerb K,Pereira H M G ,et al. Development and validation of a ultra high performance liquid chromatography-tandem mass spectrometric method for the direct detection of formoterolin human urine[J].Journal of Pharmaceutical and Biomedical Analysis,2012,70: 471-475.
[15]白凌,陈大舟,李蕾. 液相色谱-质谱法检测肝脏中5种β-受体激动剂[J].质谱学报,2008,29(1):10-12.
[16]农业部1025号公告-18-2008 动物源性食品中β-受体激动剂残留检测液相色谱-串联质谱法[S].
