产耐热木聚糖酶细菌的分离鉴定及酶易错PCR致突变条件优化
2013-10-26张宁宁凡1超1阮灵伟黄一帆
赵 超,张宁宁,梅 凡1,,艾 超1,,阮灵伟,黄一帆 ,刘 斌*
(1.福建农林大学食品科学学院,福建 福州 350002;2.国家菌草工程技术研究中心,福建 福州 350002;3.福建农林大学生物能源研究所,福建福州 350002;4.国家海洋局第三海洋研究所海洋生物遗传资源重点实验室,福建 厦门 361005)
木聚糖是植物半纤维素的主要成分,是自然界中仅次于纤维素的可再生生物资源,占植物细胞干重的15%~35%,是植物细胞壁的主要成分之一。木聚糖酶(EC3.2.1.8)属水解酶类,是将木聚糖降解为低聚木糖或木糖的复合酶系。木聚糖酶是一种重要的工业用酶,广泛应用于生物能源、食品、酿造、饲料和造纸等工业[1]。工业化生产所需木聚糖酶应是耐热的,对具备热稳定性质的木聚糖酶的研究和开发显得非常重要。目前已报道产木聚糖酶的微生物有几十个属、一百多个种,研究和应用最多的是细菌、曲霉和木霉产的木聚糖。从嗜热环境中筛选有工业应用价值的木聚糖酶的产生菌,是得到耐热木聚糖酶的最有效的手段[2]。天然木聚糖酶的许多性质不适应工业生产的条件,酶的定向进化能通过改变酶的结构和性质而满足这种需求[3-4]。耐热木聚糖酶的定性进化方面,国内外研究相对较少[5]。耐热木聚糖酶基因的体外分子进化研究,可使原本操作起来耗时耗力或难以进行直观筛选的耐热酶得到改造,以期获得热稳定的木聚糖酶。本研究从福建省永泰县温泉中筛选到1株高产木聚糖酶菌株(编号为TC-W7),通过16S rRNA序列、形态、生理生化等方面对该菌进行了初步鉴定,并从中克隆得到耐热木聚糖酶基因。采用定向进化易错PCR的方法,对影响易错PCR突变率的Mg2+浓度、Mn2+浓度和dCTP/dTTP浓度等条件展开优化,向该木聚糖酶基因随机引入突变,为后续耐热木聚糖酶的定向进化研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 样品 实验样品来自于美国内华达州温泉和福建省永泰县近海温泉。
1.1.2 菌株和试剂 E.coli DH5α、载体 pMD18-T、Ex Taq DNA 聚合酶、dNTP、Mixture、dTTP、dCTP、T4 DNA Ligase(TaKaRa);100 bp DNA Ladder Maker、琼脂糖凝胶DNA回收试剂盒、Plasmid Mini Kit、PCR产物纯化试剂盒(TIANGEN);木聚糖(Sigma),半纤维素自制。
1.1.3 培养基 ①半纤维素初筛培养基(g/L):(NH4)2SO40.50,KH2PO41.0,CaCl2·2H2O 0.20,MgSO4·7H2O 0.30,K2SO40.10,NaCl 0.20,琼脂 15.0,自制半纤维素 15.0,pH 7.0 ~7.2。(半纤维素制备:取水稻秸秆磨成的粉末,按浸泡固液比1∶15,用60 g/L的NaOH于120℃浸泡2 h,过滤得滤液。将所得滤液冷却至室温,调pH值至7.0,加入与滤液等体积的乙醇沉淀,高速冷冻离心机5000 r/min离心5 min,沉淀物用无水乙醇洗涤离心2~3次。将所得固体物45℃下烘干,得到的粉末即为半纤维素[6]);②木聚糖复筛培养基(g/L):木聚糖 3.0,KNO30.10,Mg-SO4·7H2O 0.05,NaCl 0.05,K2HPO40.05,琼脂15.0,pH 7.0 ~7.2。
1.2 方法
1.2.1 目标菌株的分离与筛选 称取5.0 g样品,加50 mL灭菌生理盐水于三角瓶中,摇床振荡10 min。吸取1 mL用无菌生理盐水梯度稀释至10-4倍,取80 μL稀释液涂布半纤维素固体培养基,置于70℃培养,待菌落长出后,挑取单菌落划线分离纯化。在半纤维素初筛平板上选取透明圈相对较大菌株,接种于木聚糖复筛平板和液体培养基中,根据降解后透明圈形成的大小及粗酶液活性判断降解能力。酶活性较强菌株添加15%甘油后,置于-80℃超低温冰箱保存备用。
1.2.2 菌落形态观察、镜检及生理生化测试 取目标菌株斜面菌种,接种于复筛培养基,70℃培养24 h后,观察并记录菌落生长状况和菌落形态。挑取少量菌体进行染色,显微镜下观察并记录菌体形态。参考东秀珠等[7]《常见细菌系统鉴定手册》对菌株进行部分生理生化测试。
1.2.3 酶学性质研究(酶活测定按1.2.8) ①酶最适反应温度测定:取适量稀释酶液,分别置于35、45、55、65、70、75、80、85、90、95 ℃下测定酶活;②酶的热稳定性测定:取适量稀释酶液,分别置于65、70、75、80 ℃下保温 10、20、30、40、60、80、100、120 min后,取出测定酶活;③酶的最适pH测定:取适量稀释酶液,分别置于50 mmol/L的pH 3.2、4.2、5.2、6.2、7.2 的柠檬酸-磷酸氢二钠缓冲液,pH 8.2 的 Tris-HCl缓冲液,pH 9.2、10.2 的甘氨酸-氢氧化钠缓冲液,最适温度条件下测定酶活;④酶的pH稳定性测定:取适量稀释酶液,置于上述pH 条件下分别耐受15、30、60、90 min后,取出测定酶活;⑤金属离子、抑制剂和去污剂对酶活力的影响:分别配制50 mmol/L的不同金属离子(Ni2+、Cu2+、Zn2+、Mg2+、Ca2+、Ba2+、Mn2+、Fe2+、Al3+)、100 mmol/L 的抑制剂(SDS、EDTA、PMSF、2-Me、DDT)和 10% 的去污剂(Tween-20、TrionX-100)溶液。取适量稀释酶液,加入金属离子、抑制剂和去污剂至终浓度为10 mmol/L或1%,温浴10 min后,取出测定酶活。
1.2.4 基因组DNA的提取及16S rRNA序列扩增 采用CTAB/NaCl法提取基因组DNA[8],利用通用扩增16S rRNA基因的引物27F和1492R[9],以基因组DNA为模板,进行PCR反应。PCR条件:94 ℃ 5 min;94℃ 45 s,55℃ 45 s,72℃ 90 s;30个循环;72℃ 10 min。将PCR产物回收,连接至载体pMD18-T,转化E.coli DH5α,挑取阳性克隆子,送上海生工测序分析。将测序结果在专门收录典型菌株的网站EzTaxon database进行比对分析[10]。
1.2.5 系统发育学分析 采用EzTaxon的在线工具进行序列比对计算相似性,并利用软件MEGA 4.0对相应基因序列构建系统进化树[11],利用Clustal W进行比对,随后采用Neighbor-joining方法建立进化树,同源关系的可靠性由自举值(bootstrap)进行评估(1000次重复)。
1.2.6 木聚糖酶基因xyn扩增 以目标菌株基因组DNA为模板,根据木聚糖酶基因保守区域设计的兼并引物进行交叉式PCR扩增(表1),回收PCR产物后连入pMD18-T克隆载体,挑取阳性克隆子,送上海生工测序分析。所得序列经BLAST分析,依据与该片段比对具有最高相似性菌株中木聚糖酶基因的全长序列设计特异性引物(表1),以目标菌株基因组DNA为模板PCR扩增,回收PCR产物后连入pMD18-T克隆载体挑取阳性克隆子,送上海生工测序分析。
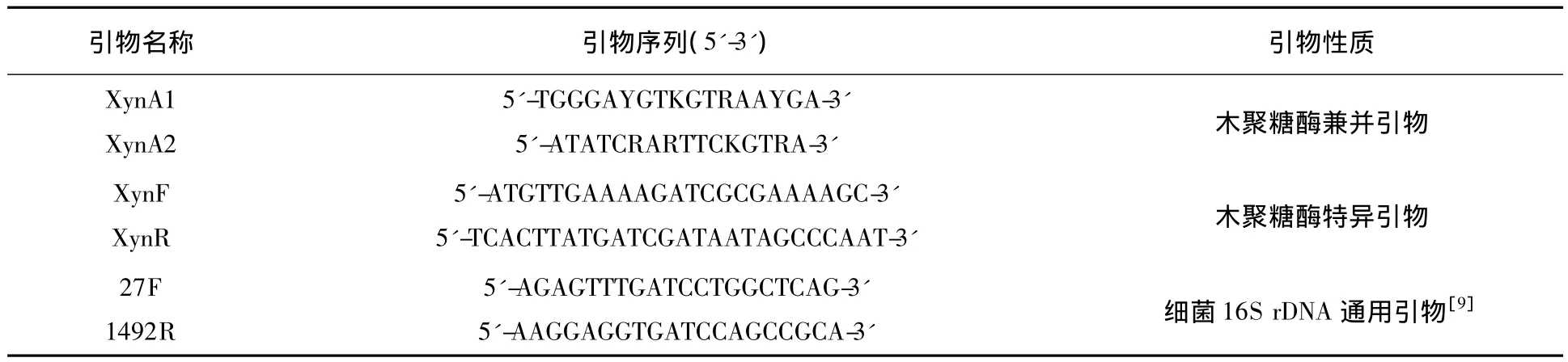
表1 用于PCR的引物序列Table 1 Primers used in PCR
1.2.7 易错PCR致突变条件优化 普通PCR扩增体系(50 μL)为 10 × TaKaRa Taq Buffer,dNTP Mixture,引物各 0.2 μmol/L,模板 DNA 100 ng,Taq DNA聚合酶2.5 U。PCR条件:95℃ 5 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 90 s,30个循环;72℃ 10 min。易错PCR致突变条件优化过程如下:①Mg2+致突变条件优化:易错PCR其他条件不变,Mg2+分别选择 18.0、20.0、22.0、24.0 μmol/L;②Mn2+致突变条件优化:易错PCR其他条件不变,Mn2+分别添加至 0.20、0.40、0.60、0.80 μmol/L;③dTTP/dCTP致突变条件优化:易错PCR其他条件不变,dTTP/dCTP分别添加至0.21、0.22、0.23、0.26、0.30 mmol/L;④根据以上试验结果,将影响突变率的因素组合,其他易错PCR的组分和扩增条件不变,获得适宜的突变率。
突变率的鉴定:PCR产物经纯化试剂盒纯化后,连接pMD18-T载体,转化E.coli DH5α感受态细胞,所有转化子构成突变体文库。随机挑选3个阳性克隆子送上海生工测序。计算在木聚糖酶基因中平均有多少碱基发生突变,计算突变率。
1.2.8 木聚糖酶活力测定 将2.0 mL的1.0%木聚糖溶液 (pH 7.2的柠檬酸缓冲液配制)和1.5 mL的DNS加入比色管,70℃温浴5 min,加入粗酶液0.5 mL,反应30 min,混匀后沸水浴显色15 min,冷却至室温后定容到10 mL,用分光光度计540 nm测定OD值,通过标准曲线方程计算酶活。在上述条件下1.0 mL粗酶液1 min催化水解木聚糖生成1 μmoL木糖的量,定义为1 U。
2 结果与分析
2.1 产耐热木聚糖酶菌株的筛选与鉴定
样品经半纤维素初筛培养基筛选,得到20株透明圈相对较大的菌株,再根据木聚糖复筛培养基条件下木聚糖酶水解圈直径及粗酶液酶活力比较,复筛到1株编号为TC-W7的木聚糖酶活性最大的细菌菌株。初始菌株TC-W7在木聚糖复筛培养基上菌落呈现乳白色,半透明且表面光滑,中间些许隆起、带有透明晕环、边缘不规则。革兰染色为阳性,鞭毛侧生。其最适生长温度为75℃,最适生长pH值为8.2,在此条件下其木聚糖酶活力为215.83 U/mL。
经PCR扩增获得菌株TC-W7的16S rRNA基因序列,提交至NCBI数据库进行保存,其NCBI序列登录号为GQ866911。采用Neighbor-joining构建16S rRNA基因系统发育树,分析菌株TC-W7发现与Geobacillus thermodenitrificans DSM 465T及Geobacillus subterraneus 34T处于同一分支(图1),TC-W7的16S rRNA基因与两个菌株的序列相似性分别为99.67%和99.20%,初步确定菌株TC-W7属于土壤芽胞杆菌属(Geobacillus)。
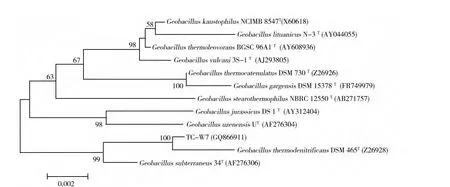
图1 利用Neighbor-joining建树法对菌株TC-W7系统发育树分析Fig.1 Unrooted neighbor-joining tree of strain TC-W7 and related genera based on 16S rRNA gene sequences.Bar,0.2%sequence divergence
2.2 酶学性质测定
该木聚糖酶反应的最适温度为75℃,粗酶在65℃和70℃条件下的热稳定性较强,耐受2 h后仍有75%活性,该酶在95℃时仍具有一定的酶活。75℃时,酶的半衰期为30 min,酶的热稳定性能较好。该酶反应的最适 pH为7.2,在 pH 9.2的稳定最好,pH 9.2和10.2条件下温育90 min后仍具有80%和42%的活性,表明该木聚糖酶具有较好的碱耐受性(图2)。
金属离子Ni2+、Cu2+、Zn2+对酶活具有较强抑制作用,分别降至初始酶活的45.0%、24.3%和66.8%,而 Mg2+、Ca2+、Ba2+、Mn2+和 Al3+对其有一定程度的促进作用,分别提高了20.0%、16.0%、19.1%、23.4%和 16.8%,尤其是 Fe2+的促进作用最强,酶活提高44.5%。抑制剂SDS、2-Me、Tween-20对酶活性的影响作用不明显,而PMSF和EDTA则能较强的抑制其酶活性,分别降低到初始酶活的55.6%和25.5%,但Triton X-100和DDT能够有效增强该酶的活性,酶活分别提高了45.2%和30.5%。
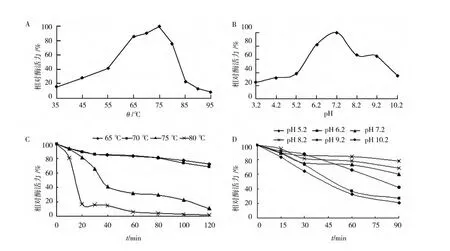
图2 温度和pH值对木聚糖酶酶活力影响Fig.2 Effects of temperature(A,C)and pH(B,D)on xylanase activity
2.3 木聚糖酶基因xyn扩增
以TC-W7基因组DNA为模板,以木聚糖酶基因保守区域设计的兼并引物进行PCR扩增,得到1条400 bp的片段,测序结果经BLAST比对发现,该序列片段为木聚糖酶基因的部分序列,且与G.thermodenitrificans T-2的热稳定木聚糖酶具有92%的最高相似性。依据与该片段比对具有最高相似性菌株G.thermodenitrificans T-2中木聚糖酶基因的全长序列设计了引物(XynF/XynR),PCR扩增得到一段大约1200 bp的片段(图3)。测序结果显示,TC-W7木聚糖酶基因是一个1224 bp的开放阅读框(ORF),编码由407个氨基酸组成的蛋白质,NCBI中的序列登录号为 GQ857066。与UniProt Knowledgebase数据库中木聚糖酶序列进行比对分析,发现该酶与G.thermodenitrificans NG80-2(A4IP71)、Geobacillus sp.WBI(B5M201)、Geobacillus sp.Y412MC61(C9RT34)、Bacillus firmus(Q6U892)中木聚糖酶的同源性分别为98%、86%、85%和57%。
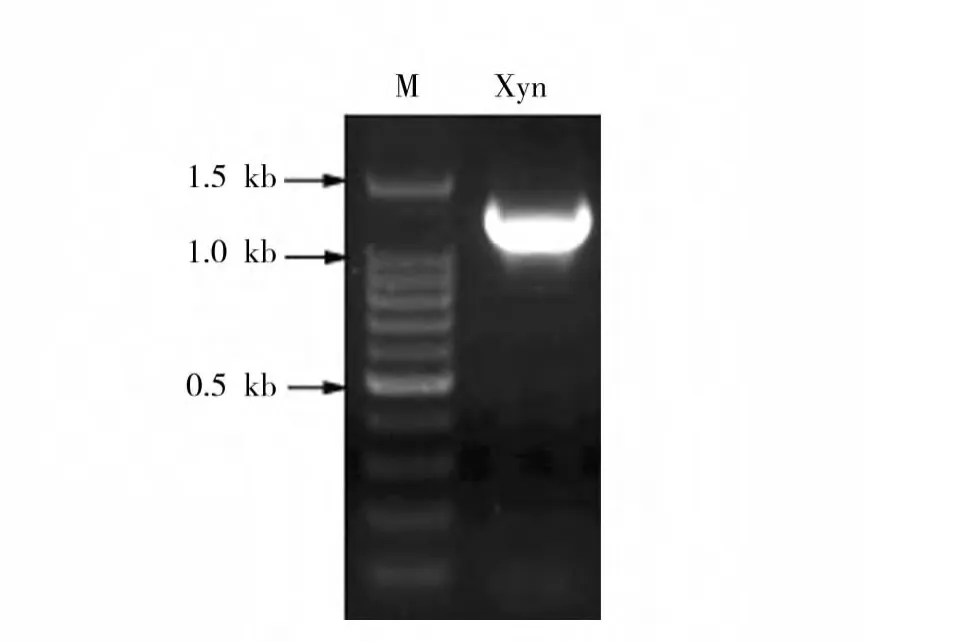
图3 以TC-W7基因组DNA为模板扩增木聚糖酶基因电泳图Fig.3 Electrophoregrams of the xylanase-encoding DNA amplification fragment from the strain TC-W7 chromosomal DNA
2.4 易错PCR致突变条件优化
2.4.1 Mg2+、Mn2+浓度优化 由于 Mg2+在 PCR过程中可以稳定非互补的碱基对,而Mn2+能够降低聚合酶对模板的特异性,因此可通过调整2种离子的浓度,获得不同突变频率的多样性文库。较低浓度的Mg2+对Taq DNA聚合酶是必需的,较高浓度可以稳定非互补的碱基对,有利于突变。Mg2+浓度优化结果表明,18.0 μmol/L时开始出现弥散,20.0 ~24.0 μmol/L 时扩增条带逐渐变窄变淡,24.0 μmol/L时条带几乎扩增不出来(图4A)。在20.0、22.0 μmol/L 浓度下,扩增的突变率分别为 0.6%(7/1224)和 1.5%(18/1224),选定20.0 μmol/L Mg2+浓度作为后续致突变条件。Mn2+可以降低聚合酶对模板的特异性。在比较不同Mn2+浓度对PCR反应影响时发现,0.20~0.80 μmol/L梯度内条带清晰度均较好,但随着Mn2+浓度的增高,条带弥散的现象越来越严重(图4B),可见提高Mn2+浓度可增加突变率。在 0.6、0.8 μmol/L 浓度下,碱基突变率分别为0.5%(6/1224)和 1.2%(14/1224),选取 0.80 μmol/L Mn2+浓度作为后续致突变条件。

图4 不同Mg2+(A)及Mn2+(B)浓度优化易错PCR结果(单位:μmol/L)Fig.4 Error-prone PCR conducted with different Mg2+(A)and Mn2+(B)concentrations(unit:μmol/L)
2.4.2 dTTP/dCTP浓度优化 本实验在原有dNTP Mixture的基础上,添加dTTP/dCTP浓度分别至0.21、0.22、0.23、0.26、0.30 μmol/L,添加至0.30 mmol/L后出现较为理想的浑浊度(图5),在该浓度条件下突变率为 0.6%(7/1244)。dNTP是反应中磷酸根的主要来源,增大dTTP/dCTP的浓度促进错误掺入,碱基A容易被T替代,碱基G被C替代,从而提高突变率。另外,dNTP浓度的任何变化都将影响到Mg2+的有效浓度,从而影响PCR结果的忠实性[12]。

图5 不同dTTP/dCTP浓度优化易错PCR结果Fig.5 Error-prone PCR conducted with different dTTP/dCTP concentrations
2.5 不同致突变条件联合作用对碱基突变率影响
其他易错PCR的组分和扩增条件不变,同时选择 20.0 μmol/L Mg2+、0.80 μmol/L Mn2+、0.30 mmol/L的dTTP/dCTP进行扩增,测序结果显示在1224个碱基中有12个碱基发生突变,突变率为0.98%,所造成的突变率在0.5% ~2.0%的范围。43个碱基发生变化会导致407个氨基酸残基中4~12个氨基酸发生突变,氨基酸突变率为0.98% ~2.95%,此突变率适合用于酶定向进化[13]。该技术关键在于选择适当的突变频率,一般为每个基因2~5个碱基替换。只有突变库尽量大,才能筛选到想要获得的阳性突变子。但是如果库容量过大,则筛选过程费时费力。因此获得最佳的突变率,既可以降低筛选突变子的数量,又可以成功地获得预期的突变子。
3 讨论
本研究从温泉中筛选到1株嗜热脱氮土壤芽胞杆菌 Geobacillus sp.TC-W7,菌株在最适温度75℃和 pH 8.2条件下,其木聚糖酶活力为215.83 U/mL。该木聚糖酶在温度为75℃和pH 9.2条件下的稳定性最好,具有较强的耐热性和耐碱性。从菌株TC-W7扩增到1224 bp的木聚糖酶基因xyn,并通过易错PCR的定向进化策略,研究了xyn基因致突变条件,在Mg2+浓度为20.0 mmol/L,Mn2+浓度为 0.80 mmol/L,dTTP/dCTP浓度为0.30 mmol/L的条件下,获得的碱基突变率为0.98%,氨基酸突变率为0.98% ~2.95%,此条件适合用于耐热木聚糖酶的定向进化。
Geobacillus是国际上2001年新命名的一类细菌。由于其具有嗜热、兼性厌氧及降解烃等特性,这类细菌具有特殊的功能基因和特种酶,对构建工程菌具有重要的研究价值[14]。天然蛋白质分子的进化依赖于自然选择和变异法则,近年发展起来的酶定向进化技术能够开发出天然酶蛋白分子不具备的特性[15]。利用易错PCR重新改进酶分子的结构和性质可以逐步接近和满足将酶催化用于工业生产的需要[16]。Stephens等[17]利用易错PCR技术提高了Thermomyces lanuginosus中木聚糖酶(XynA)的耐碱性和耐热性。Zhang等[18]利用该技术使 G.stearothermophilus产木聚糖酶(xylanase XT6)的失活半寿期提高了1.4~2.5倍。易错PCR可使原始蛋白质中仅有很小的序列空间发生突变,一般适用于较小的基因片段,对于定向进化的研究者,易错PCR不失为一种有效、实用的进化方法。本研究为耐热木聚糖酶基因的突变文库构建,获得高活性和热稳定性突变体奠定基础。
[1]Beg QK,Kapoor M,Mahajan L,et al.Microbial xylanases and their industrial applications:a review[J].Applied Microbiology and Biotechnology,2001,56(3-4):326-338.
[2]赵超,李婷,邓云金,等.厌氧菌群SVY42产酶条件分析及产木聚糖酶菌株的分离鉴定[J].微生物学杂志,2013,33(3):49-53.
[3]Belien T,Joye IJ,Delcour JA,et al.Computational design-based molecular engineering of the glycosyl hydrolase family 11 B.subtilis XynA endoxylanase improves its acid stability[J].Protein Engineering Design and Selection,2009,22(10):587-596.
[4]Fenel F,Zitting AJ,Kantelinen A.Increased alkali stability in Trichoderma reesei endo-1,4-[beta]-xylanase II by site directed mutagenesis[J].Journal of Biotechnology,2006,121(1):102-107.
[5]Miyazaki K,Takenouchi M,Kondo H,et al.Thermal stabilization of Bacillus subtilis family-11 xylanase by directed evolution[J].The Journal of Biological Chemistry,2006,281(15):10236-10242.
[6]彭园花,卢红梅,曾祥钦.半纤维素制备条件优化[J].环保科技,2007,13(1):44-46.
[7]东秀珠,蔡妙英,等.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[8]Syn CK,Swarup S.A scalable protocol for the isolation of large-sized genome DNA within an hour from several bacteria[J].Analytical Biochemistry,2000,278(1):86-90.
[9]Weisburg WG,Barns SM,Pelletier DA,et al.16S ribosomal DNA amplification for phylogenetic study[J].Journal of Biotechnology,1991,173(2):697-703.
[10]Chun J,Lee JH,Jung Y,et al.EzTaxon:a web-based tool for the identification of prokaryotes based on 16S ribosomal RNA gene sequences[J].International Journal of Systematic and Evolutionary Microbiology,2007,57(10):2259-2261.
[11]Tamura K,Dudley J,Nei M,et al.MEGA4:Molecular evolutionary genetics analysis(MEGA)software version 4.0[J].Molecular Biology and Evolution,2007,24(8):1596-1599.
[12]王睿,喻晓蔚,沙冲,等.定向进化-易错PCR方法提高华根霉Rhizopus chinensis CCTCC M201021脂肪酶的活力[J].生物工程学报,2009,25(12):1892-1899.
[13]冯慧玲,李春梅,吴振芳,等.易错 PCR技术提高黑曲霉N25植酸酶活力的研究[J].生物技术通报,2010,10:226-230.
[14]周卫民,杨世忠,Nazina TN,等.Geobacillus研究进展[J].微生物学杂志,2005,25(3):46-49.
[15]Leisola M,Turunen O.Protein engineering:opportunities and challenges[J].Applied Microbiology and Biotechnology,2007,75(6):1225-1232.
[16]Bornscheuer UT,Pohl M.Improved biocatalysts by directed evolution and rational protein design[J].Current Opinion in Chemical Biology,2001,5(2):137-143.
[17]Stephens DE,Singh S,Permaul K.Error-prone PCR of a fungal xylanase for improvement of its alkaline and thermal stability[J].FEMS Microbiology Letters,2009,293(1):42-47.
[18]Zhang ZG,Yi ZL,Pei XQ,et al.Improving the thermostability of Geobacillus stearothermophilus xylanase XT6 by directed evolution and site-directed mutagenesis[J].Bioresource Technology,2010,101(23):9272-9278.
