兔心肌梗死再灌注和血管损伤双模型的建立与评价
2013-10-26王正龙刘志江赵然尊
王正龙,刘志江,赵然尊,郭 艳,石 蓓
(遵义医学院附属医院 心血管内科, 贵州 遵义 563099)
兔心肌梗死再灌注和血管损伤双模型的建立与评价
王正龙,刘志江,赵然尊,郭 艳,石 蓓
(遵义医学院附属医院 心血管内科, 贵州 遵义 563099)
目的制作兔心肌梗死再灌注和血管损伤双模型,为同步研究心肌梗死后心肌重塑和血管重塑提供可行的动物模型。方法选用新西兰大白兔45只,随机分成2组:对照组(n=5)和模型组(n=40)。模型组用高脂饲料饲养建立动脉粥样硬化模型,然后制备心肌梗死再灌注和颈动脉球囊损伤双模型。采用心电图、心肌标志物和组织病理学评价心肌梗死再灌注模型;采用组织病理学评价颈动脉球囊损伤模型。结果心肌标志物升高并随时间变化呈动态演变,而且心肌随时间变化呈凝固性坏死到纤维疤痕改变;右颈总动脉球囊损伤后内膜增生。结论心肌梗死再灌注和血管损伤双模型的建立具有可行性。
心肌梗死再灌注;血管损伤;模型;兔
目前,干细胞移植对治疗急性心肌梗死的有效性已得到部分证实[1-7],然而,其治疗中的安全性仍然存在争议[8-11],因为干细胞移植治疗在改善心功能的同时可能会加重血管重塑。但至今仍少见可用于同步研究干细胞移植治疗心肌梗死后心肌再灌注和血管重塑的动物双模型。因此,本实验以兔为研究对象,建立心肌梗死再灌注和血管损伤双模型,目的是建立可用于同步平行研究干细胞移植治疗心肌梗死后心肌重塑和血管重塑的动物模型。
1 材料与方法
1.1 实验动物与分组 新西兰大白兔,雄性,45只,体重(3.0±0.3)kg,由遵义医学院实验动物中心提供。随机分成二组:对照组(n=5)和模型组(n=40),对照组普通饲料饲养,模型组模型组用高脂饲料饲养。
1.2 主要试剂、药品和仪器 高脂饲料主要成份:普通混合饲料、猪油、胆固醇、猪胆盐(自配)。血清肌钙蛋白T免疫放射诊断试剂盒(IRMA-cTnT)(北京北方生物技术研究所),戊巴比妥钠(上海试剂厂),硫化钠(北京益利精细化学品有限公司),Kenzcardico302心电图机(日本铃谦株式会社),日立7170A全自动生物化学分析仪(日本日立公司),球囊导管(美国Cordis公司),医学图像分析管理系统(德国Leica Microsystems Ltd)。
1.3 冠状动脉结扎法建立心肌梗死再灌注模型 高脂喂养建立动脉粥样硬化模型[12]后采用开胸结扎冠状动脉法建立心肌梗死再灌注模型。戊巴比妥钠(10 mg/kg)沿耳缘静脉注射麻醉,仰卧固定于手术台板上,前胸及颈部手术部位常规备皮去毛(5%Na2S),消毒,然后铺洞巾,在无菌条件下,于胸骨旁左侧0.5 cm纵行切口长约30 cm,离断胸骨与左第3、4肋交界处,将第3肋骨两断端用缝线向两侧牵引固定,不使用开胸器,尽量保持胸膜完整性,充分暴露心脏,小心提起心包剪开并制备心包吊床,用无齿镊轻拉左心耳,可清楚暴露兔心脏血管,用小圆针穿眼科4-0缝线,在左室支距离左心耳下缘10 mm处缝扎血管[2],其末端套内径0.5 cm的硅胶管,通过拉紧丝线阻断冠脉血流,放松即可恢复灌注。可见结扎线以下出现局部心肌紫绀,收缩减弱,心电监护ST段抬高≥2 mm且30 min内不回落,初步判断模型制作成功,结扎45 min[13]后。放松结扎线,恢复心肌血流再灌注,常规关闭胸腔。
1.4 球囊损伤颈动脉法制作血管损伤模型 心肌梗死再灌注模型建立后在颈正中线上作4~6 cm纵行切口,将右颈总动脉暴露至分叉水平。在颈总动脉近端和颈内动脉远端各放一个动脉夹阻断血流,结扎颈外动脉远端,近端逆行插入一根直径为2.5 mm球囊导管至颈总动脉约5.0 cm。连接手推式压力泵,注入肝素生理盐水,膨至6个大气压使球囊膨胀[14],然后沿颈总动脉拖动5次,使导管损伤的血管区域达到4 cm长度。退出球囊导管,结扎颈外动脉近端,移去颈总动脉近端和颈内动脉远端动脉夹,恢复血液循环,常规缝合颈部皮肤。左颈外动脉不做任何处理,作为自身对照;术后肌注青霉素80万单位,连续3 d。
1.5 心电图检测 分别于结扎前,结扎后30 min,2周记录心电图。全导联心电图动态监测阻断冠脉血流前后心电波形变化。
1.6 心脏标志物检测 分别从术前,结扎冠脉后1 h,3 h,5 h,7 h,2周分别于兔耳缘静脉取血,检测心肌酶和肌钙蛋白。
1.7 心肌和血管病理组织切片检测 结扎冠脉左室支后1周,4周处死动物,每组取4只兔的心脏组织,经10%福尔马林固定,乙醇脱水,石蜡包埋,常规HE染色,光镜下观察病理变化。
2 结果
2.1 存活情况 入选40只新西兰兔建立心肌梗死再灌注和血管损伤双模型,观察1月,术中术后共死亡8只,死亡率20%,模型成功率80%,其中建立心肌梗死再灌注模型死亡7只(顽固性室颤3只,急性左心衰竭2只,麻醉死亡2只);建立血管损伤模型无死亡,晚期严重感染死亡1只。
2.2 心电图结果 术前十二导联心电图未见ST段抬高,结扎冠状动脉左室支后30 min T波升高,ST段抬高,以II、III和aVF及V1-V3明显;2周后 II、III和aVF及V1-V3形成深而宽的病理性Q波,与结扎后30 min心电图比较,II、III和aVF及V1-V3升高的ST段有恢复(见图1)。

注:A:正常兔V1、V2、V3导联ECG;B:梗死30 min ST段抬高;C:梗死2周ST段抬高下降,宽而深的Q波形成。 图1 结扎兔冠状动脉左室支不同时间心电图变化特点
2.3 心脏标志物结果 CK、CK-MB及CTnT在心肌梗死模型建立后3 h升高,7~24 h达高峰,且建模后3 h、5 h、7 h、24 h与建模前比较,差异均有统计学意义(P<0.05);建模后2周,其值明显下降,与建模前比较差异无统计学意义(P>0.05) (见表1)。


指 标心肌梗死前心肌梗死后3h5h7h24h2周后CK(U/L)1882±304.136872±451.04∗12463±563.21∗16601±557.28∗13674±551.36∗2266±268.29CK-MB(U/L)1297±218.486738±331.57∗10025±309.15∗12168±478.65∗9959±389.75∗2289±398.36CTnT(mg/l)0.00±0.00 3.96±0.06∗ 7.11±0.11∗ 4.58±0.07∗ 1.81±0.04∗0.00±0.00
注:与心肌梗死前比较*P<0.05。
2.4 心肌病理 正常兔心肌纤维排列规则,无炎性细胞浸润,无纤维疤痕组织增生;心肌梗死再灌注后1周,可见典型的心肌细胞凝固性坏死;心肌梗死再灌注后4周,左心室游离壁心肌组织大量坏死,由纤维疤痕组织所取代,存活的少量心肌组织被分隔成岛状,散在分布(见图2)。
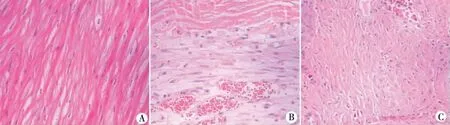
注:A:正常兔心肌组织;B:梗死1周典型凝固坏死形成,局部较多炎性细胞侵润;C:梗死4周局部纤维瘢痕形成。 图2 结扎兔冠状动脉左室支不同时间心肌病理变化特点(HE×100)
2.5 血管损伤结果 血管损伤后1月行组织病理学检查见内膜增生明显(见图3)。

注:A:正常兔颈动脉;B:球囊损伤颈动脉,可见内膜增生明显。 图3 球囊损伤颈动脉4周内膜病理变化特点(HE×200)
3 讨论
3.1 建模方法的选择及意义 心肌梗死动物模型在心肌梗死发生机理及其治疗方法的研究中具有重要作用,目前,心肌梗死模型有4种方法[13]:①通过转基因或基因敲除等方法;②药物(垂体后叶素、异丙肾上腺素、麦角新碱)注射法;③液氮冷冻法及电凝法; ④人工阻塞左冠状动脉,包括冠状动脉结扎或夹闭术及冠状动脉阻塞术。这些方法中各有其优缺点,转基因或基因敲除法可造成严重的高脂血症及动脉粥样硬化,继而引起心肌梗死,特点在于接近人类发病的过程。然而,因该方法复制的动物模型其冠状动脉闭塞的时间和位置变异性大,可控性差,同时其费用高,需时长,因此,不适合用于心肌梗死相关的心肌重塑研究。药物注射法通过增加心肌氧耗和诱发冠脉痉挛导致心肌缺血,因其存在不安全性和所制模型梗死区域难定位的缺陷,已很少被实验者采用;冷冻法通过超低温使心肌细胞冻伤坏死,这与血流中断引起的心梗发生过程有较大差异。人工阻塞左冠状动脉法可使动物造成急性或慢性心肌缺血及梗死,在诸多方法中,冠状动脉结扎法有较多优点,如梗死的部位及时间容易控制,可以复制与心肌梗死患者极为类似的动物模型,因此,至今冠状动脉结扎法仍是经典的首选方法[13]。
3.2 模型的可行性分析 建立的动物模型具有可行性的关键之一是如何降低动物的死亡率。本实验共入选40只新西兰兔建立心肌梗死再灌注和血管损伤双模型,观察1月,术中、术后共死亡8只,其中建立心肌梗死再灌注模型死亡7只(顽固性室颤3只、急性左心衰竭2只、麻醉意外2只);建立血管损伤模型时无死亡,晚期严重感染死亡1只,死亡率为20.0%,模型成功率80%。
通过本实验体会,影响模型动物存活率主要与以下几个因素有关:①结扎部位选择;②麻醉;③手术操作技能及无菌技术;④术后抗感染;⑤其它如术中保温、术中术后护理等,其中,结扎部位的选择是提高手术后成活率的重要措施。预实验中,采用结扎冠状动脉左室支的中上1/3处(距左心耳下缘3~5 mm),术中心电图检测可见较广泛的ST段呈弓背向上抬高,尤以II、III、aVF及V1-V6明显,在几分钟内,因心室纤颤而死亡,死亡率几乎达100%。后来,降低结扎部位,改在冠状动脉左室支距离左心耳下缘10 mm处缝扎血管,死亡率明显下降,饲养1月,存活率可达60%。通过加强麻醉、手术操作技能及无菌技术、抗炎等综合措施,然后观察1月,模型成功率达到80%,提示建立心肌梗死再灌注和血管损伤双模型具有可行性。
可靠的实验指标检测是判断模型建立成功的重要方面。目前认为心电图,心肌标志物及病理检查结合是判断心肌梗死模型成功建立的金标准。本实验通过心电图,心肌标志物及病理检查确定心肌梗死再灌注模型成功建立;同时从颈动脉内膜损伤后伊文思蓝染色特点和病理结果提示血管损伤模型建立成功。
3.3 本实验特点 近年来,PCI已成为冠心病治疗的重要手段。新近国内外许多研究表明,干细胞移植治疗心肌梗死能改善心功能,但是在应用安全性方面存在争议。我们在探索干细胞移植治疗急性心肌梗死中的有益作用的同时,需要明确其在治疗中是否会加重急性心肌梗死后损伤血管的重塑。有文献报道G-CSF诱导和动员的骨髓造血祖细胞转化为血管平滑肌细胞会加重再狭窄,因而,干细胞移植治疗心肌梗死可能会加剧冠状动脉粥样斑块形成和再狭窄的发生[15]。因此,有必要在同一个体内同步研究心肌梗死后干细胞对心肌重塑的有效性和安全性。既往制作的动物模型多集中在干细胞治疗心肌梗死方面,对于心肌梗死后同步观察心肌重塑和血管重塑方面的研究较少,而长期以来制作的心肌梗死模型多采用持续性冠状动脉阻断的方法,不能准确反应临床上许多急性心肌梗死患者已进行冠脉内再灌注治疗(PCI或CABG)的特点。本实验以兔为研究对象,在动脉粥样硬化颈动脉狭窄基础上,采用开胸结扎冠状动脉法构建心肌梗死动物模型,在结扎血管45 min后,恢复心肌血流灌注。在心肌梗死后恢复心肌再灌注,这更符合临床上急性心梗患者紧急开通血管,恢复心肌血流灌注的特点。该模型在建立心肌梗死模型成功后采用球囊损伤狭窄的颈动脉,这模拟了临床患者PCI治疗模式,为在同一个体中同步平行研究心肌梗死后心肌重塑(心力衰竭)和血管重塑(PCI术后再狭窄)的实验研究提供重要的意义。
综上所述,建立心肌梗死再灌注和血管损伤双模型具有可行性。
[1] Hou J,Wang L,Jiang J,et al.Cardiac Stem Cells and their Roles in Myocardial Infarction[J].Stem Cell Reviews and Reports,2012:1-13.
[2]Donndorf P, Strauer B E,Haverich A.Steinhoff G.Stem Cell Therapy for the Treatment of Acute Myocardial Infarction and Chronic Ischemic Heart Disease[J].Curr Pharm Biotechnol,2013,14(1):12-9 .
[3]Mathieu E,Lamirault G,Toquet C,et al. Intramyocardial delivery of mesenchymal stem cell-seeded hydrogel preserves cardiac function and attenuates ventricular remodeling after myocardial infarction[J]. LoS One,2012,7(12):51991.
[4]Wright E J,Farrell K A,Malik N,et al.Encapsulated glucagon-like peptide-1-producing mesenchymal stem cells have a beneficial effect on failing pig hearts[J].Stem Cells Transl Med,2012,1(10):759-769.
[5]Flynn A W,Chen X,O'Connell E,et al.A comparison of the efficacy of transplantation of bone marrow derived mesenchymal stem cells and unrestricted somatic stem cells on outcome after acute myocardial infarction[J].Stem Cell Research & Therapy,2012,3(5):36.
[6]Karantalis V,Balkan W,Schulman I H,et al.Cell-based therapy for prevention and reversal of myocardial remodeling[J]. Am J Physiol Heart Circ Physiol,2012,303(3):256-270.
[7]Donndorf P,Strauer B E,Steinhoff G.Update on cardiac stem cell therapy in heart failure[J].Curr Opin Cardiol,2012,27(2):154-160.
[8]Ripa R S,Jørgensen E,Kastrup J.Clinical outcome after stem cell mobilization with granulocyte-colony-stimulating factor after acute ST-elevation myocardial infarction:5-year results of the STEMMI trial[J].Scandinavian Journal of Clinical & Laboratory Investigation,2013,1-5.
[9]Jonsson T B,Larzon T,Arfvidsson B,et al. Adverse events during treatment of critical limb ischemia with autologous peripheral blood mononuclear cell implant[J].Int Angiol,2012,31(1):77-784.
[10]Choi S H,Jung S Y,Kwon S M,et al. Perspectives on stem cell therapy for cardiac regeneration[J].Circ J,2012,76(6):1307-1312.
[11]Lodi D,Iannitti T,Palmieri B.Stem cells in clinical practice:applications and warnings[J].J Exp Clin Cancer Res,2011,30(9):1-20.
[12]沈长银,石蓓,赵然尊,等.兔颈动脉粥样硬化狭窄动物模型的制备[J].四川大学学报:医学版,2009,40(5):923-926.
[13]Lukács E,Magyari B,Tóth L,et al. Overview of large animal myocardial infarction models (review)[J].Acta Physiol Hung,2012,99(4):365-381.
[14]Orozco L D,Liu H,Chen B B,et al.Perkins E.Angiographic evaluation of the rat carotid balloon injury model[J].Exp Mol Pathol,2011,91(2):590-595.
[15]Hill J M,Syed M A,Arai A E,et al.Outcomes and risks of granulocyte colony-Stimulating factor in patients with coronary artery disease[J].J Am Coll Cardiol,2005,46(9):1643-1648.
[收稿2013-02-12;修回2013-04-21]
(编辑:谭秀荣)
Establishmentandevaluationofrabbitmyocardialinfarctionreperfusionwithvascularinjurymodel
Wangzhenglong,Liuzhijiang,Zhaoranzun,Guoyan,Shibei
(Department of Cardiology, The Affiliated Hospital of Zunyi Medical University,Guizhou Zunyi 563099,China)
ObjectiveTo establish rabbit myocardial infarction reperfusion with vascular injury model.MethodsForty-five New Zealand white rabbits were randomly divided into the control group (n=5) and model group (n=40) fed with high-fat diets to establish atherosclerosis model followed by the myocardial infarction reperfusion-induced injury by thoracotomy and ligating left ventricular branch of coronary artery and the subsequent carotid artery balloon injury. ECG, cardiac markers and histopathological examinations were performed to evaluate the model establishment.ResultsCompared with the control group, the cardiac markers were time-dependently increased with dynamic development and the time-dependent change from necrosis to fibrous scar was presented and carotid artery showed intimal hyperplasia in the model group.ConclusionIt is feasible to eatablish myocardial infarction reperfusion with vascular injury model.
Myocardial infarction reperfusion; vascular injury; model; rabbit
R 541
A
1000-2715(2013)03-0193-05
国家自然科学基金资助项目(NO:81060014)。
石蓓,女,教授,硕士生导师,研究方向:冠心病介入治疗,E-mail:shibei2147@163.com。
