远隔缺血后适应对脑缺血/再灌注损伤保护作用的研究
2013-10-25赵海苹吉训明高素琴罗玉敏
张 营 赵海苹 吉训明 高素琴 罗玉敏*
(1.首都医科大学宣武医院脑血管病研究室,北京100053;2.首都医科大学宣武医院神经外科,北京100053;3.济钢医院神经内科,济南250101)
脑血管病具有高发病率、高致残率、高病死率、高复发率的特点,其中缺血性脑血管病的发病占45.5% ~75.9%[1]。缺血预适应和后适应现象均被认为是机体缺血事件中强有力的内源性保护方法。1986年,Murry等[2]研究发现犬心脏在短暂冠状动脉(以下简称冠脉)结扎后,能显著减少随后较长时间缺血所引起的高能磷酸化合物耗竭和心肌的梗死,首次提出了“缺血预适应”(ischemic preconditioning,IPC)的概念,其最初定义为“一种短暂缺血后诱导的快速适应性反应,能减少随后较长时间缺血引起的细胞坏死”。但是由于缺血事件的不可预见性,限制了IPC的临床应用。2003年,Zhao等[3]利用犬的心脏缺血模型,于缺血再灌注开始时,直接给予缺血心脏连续3次30 s再灌注和30 s缺血,发现同IPC一样,可以减轻缺血再灌注损伤,并提出了缺血后适应(ischemic postconditioning,IPostC)的概念,即在再灌注早期,重复给予几次短暂的、非致命性缺血与再通,可以明显减轻再灌注损伤。IPostC可以应用于缺血事件发生之后,但是由于其实施必须直接作用于发生缺血的重要器官,临床不适用于对缺血极其敏感的器官,如心脏、脑缺血等。
Kerendi等[4]利用小鼠的心肌缺血模型,于缺血后再灌注前对肾动脉进行单次5 min的闭塞和再通,发现可以显著地减轻心肌的缺血再灌注损伤。首次观察到了远隔缺血后适应(remote ischemic post-conditioning,RIPostC)的现象,由此提出了“远隔缺血后适应”的概念,即器官发生缺血后,对远隔器官进行短暂的、非致死性缺血和再灌注,可以减轻器官的缺血再灌注损伤。对非生命重要器官实施RIPostC,来保护已经发生缺血的生命重要器官,避免了对心、脑等生命重要器官直接实施缺血保护带来的高风险,此种方法对于临床应用具有重要意义,临床应用前景广阔。
本实验的目的就是研究在大鼠脑缺血即刻给予的RIPostC 对缺血后8、24 h 和3、7、14、30 d 脑梗死体积及神经功能的影响。
1 材料与方法
1.1 实验动物
SD雄性大鼠104只,体质量280~310 g,清洁级,由北京维通利华实验动物技术有限公司提供,实验动物许可证号:SCXK(京)2008-0001。术前禁食,但自由进水12 h。
1.2 实验仪器
小动物呼吸机(Harvard Apparatus 683)、双极电凝(德威,ACC100,北京天业爱博科贸有限公司)、显微镜(Carl Zeiss)、脑血流监测仪(Perimed,PF5001)、反馈式温度调节仪(Harvard Apparatus)、血气分析仪(美国,Abbott,i-STAT)、有创血压监测仪(Biopac DA100C)、牙科钻(Saeshin Strong207),精密电子天平(Adventurer)、Image-Pro Plus计算机图像分析系统(美国,Larser Sharp)、数码相机(苏州富士胶片映象机器有限公司)、大鼠手术操作台、显微手术器械,线栓(北京科海军舟生物科技发展中心)、免疫荧光显微镜(Nikon Digital Imaging Hero Eclipse 80i)、-80 ℃低温冰箱(Forma-86c)、超声波细胞粉碎机(Scientz-ⅡD)、离心机(Beckman Coulter)、酶标仪(Thermo Multiskan Mk3)、胶片(Kodak X-OMAT,USA)PVDF 膜(BioTrace,Pall Corporation,USA)、AlphaEaseFC 软件(美国 Alpha Innotech公司)、德国 Siemens 3.0T(Verio Syngo B15)超导磁共振成像系统。
1.3 实验试剂
0.9 %NaCl注射液、磷酸二氢钠、磷酸氢二钠、多聚甲醛、恩氟烷 (河北九派制药)、10%水合氯醛(华瑞制药)。
1.4 实验方法
1.4.1 大鼠MCAO模型
大鼠称质量后,在4% ~5%恩氟烷、30%O2/70%N2O下诱导麻醉。约5 min后将其尾部抬起无任何张力且随重力自然落下表示诱导麻醉成功。将大鼠固定于操作台上,手术显微镜放大倍数调节至16倍,进行气管插管。插管成功后迅速连接动物呼吸机,在1% ~2%恩氟烷、30%O2/70%N2O下维持麻醉。将大鼠仰卧于手术台上,取颈部正中切口,小心分离皮下脂肪和肌肉,右侧颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)和颈内动脉(internal carotid artery,ICA)。分离ECA主干,钝性分离出甲状腺动脉和枕动脉,并电灼切断。在CCA分叉处远端约1 cm处结扎、电灼、切断ECA,并在CCA分叉处结扎一道缝合线,不做紧密结扎。仔细分离ICA至其发出翼腭动脉(pterygopalatine artery,PPA)和入颅动脉处。用微小动脉夹临时夹闭CCA和ICA,用眼科剪在ECA残端剪一个小口,插入线栓,扎紧缝合线,松开ICA动脉夹,慢慢推动线栓进入ICA,使其进入ICA入颅动脉支。线栓穿过距ICA和ECA分叉处约2 cm左右,有阻力感时,表明线栓已将大脑中动脉堵塞,放开CCA动脉夹,结扎CCA分叉处缝合线,缝合颈部皮肤。缺血2 h后,再次麻醉大鼠,打开颈部切口,将线栓拔出,电凝ECA残端后将颈部切口缝合,脑缺血8、24 h和3、7、14、30 d后处死。假手术组的大鼠接受所有的手术过程但不插入线栓。
1.4.2 RIPostC 方法
大鼠双侧腹股沟处的皮肤备皮消毒之后,各做一处长约1 cm的切口,钝性分离出双侧股动脉,在再灌注即刻,以临时血管夹夹闭/放开双侧股动脉,夹闭10 mins,放开10 mins,如此3次循环。
1.4.3 动物分组
104只健康雄性SD大鼠采用数字表法随机分为13组,每组8只:① 假手术组(S);② RIPostC 8 h组(R8 h);③ 8 h对照组(C8 h);④ RIPostC 24 h组(R24 h);⑤24 h对照组(C24 h);⑥ RIPostC 3 d组(R3 d);⑦3 d对照组(C3 d);⑧ RIPostC 7 d组(R7 d);⑨ 7 d对照组(C7 d);⑩ RIPostC 14 d组(R14 d);⑪14 d 对照组(C14 d);⑫RIPostC 30 d 组(R30 d);⑬30 d 对照组(C30 d)。
1.4.4 神经功能评分
1)Longa 评分法[5]评分标准为:采用 Longa 等[5]推荐的5分法,并稍作改变,对大鼠神经功能进行评分:0分:正常;1分:脑缺血对侧的前肢不能伸展;2分:脑缺血对侧的前肢屈曲;3分:实验动物向缺血对侧轻度转圈;4分:实验动物明显向缺血对侧转圈;5分:实验动物爬行时倒向缺血对侧。
2)前肢踩空试验[6]:主要检测实验动物的视觉、触觉以及前肢对感觉及运动的整合能力。整个空格的面积为10 cm×110 cm,由许多正方形小网格组成(面积9 cm2),小网格网丝的直径为1.0 mm,放置在离地面1 m的高度。在实验中,让大鼠在1 min内,由空格的一端爬向另一端。如果爬行中,动物的前肢掉入网格里,记为1次前肢踩空,它主要是因为脑组织缺血损伤导致运动功能失调。总共计数1 min内实验动物脑缺血对侧前肢出现的踩空错误次数。
3)12分评分法:根据 Belayev等[7]的12分评分法:(1)姿势反射测验,即提尾悬空试验:无明显神经功能缺失为0分,梗死对侧肢体屈曲为1分,侧推试验阳性为2分。(2)肢体放置试验:① 视觉亚实验,即前方刺激——实验者将动物握于手中,使其前爪悬空,自桌面上方10 cm处向桌面缓慢斜线靠近(此时桌子位于大鼠前方),大鼠正常反应为前肢即刻抓向桌面,损伤大鼠则表现为肢体反应延迟。0分:动物肢体放置反应正常;1分:反应延迟但不超过2 s;2分:反应延迟且超过2 s。侧方刺激,此时桌子位于动物侧方,其余实验方法及评分标准同前方刺激。② 触觉亚实验,将动物双眼遮住,并使其前爪悬空,此时大鼠应该既看不见,也不能用胡须触及桌面,用其前爪背侧轻触桌面,刺激深度仅达皮肤和毛发,动物反应及评分同视觉亚实验,触觉刺激同样分前方及侧方刺激。③本体觉亚实验,操作及评分同触觉亚实验,仅刺激深度不同,本体觉亚实验给予前爪较大压力,刺激深达肌肉及关节。该亚实验只有前方刺激。动物前肢放置实验总分范围为0~10分,功能损伤越重,得分越高。
1.4.5 大鼠头颅磁共振扫描
大鼠分别在脑缺血后 8、24 h 和 3、7、14、30 d 后行大鼠冠状位磁共振T1WI、T2WI检查。使用德国Siemens 3.0T(Verio Syngo B15)超导磁共振成像系统,大鼠专用线圈。大鼠水合氯醛腹腔注射麻醉后,取俯卧位,头置线圈中央,行冠状位连续扫描,层厚2 mm,层间隔0 mm,层数11。T1WI采用SE序列,TR/TE/NEX(500 ms/13 ms/2),FOV 78 mm×78 mm,矩阵256×256;T2WI采用SE序列,TR/TE/NEX(4 000 ms/92 ms/2),FOV 64 mm×64 mm,矩阵 192×192;DWI采用单次激发 SE-EPI序列,b值取50 s/mm2、500 s/mm2、1 000 s/mm2,TR/TE/NEX(3 500 ms/80 ms/5),FOV 94 mm×94 mm,矩阵80×80。像后处理使用Siemens Leonardo工作站。
1.4.6 HE染色测定脑梗死体积
各组大鼠分别在脑缺血再灌注后8、24 h和3、7、14、30 d后,10%水合氯醛腹腔麻醉,右心房快速灌注肝素化PBS及4%多聚甲醛进行固定,断头取脑,置4%多聚甲醛中后固定48 h后放入模具,于视交叉处沿冠状切片,向前囟方向切2张切片,向小脑方向切3张切片,每片厚约2 mm,石蜡包埋。每片脑组织第一张做HE染色,使用Image-Pro Plus 6.0图像分析系统计算脑梗死体积。大鼠脑梗死百分比=(正常侧大脑半球体积-梗死侧非梗死区大脑半球的体积)/对侧正常侧大脑半球体积%=[(S1'+S2'+…+Sn')H-(S1+S2+…+Sn)H]/(S1'+S2'+…+Sn')H%,Sn'表示每片正常脑组织面积,Sn表示梗死侧非梗死区每片脑组织面积,H表示每片厚度。
1.5 统计学方法
采用SPSS 16.0进行统计分析。计量数据用均数±标准差(ˉ±s)表示,组间比较使用one-way ANOVA方法,以P<0.05为差异有统计学意义。
2 结果
2.1 RIPostC对大鼠神经功能的影响
各实验组大鼠分别在脑缺血后8、24 h和3、7、14、30 d进行神经功能评分。结果显示,假手术组未见任何神经功能缺失症状,而对照组与RIPostC组大鼠术后均出现不同程度左前肢屈曲、行走路径向左侧偏斜。
2.1.1 Longa 方法评分结果
对照组各组间比较,14和30 d的神经功能评分明显低于8 h、24 h、3 d(P<0.05);RIPostC 组各组间比较,7 d、14 d、30 d 神经功能评分明显低于 8 h、24 h、3 d(P<0.05);与对照组比较,RIPostC 组大鼠在7 d神经功能评分降低,但差异无统计学意义(P>0.05),详见图1。
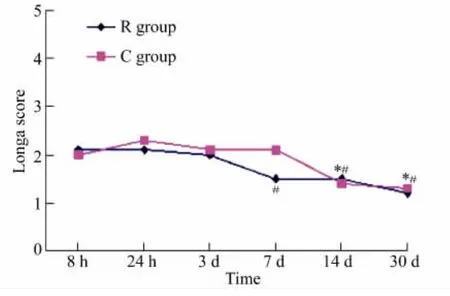
图1 Longa评分结果Fig.1 The results of Longa scores
2.1.2 前肢踩空试验评分结果
对照组各组间比较,14和30 d神经功能评分明显低于8、24 h 和3、7 d(P<0.05),30 d 神经功能评分明显低于14 d(P<0.05);RIPostC组各组间比较,30d神经功能评分明显低于 8、24 h和 3、7、14 d(P<0.05),14 d神经功能评分明显低于8和24 d(P<0.05),7 d神经功能评分明显低于24 d(P<0.05);与对照组比较,RIPostC组大鼠3 d和7 d神经功能评分显著降低,并且差异有统计学意义(P<0.05),说明RIPostC改善了大鼠脑缺血再灌注损伤的神经功能恢复,详见图2。

图2 前肢踩空试验评分结果Fig.2 The scores of the forelimb test
2.1.3 神经功能12分评分结果
对照组各组间比较,14和30 d的神经功能评分明显低于8 h、24 h、3 d、7 d(P<0.05);RIPostC 组各组间比较,30 d神经功能评分明显低于8 h、24 h、3 d、7 d(P<0.05),3和14 d神经功能评分明显低于8和24 h(P<0.05),7 d神经功能评分明显低于24 h(P<0.05);与对照组比较,RIPostC组大鼠3 d和7 d神经功能评分显著降低,并且差异有统计学意义(P<0.05),进一步说明RIPostC对脑缺血再灌注损伤的神经功能恢复的保护作用,详见图3。

图3 12分评分结果Fig.3 The results of the 12 scores
2.2 RIPostC对大鼠脑梗死体积的影响
2.2.1 HE染色测定脑梗死体积
两种神经功能评分均显示,RIPostC对脑缺血再灌注损伤7 d和14 d具有保护作用,笔者进一步应用HE染色观察RIPostC是否可以影响大鼠脑缺血再灌注后的远期脑梗死体积。镜下可见,脑梗死形态为多角形或扇形,梗死侧神经元细胞数量减少,轴突缺失,神经元细胞周围可见较多有空泡的神经纤维。结果显示:与对照组相比,RIPostC组大鼠在脑缺血再灌注损伤后8 h、24 h、3 d、7 d脑梗死体积均明显降低,差异具有统计学意义(P<0.05),但14和30 d脑梗死体积在两组间比较差异并无统计学意义。结果如图4所示HE染色,图5为HE染色的脑梗死体积定量。
2.2.2 大鼠头颅磁共振扫描结果
为进一步确认本模型的稳定性以及RIPostC对大鼠脑缺血再灌注损伤的保护作用。笔者分别对RIPostC组和对照组大鼠在脑缺血再灌注损伤后8、24 h和3、7、14、30 d行头颅磁共振扫描,脑梗死区域在MRI的T2加权像上所见弥散性高信号的影像学改变,详见图6。
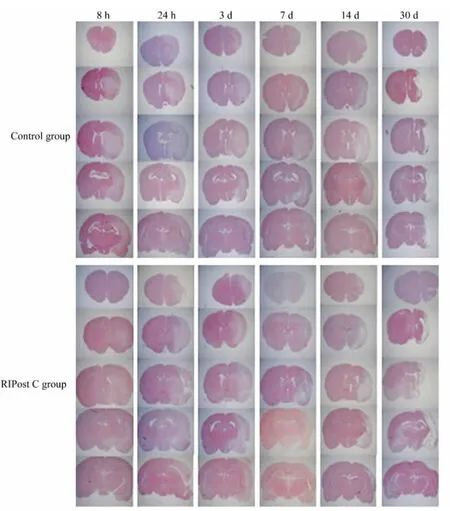
图4 HE染色Fig.4 The results of the hematoxylin-eosin stain

图5 RIPostC对大鼠脑梗死体积的影响Fig.5 The results of RIPostC on the cerebral infarction volumes of the rats
3 讨论
在以往关于RIPostC的研究中,我们已经得到在脑缺血即刻和脑缺血再灌注即刻对大鼠实施远隔夹闭/放开双侧股动脉,夹闭10 min,放开10 min,如此3次循环的RIPostC可以减少大鼠脑缺血后24 h的脑梗死体积,并提高神经功能评分,其脑保护机制可能是通过降低C/EBP同源蛋白和caspase-3的表达来发挥其脑保护的作用[8-12]。本研究应用大鼠大脑MCAO模型着重研究RIPostC对大鼠脑缺血的远期保护作用,结果证明远隔夹闭/放开双侧股动脉,夹闭10 min,放开10 min,如此3次循环的RIPostC可以减少大鼠脑缺血后8 h、24 h、3 d和7 d的脑梗死体积,改善脑缺血后3和7d的神经功能评分,具有神经保护作用,但是对14 d和30 d的脑梗死体积和神经功能评分均无明显影响。

图6 头颅磁共振扫描图Fig.6 The results of the magnetic resonance imaging
Ren等[10]通过永久性大脑中动脉阻塞和30 min双侧颈总动脉夹闭制造小鼠脑缺血模型。双侧颈总动脉恢复血流后,给予下肢股动脉连续3次15 min缺血和15 min再灌注的RIPostC,2 d后测定脑梗死体积。结果双侧颈总动脉恢复血流后立即实施RIPostC,与对照组相比,脑梗死体积下降67%。双侧颈总动脉恢复血流后3 h实施RIPostC,与对照组相比,脑梗死体积下降47%。说明RIPostC对脑缺血再灌注损伤具有保护作用,而且实施的越早效果可能越好。Stavros等[11]在短暂肢体缺血产生RIPostC实验中发现,上肢反复3次的缺血再灌注刺激可以使机体产生保护作用,但是如果这种刺激减少到反复2次,这种保护作用就消失。同时RIPostC的保护程度也取决于接受缺血再灌注刺激的组织体积,因为下肢反复2次的缺血再灌注刺激可以使机体对内皮的缺血再灌注损伤产生保护作用。以上结果提示RIPostC刺激也存在一定的阈值,但是由于目前基础实验证据不充分,无法确定阈刺激的具体值。
关于RIPostC的治疗时间窗的研究中,Ren等[10]在肢体的RIPostC保护小鼠的局灶性脑梗死实验中发现,再灌注即刻实施的RIPostC可以使脑梗死体积比对照组下降67%,再灌注后3h实施的RIPostC可以使脑梗死体积比对照组下降47%,将RIPostC的实施延长到再灌注后6h,脑梗死体积与对照组比较无明显差异,提示RIPostC存在治疗时间窗,这项实验中RIPostC的治疗时间窗为到再灌注后的3 h。Faraz等[4]在利用肾动脉短暂的缺血再灌注产生RIPostC来减少心肌梗死面积的实验中发现,对小鼠实施左冠状动脉阻塞30 min,制造心肌缺血模型,于心肌缺血24 min时夹闭肾动脉血流5 min,松解肾动脉并于1 min后进行左冠状动脉再灌注,可使心肌梗死面积比对照组减少了50%。而延时的RIPostC,即在左冠状动脉阻塞26 min后实施RIPostC,其心肌梗死面积与对照组相比无明显差异。此项实验进一步说明,与传统的心肌缺血后适应一样,RIPostC需要于再灌注的早期完成,这样才可以发挥它的保护作用。本研究课题组前期的研究发现RIPostC在再灌注30 mins内给予,24 h后测定脑梗死体积,具有保护作用,进一步明确了RIPostC应用的时间窗(尚待发表)。上述实验研究为临床实施RIPostC提供了一定参考,但是究竟如何选择RIPostC的最佳治疗时间窗,有待于进一步深入研究。
本课题采用线栓法制备比较符合人类常见缺血性卒中类型的大鼠MCAO模型,大脑中动脉阻塞2 h后进行再灌注。RIPostC的具体操作方法为:在大鼠脑缺血即刻夹闭双侧股动脉10 min,放开10 min,此为1个循环,共进行3个循环,分别在脑缺血再灌注后8、24 h 和 3、7、14、30 d 进行神经功能评分和头颅核磁平扫并留取脑组织标本。结果显示与对照组相比,RIPostC可以减少脑缺血后8、24 h和3、7 d的脑梗死体积,降低3和7 d的神经功能评分,说明RIPostC能改善缺血再灌注早期的神经功能评分,对缺血再灌注后远期(14和30 d)的脑梗死体积和神经功能并无影响,其原因可能与啮齿类动物的神经恢复功能很强,对照组的自身恢复已经使晚期的神经功能评分检测不出两组的差异。同时本课题只在脑缺血再灌注的早期给予了RIPostC,缺乏长期的应用,也可能是出现上述结果的原因之一。
[1]王伊龙,王拥军,吴敌,等.中国卒中防治现状[J].中国卒中杂志,2007,2(1):20-37.
[2]Murry C E,Jennings R B,Reimer K A.Preconditioning with ischemia:A delay of lethal cell injury in ischemic myocardium[J].Circulation,1986,74(5):1124-1136.
[3]Zhao Z Q,Corvera J S,Halkos M E,et al.Inhibition of myocardial injury by ischemic postconditioning during reperfusion:Comparison with ischemic preconditioning[J].Am J Physiol Heart Circ Physiol,2003,285(1):H579-588.
[4]Kerendi F,Kin H,Halkos M E.Brief renal ischemia and reperfusion applied before coronary artery reperfusion reduces myocardial infarct size via endogenous activation of adenosine receptors[J].Basic Res Cardiol,2005,100(5):404-412.
[5]Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniotomy in rats[J].Stroke,1989,20(1):84-91.
[6]Kim S J,Kim B K,Ko Y J,et al.Functional and histologic changes after repeated transcranial direct current stimulation in rat stroke model[J].J Korean Med Sci,2010,25(10):1499-1505.
[7]Belayev L,Alonso O F,Busto R,et al.Middle cerebral artery occlusion in the rat by intraluminal suture[J].Stroke,1996,27(9):1616-1622.
[8]卢旭霞,牛小媛,罗玉敏,等.远程缺血后适应对大鼠脑缺血——再灌注损伤的影响[J].中国脑血管病杂志,2010,7(3):139-142.
[9]宋兆晶,牛小媛,吉训明,等.远程缺血后适应对脑缺血损伤的实验研究[J].中国医学创新,2010,7(11):1-4.
[10]Ren C,Yan Z,Wei D.Limb remote ischemic postconditioning protects against focal ischemia in rats[J].Brain Res,2009,1288(8):88-94.
[11]Kin H,Zhao Z Q,Sun H Y,et al.Postconditioning attenuates myocardial ischemia-reperfusion injury by inhibiting events in the early minutes of reperfusion[J].Cardiovasc Res,2004,62(1):74-85.
[12]陈靖宜,刘菊英.大鼠心肌缺血再灌注损伤模型的制备及改进[J].临床误诊误治,2012,25(2):14-16.
