肿瘤坏死因子α诱导蛋白2在过敏性鼻炎小鼠模型中的表达及与血管生成的关系
2013-10-25王敏杨军尚军张罗*
王 敏 杨 军 尚 军 张 罗*
(1.首都医科大学附属北京同仁医院耳鼻咽喉头颈外科,北京100730;2.北京市耳鼻咽喉科研究所基础室,耳鼻咽喉头颈科学教育部重点实验室,北京100005;3.首都医科大学附属北京同仁医院中心实验室,北京100730)
过敏性鼻炎(allergic rhinitis,AR)是鼻科常见病之一,严重影响了患者的生活质量,并且与哮喘、鼻窦炎和呼吸道感染等多种疾病的发生密切相关。
近期研究[1-2]表明呼吸道重塑是过敏性鼻炎的重要特征。呼吸道重塑可导致呼吸道结构性变化,包括平滑肌肥大,杯状细胞增生、上皮下纤维化、炎性细胞浸润和血管生成增多。其中血管生成在呼吸道重塑中起着关键作用[3]。目前比较明确在过敏性鼻炎中参与血管生成的因子有血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)和血小板来源的生长因子(platelet-derived growth factor,PDGF)[3-4]。
肿瘤坏死因子α诱导蛋白2(tumor necrosis factor-α-inducible protein-2,TNFAIP2),又称 B94,最早发现是内皮细胞经TNF α刺激后表达的主要基因[5]。随后的研究[6-7]显示多种细胞经过多种物质刺激后均可诱导TNFAIP2的表达。目前认为TNFAIP2与多种肿瘤的形成有关[8-10],且功能主要是影响血管生成[8]。但是,血管生成因子 TNFAIP2在过敏性鼻炎中的作用目前尚不清楚,本研究将对此进行探讨,以期加深对AR发病机制的理解,并为AR治疗靶点的选择提供重要理论依据。
1 材料与方法
1.1 建立卵清蛋白(ovalbumin,OVA)诱导的过敏
性鼻炎小鼠模型的建立
用BALB/c小鼠进行AR动物模型的建立,具体建模方案参考文献[11]并作简单修改。在1 d和7 d用含50 μg OVA和5 mg Al(OH)3佐剂的0.9%氯化钠注射液400 μL进行致敏(i.p.)。1周后连续3周每周 3 d(14~35 d)鼻局部给予含 50 μg OVA的0.9%氯化钠注射液20 μL方式进行激发。最后一次激发2 h后处理小鼠收集血清和鼻黏膜,一部分鼻黏膜用于提取RNA,另一部分过夜固定用于免疫组织化学分析。上述为实验组,即OVA组。对照组,用0.9%氯化钠注射液代替OVA致敏和激发。实验组和对照组各6只小鼠。具体见图1。

图1 过敏性鼻炎小鼠的建模方案Fig.1 Experimental protocol of allergic rhinitis mouse model
1.2 鼻部症状与ELISA检测
最后一次激发后立即计数20 min内挠鼻和喷嚏的次数。血清中OVA特异性IgE用ELISA法检测,具体方法参考文献[12]。
1.3 实时定量 PCR检测
鼻黏膜组织总RNA用Trizol提取,用oligo(dt)反转录成cDNA。实时定量PCR仪器为Rotor-GeneTM6200 HRM(Corbett Life Science,Sydney,Australia)。Platinum SYBR Green qPCRSuperMixUDG购自美国Invitrogen公司。小鼠TNFAIP2引物QuantiTect Primer Assay QT00154812购自德国 Qiagen公司,小鼠CD31的引物序列参考文献[13];看家基因GAPDH的引物序列参考文献[14]。结果用delta delta Ct法分析。
1.4 组织学分析
鼻黏膜组织用10%的中性甲醛固定,然后石蜡包埋,切成厚度为4 μm的切片。HE染色用于观察嗜酸细胞,甲苯胺蓝染色用于观察肥大细胞,免疫组化染色用于观察TNFAIP2的表达。一抗TNFAIP2抗体购自美国Santa Cruz Biotechnology公司,HRP标记的二抗和底物DAB购自北京中杉金桥公司。
1.5 统计学方法
用SPSS 13.0进行统计学分析。计量资料以均数±标准差(ˉ±s)表示,组间比较用t-test。相关性采用Pearson相关系数描述。以P<0.05为差异有统计学意义。
2 结果
2.1 过敏性鼻炎小鼠模型
过敏性鼻炎小鼠的挠鼻症状和血清OVA-specific IgE水平均显著高于对照小鼠,且鼻黏膜组织中有明显的嗜酸细胞和肥大细胞浸润,表明过敏性鼻炎小鼠动物模型已成功建立(图2)。
2.2 过敏性鼻炎小鼠中TNFAIP2基因的表达
过敏性鼻炎小鼠鼻黏膜中TNFAIP2基因的表达比对照小鼠显著升高(P<0.01,图3)。
2.3 过敏性鼻炎小鼠中TNFAIP2蛋白的表达
对照小鼠鼻黏膜仅有少量TNFAIP2蛋白表达,而过敏性鼻炎小鼠中TNFAIP2蛋白的表达显著升高,而且在上皮层和皮下均有表达(图4)。
2.4 过敏性鼻炎小鼠中CD31基因的表达及其与TNAFIP2的相关性
过敏性鼻炎小鼠鼻黏膜中CD31基因的表达也比对照小鼠显著升高(P<0.05),且鼻黏膜中CD31和TNFAIP2基因的表达存在显著正相关(r=0.6399,P=0.025,图 5)。
3 讨论
鼻黏膜局部反应的研究往往比全身系统反应的研究更能反映疾病的本质。然而,由于过敏性鼻炎患者的鼻黏膜组织正常情况下无法获得,限制了对此疾病局部反应的研究。过敏性鼻炎小鼠模型的建立解决了这一难题,本课题组通过建立OVA诱导的过敏性鼻炎小鼠模型对鼻黏膜局部TNFAIP2的表达进行了观察。
鼻部症状的出现、过敏原特异性IgE的产生、嗜酸细胞和肥大细胞的浸润是过敏性鼻炎的重要特征[15]。与此一致,笔者用OVA致敏和激发的小鼠其挠鼻次数、OVA特异性IgE浓度和鼻黏膜局部嗜酸细胞和肥大细胞的聚集均明显高于正常对照,表明过敏性鼻炎小鼠模型建模成功。

图2 过敏性鼻炎小鼠模型的特征Fig.2 Characteristic of allergic rhinitis mouse model

图3 过敏性鼻炎小鼠鼻黏膜上皮组织TNFAIP2基因的表达Fig.3 Expression of TNFAIP2 gene in nasal mucosa
本研究发现过敏性鼻炎小鼠鼻黏膜局部TNFAIP2的表达显著升高。血管生成是过敏性鼻炎鼻黏膜组织重塑的重要特征之一,过敏性鼻炎患者鼻组织血管生成因子VEGF和PDGF表达水平显著升高[16-17],应用血管生成因子VEGF和PDGF受体阻断剂可改善过敏性鼻炎小鼠鼻气道重塑[3]。TNFAIP2也与血管生成有关,早期研究[18]发现血管生成的体外模型中TNFAIP2表达显著升高。另外,近期在鼻咽癌研究[8]中发现TNFAIP2的表达与微血管的密度相关。CD31是血管内皮细胞的标志分子,本研究中过敏性鼻炎小鼠鼻黏膜同样高表达 CD31,且与 TNFAIP2基因的表达相关。因此,TNFAIP2很可能通过影响血管生成参与了过敏性鼻炎的发生。
总之,本研究结果提示TNFAIP2可能参与了过敏性鼻炎的发生,且可能与血管生成相关,但具体机制如何,还有待进一步探讨。
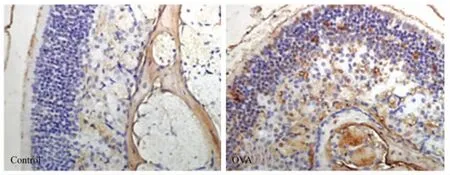
图4 过敏性鼻炎小鼠鼻黏膜上皮组织TNFAIP2免疫组化染色结果Fig.4 Expression of TNFAIP2 protein in nasal mucosal(400×)

图5 CD31基因的表达及其与TNFAIP2的相关性Fig.5 Expression of CD31 and correlation between CD31 and TNFAIP2
[1]Lim Y S,Won T B,Shim W S,et al.Induction of airway remodeling of nasal mucosa by repetitive allergen challenge in a murine model of allergic rhinitis[J].Ann Allergy Asthma Immunol,2007,98(1):22-31.
[2]Nakaya M,Dohi M,Okunishi K,et al.Prolonged allergen challenge in murine nasal allergic rhinitis:nasal airway remodeling and adaptation of nasal airway responsiveness[J].Laryngoscope,2007,117(5):881-885.
[3]Moon I J,Kim D Y,Rhee C S,et al.Role of angiogenic factors in airway remodeling in an allergic rhinitis murine model[J].Allergy Asthma Immunol Res,2012,4(1):37-45.
[4]Kirmaz C,Ozbilgin K,Yuksel H,et al.Increased expression of angiogenic markers in patients with seasonal allergic rhinitis[J].Eur Cytokine Netw,2004,15(4):317-322.
[5]Sarma V,Wolf F W,Marks R M,et al.Cloning of a novel tumor necrosis factor-alpha-inducible primary response gene that is differentially expressed in development and capillary tube-like formation in vitro[J].J Immunol,1992,148(10):3302-3312.
[6]Ma Y,Koza-Taylor P H,DiMattia D A,et al.Microarray analysis uncovers retinoid targets in human bronchial epithelial cells[J].Oncogene,2003,22(31):4924-4932.
[7]Cooper P,Potter S,Mueck B,et al.Identification of genes induced by inflammatory cytokines in airway epithelium[J].Am J Physiol Lung Cell Mol Physiol,2001,280(5):L841-852.
[8]Chen L C,Chen C C,Liang Y,et al.A novel role for TNFAIP2:its correlation with invasion and metastasis in nasopharyngeal carcinoma[J].Mod Pathol,2011,24(2):175-184.
[9]Liu Z,Wei S,Ma H,et al.A functional variant at the miR-184 binding site in TNFAIP2 and risk of squamous cell carcinoma of the head and neck[J].Carcinogenesis,2011,32(11):1668-1674.
[10]Kondratiev S,Duraisamy S,Unitt C L,et al.Aberrant expression of the dendritic cell marker TNFAIP2 by the malignant cells of Hodgkin lymphoma and primary mediastinal large B-cell lymphoma distinguishes these tumor types from morphologically and phenotypically similar lymphomas[J].Am J Surg Pathol,2011,35(10):1531-1539.
[11]KleinJan A,Willart M,van Nimwegen M,et al.United airways:circulating Th2 effector cells in an allergic rhinitis model are responsible for promoting lower airways inflammation[J].Clin Exp Allergy,2010,40(3):494-504.
[12]Wang M,Zhang W,Shang J,et al.Immunomodulatory effects of IL-23 and IL-17 in a mouse model of allergic rhinitis[J].Clin Exp Allergy,2013,43(8):956-966.
[13]Konno M,Hamazaki T S,Fukuda S,et al.Efficiently differentiating vascular endothelial cells from adipose tissuederived mesenchymal stem cells in serum-free culture[J].Biochem Biophys Res Commun,2010,400(4):461-465.
[14]Liu Y,Lu X,Yu H J,et al.The expression of osteopontin and its association with Clara cell 10 kDa protein in allergic rhinitis[J].Clin Exp Allergy,2010,40(11):1632-1641.
[15]Baraniuk J N.Pathogenesis of allergic rhinitis[J].J Allergy Clin Immunol,1997,99(2):S763-772.
[16]Matsune S,Ohori J,Sun D,et al.Vascular endothelial growth factor produced in nasal glands of perennial allergic rhinitis[J].Am J Rhinology,2008,22(4):365-370.
[17]Mori S,Fujieda S,Sunaga H,et al.Expression of plateletderived endothelial cell growth factor and vascularity in the nasal mucosa from allergic rhinitis[J].Clin Exp Allergy,2000,30(11):1637-1644.
[18]Sarma V,Wolf F W,Marks R M,et al.Cloning of a novel tumor necrosis factor-alpha-inducible primary response gene that is differentially expressed in development and capillary tube-like formation in vitro[J].J Immunol,1992,148(10):3302-3312.
