降解2,6-二叔丁基苯酚菌种的驯化与鉴定
2013-10-25马海娟
马海娟
(开朗(上海)生态科技有限公司,上海 201203)
含酚有机物被广泛地用于木材防腐剂、防锈剂、杀菌剂和杀虫剂等,是化工、钢铁等工业废水的主要有毒成分。其对许多微生物具有抑制毒害作用,在环境中难以被微生物分解。国内外有许多对这类物质生物降解研究的报告[1-3],但对2,6-二叔丁基苯酚(2,6-DTBP)生物降解报道很少[4]。2,6-二叔丁基苯酚是受阻酚类抗氧化剂的主要母体,广泛用于橡胶、化纤等行业,同时又是合成医药中间体的重要原料,也可直接用作润滑油抗氧剂。该物质对水中的鱼类、藻类和微生物有很大的毒害作用[5],且难于生物降解[6]。本研究以2,6-二叔丁基苯酚为唯一碳源,通过菌种采集、平板分离纯化,初步筛选出对2,6-二叔丁基苯酚有降解作用的菌株。对筛选出的多株菌种进行对底物降解作用的考察,从中选出实验所用菌种,对其驯化,并进行了形态学、生理生化以及分子生物学的鉴定,以期为高效降解工业废水提供优良的微生物菌种。
1 材料与方法
1.1 材料
1.1.1 试验菌株 采自上海某石化腈纶厂废水处理站的塔式生物滤池和沉淀池水,经分离和筛选得到1株能降解2,6-二叔丁基苯酚的M-Z-8菌株。
1.1.2 试验底物 2,6-二叔丁基苯酚(2,6-DT-BP),分析纯,由北京助剂研究所提供。
1.1.3 萃取剂 正己烷,分析纯(≥97.0%),由中国医药(集团)上海化学试剂公司提供。
1.1.4 培养基 肉汤培养基[7]:牛肉膏5 g,NaCl 5 g,蛋白胨10 g,蒸馏水1 L,pH 7.2(固体培养基另加琼脂16 g);Bushnell-Hass(B.H.)基础培养基[8]:MgSO40.2 g,KH2PO41 g,(NH4)2SO41 g,CaCl20.02 g,K2HPO41 g,FeCl3(60%)2 滴浓缩液,蒸馏水 1 L,pH 7.0。
1.1.5 菌悬液 将32℃下生长24 h的斜面菌种接种到装有30 mL肉汤培养基的250 mL三角烧瓶中,在37℃、250 r/min的恒温摇床中培养24 h。然后将种子液经过3次离心(8000 r/min,每次10 min,4 ℃)、2次水洗(用0.85%无菌生理盐水),最后用同样的生理盐水稀释成一定浓度(以单位体积的细胞湿重(w/v)表示)的菌悬液。
1.2 方法
1.2.1 驯化及其效果考察 ①菌种驯化:将3 mL浓度为3%的M-Z-8菌株菌悬液接种到含30 mL的B.H.基础培养基的三角烧瓶中,加入浓度为500 mg/L的2,6-二叔丁基苯酚作为唯一碳源和能源。在37℃、250 r/min的摇床中培养,待培养基溶液明显浑浊后,再取上述驯化液3 mL接种到含浓度为500 mg/L的2,6-二叔丁基苯酚的30 mL新鲜B.H.基础培养基中继续驯化。重复多次,最后取上述驯化液进行效果实验;②驯化效果考察方法:分别取未经驯化的斜面菌种和4次驯化后的菌液接种到肉汤培养基上增殖,30℃恒温培养20 h后,制备成3%的菌悬液。再接种1 mL菌悬液到底物浓度为100 mg/L的30 mL B.H.基础培养基(pH=7.0)中(相当于接种量为0.1%)。将未接种和接种的三角瓶置于37℃、250 r/min摇床培养,相隔一定时间取样,测定2,6-二叔丁基苯酚的浓度变化。
1.2.2 样品分析 ①检测条件的确定:采用UV-2201型紫外-可见分光光度计(日本岛津公司)分析2,6-二叔丁基苯酚的浓度变化。通过对不同浓度的样品扫描,发现276 nm为2,6-二叔丁基苯酚的紫外特征吸收波长,故选择在λ=276 nm时测定样品;②样品预处理及分析:在含30 mL样品溶液的各摇瓶(包括空白对照样品瓶)中加入10 mL正己烷,振荡2 min后迅速倒入离心管,4℃、8000 r/min条件下在Sorvall SuperT21离心机上离心8 min,抽取上清液2 mL,于10 mL容量瓶中定容至刻度,276 nm处用紫外-可见分光光度计测定2,6-二叔丁基苯酚的浓度。
1.2.3 菌种的鉴定 主要参照伯杰氏手册[9-10]和其他相关的文献[11-12],通过形态和生理生化等特征研究,对本研究所使用的菌种进行鉴定。①菌落特征:在肉汤培养基琼脂平板上划线接种,30℃培养3 d,观察菌落特征;②菌体形态:菌体涂片后,采用结晶紫简单染色法进行染色,然后在光学显微镜下(放大1500倍)观察菌体形态、大小。采用革兰染色法观察菌株的革兰染色结果。通过透射电镜观察鞭毛数量及着生位置等特征。
1.2.4 菌种的16S rDNA序列分析 ①细菌总DNA提取:用SDS-蛋白酶K裂解,十六烷基三甲基溴化铵(CTAB)沉淀细胞碎片和多糖,再用异丙醇沉淀提取总DNA;②PCR引物:采用细菌16S rDNA通用引物F27(5'-AGAGTTTGATCATGGCTCAG-3')和 R1492(5'-TACGGTTACCTTGTTACGACTT-3')通过PCR扩增供试菌的16S rDNA片段[13];③PCR扩增、产物回收、连接转化以及测序:用引物对模板做PCR扩增反应,PCR的反应体系:10 × PCR Buffer 5 μL,MgCl25 μL,dNTP 1 μL,F27引物 2 μL,R1492 引物 2 μL,Template 0.5 μL,Taq 酶 0.5 μL,ddH2O 39 μL。反应为35个循环,95℃保温10 min;94℃变性30 s,56℃退火30 s,72℃延伸1 min;35个循环后再72℃延伸10 min。凝胶回收试剂盒回收凝胶上的PCR产物,用pMD18-T载体(大连宝生物公司)进行连接,转化大肠埃希菌DH5α的感受态细胞,然后挑取单克隆至4 mL氨苄抗性的LB培养基中37℃、250 r/min培养过夜。在2%的琼脂糖胶上电泳后,将胶进行染色,紫外灯下观察,与克隆前PCR产物的大小一致,确定为阳性克隆。将确定为阳性克隆的菌体进行测序;④同源性比较:将测序结果用BLAST软件与GenBank中的16S rDNA序列进行同源性比较。
2 结果与分析
2.1 菌种的驯化效果
菌种驯化的方式各种各样,由于菌种对污染物具有一个适应的过程,可通过逐渐提高污染物底物浓度的方式,也可直接在高浓度下或通过诱变等方式对菌种进行驯化培养。本实验采用高浓度情况下对菌种进行驯化,来获得高活性的2,6-二叔丁基苯酚降解菌种。
图1所示的结果表明,未经驯化的M-Z-8菌株在12 d的时间里对2,6-二叔丁基苯酚的去除率为40.1%,而经过4次驯化后的菌种在相同条件下对底物的平均去除率达到了51.6%,与未驯化菌种相比,经驯化后的菌种对100.0 mg/L浓度的底物降解率提高了12%。
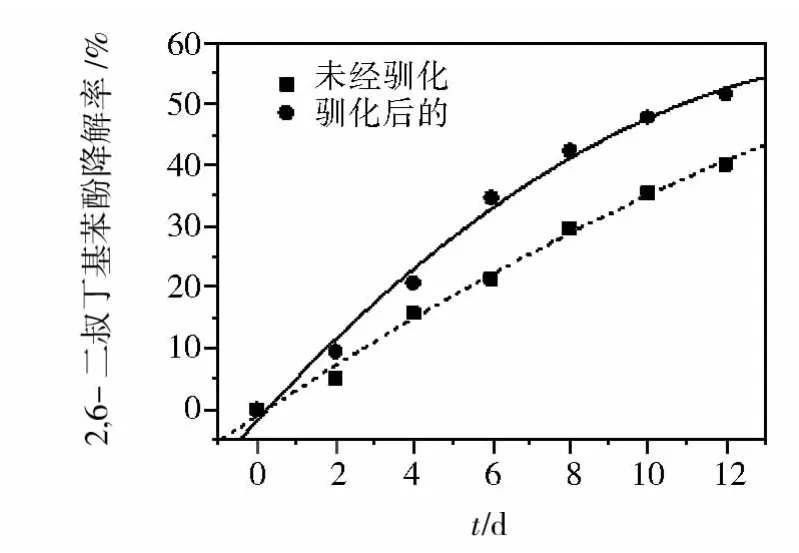
图1 驯化M-Z-8菌株对底物降解的影响Fig.1 The effect of acclimation on 2,6-DTBP degradation by M-Z-8
一般而言,当菌种进入到一个新环境时,对污染物存在着一段时间的适应期[14]。在此适应期内,微生物要通过诱导酶的合成,而且需要合成必需的辅酶或中间代谢物,来达到对污染物的适应,这期间对污染物的生物降解速率很小。一旦微生物被驯化,微生物便表现出很高的生物降解能力。在生物降解的后期,可能是由于降解产物的积累导致产生反馈抑制作用,也可能产生一些代谢产物改变了培养液理化性能,或产生一些有毒物质影响菌种生长,造成随后的降解速率趋于平缓。
2.2 鉴定结果
2.2.1 形态特征 菌体形态:M-Z-8菌株为革兰阴性细菌,杆状,单个或2个存在,大小为(0.3~0.5)μm ×(1.0 ~3.0)μm,极生鞭毛(见图2)。
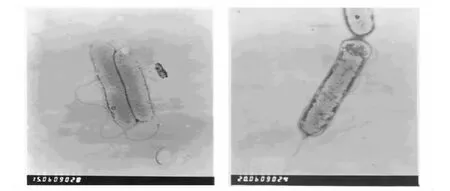
图2 M-Z-8菌株的透射电镜图(20000×)Fig.2 TEM of M-Z-8 strain(20000 × )
M-Z-8菌株菌落呈圆形,Φ1.0~2.0 mm,蜜黄色,不透明,表面光滑,湿润,低凸起,边缘整齐。
2.2.2 生理生化特征 表1列出了菌株M-Z-8的生理生化特征试验结果。

表1 菌株M-Z-8的生理生化特征Table 1 Physiological&biochemical characteristics of M-Z-8 strain
根据实验结果并结合文献资料,确认M-Z-8菌株符合气单胞菌属(Aeromonas)的特征,将M-Z-8菌株鉴定为气单胞菌(Aeromonas sp.)。
2.2.3 16S rDNA序列分析及其同源性比较 以M-Z-8菌株的总DNA为模板,利用对细菌16S rDNA特异的引物F27和R1492进行PCR扩增,得到长约1.5 kb的PCR扩增产物,将获得的1.5 kb扩增产物进行DNA序列测定,结果见图3。

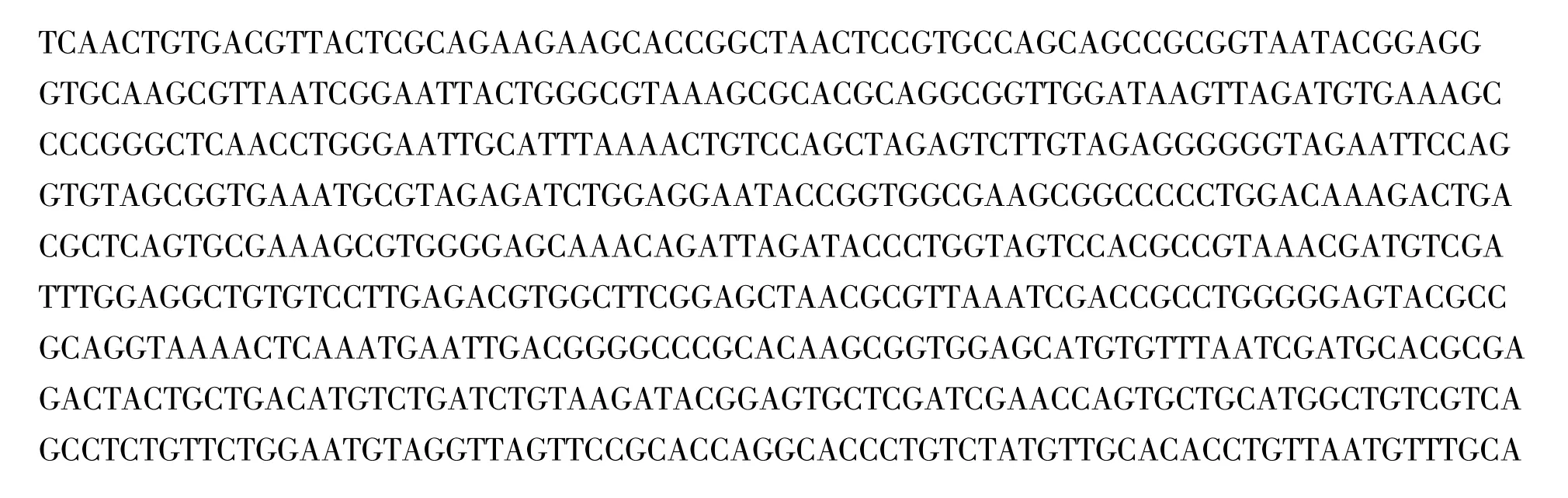
图3 M-Z-8菌株的16S rDNA核苷酸序列Fig.3 The sequence of 16S rDNA fragment of M-Z-8 strain
用BLAST程序对M-Z-8菌株的16S rDNA序列和GenBank中已登录的16S rDNA序列进行核苷酸同源性比较,结果发现与多株气单胞菌种属的16S rDNA核苷酸序列同源性均在97%以上,其中包括Aeromonas hydrophila、Aeromonas molluscorum、Aeromonas encheleia、Aeromonas eucrenophila、Aeromonas salmonicida 和 Aeromonas popoffii,与生理鉴定结果吻合,对于其准确的分类地位需要结合其他的细菌学手段予以确定。
3 讨论
以2,6-二叔丁基苯酚为唯一碳源对初筛得到的菌种进行驯化,获得了1株对2,6-二叔丁基苯酚有较强降解能力的菌种。该菌株经过驯化后,对底物的生物降解能力比未驯化时有所提高,说明其对环境的适应能力有了提高。
通过对菌株进行的形态学以及生理生化鉴定,初步表明M-Z-8菌株为气单胞菌种属(Aeromonas sp.)。
对M-Z-8菌株的16S rDNA序列进行核苷酸同源性比较,与气单胞菌种属的16S rDNA核苷酸序列同源性均在97%以上,包括Aeromonas hydrophila、Aeromonas molluscorum、Aeromonas encheleia、Aeromonas eucrenophila、Aeromonas salmonicida和Aeromonas popoffii。其与生理鉴定结果相吻合。
[1]Huban C M,Plownman R D.Bioaugmentation:Put microbes to work[J].Chemical Engineering,1997,104(3):74-84.
[2]徐威,关海滨,宋明,等.高效苯酚降解菌的选育及降酚特性[J].微生物学杂志,2008,28(1):68-71.
[3]沈齐英,申林波.苯酚好氧降解菌的驯化和筛选[J].微生物学杂志,2002,22(6):15-16,42.
[4]张志刚.固定化优势菌降解2,6-二叔丁基酚的研究[J].中国西部科技,2007,8(9):1-2.
[5]U.S.Environmental Protection Agency.G034.2,6-Di-tertbutylphenol test results[128-39-2].
[6]张亚雷.难降解有机废水(腈纶废水)处理工艺及其污染物生物降解性能研究[D].上海:同济大学,1999:77-79.
[7]胡家骏,周群英.环境工程微生物学[M].北京:高等教育出版社,1988:226.
[8]Bushnell L D,Hass H F.The utilization of certain hydrocarbons by microorganisms[J].Journal of Bacteriology,1941,41(5):653-673.
[9]Krieg N R,Holt J G.Bergey's manual of systematic bacteriology(Volume 1)[M].Baltimore:The Williams& Wilkins Co.,1984:361-373.
[10]Holt J G,Krieg N R,Sneath P H A.Bergey's manual of determinative bacteriology(9th ed.)[M].Baltimore:The Williams& Wilkins Co.,1994:75,131.
[11]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:66,106-107,117-119,370-383.
[12]中国科学院微生物研究所细菌分类组.一般细菌常用鉴定手册[M].北京:科学出版社,1978:8,64-71.
[13]徐玉泉,张维,陈明,等.一株苯酚降解菌的分离与鉴定[J].环境科学学报,2000,20(4):450-455.
[14]王菊思,赵丽辉,匡欣.合成有机化合物的生物降解性研究[J].环境化学,1993,12(3):161-172.
