1株根结线虫拮抗放线菌新种的分离与鉴定
2013-10-25黄惠琴袁维道孙前光鲍时翔
黄惠琴,袁维道,王 英,魏 华,朱 军,孙前光,鲍时翔
(中国热带农业科学院热带生物技术研究所农业部热带作物生物学与遗传资源利用重点实验室,海南 海口 571101)
由根结线虫(Meloidogyne spp.)危害植物根系引起的根结线虫病是一种世界性的土传病害,分布广、危害大,给许多国家的农林、园艺等产业造成巨大损失。我国热带、亚热带地区及寒带温室内作物、蔬菜都有根结线虫发生,一般造成减产10% ~20%,严重时减产达70%以上[1]。特别在南方热带、亚热带地区,病原线虫无越冬现象,造成世代重叠和虫口在土壤中的大量累积,繁殖系数极高,危害更为严重。对海南岛的调查结果显示,果树中的香蕉、番石榴、番木瓜、胡椒以及几乎所有的茄果类、豆类蔬菜均遭受到根结线虫侵害,严重危害着农业生产[2]。目前针对根结线虫病害主要采用化学农药进行防治,造成的生态平衡破坏、水土污染等副作用日益严重,从微生物代谢产物中寻找具有根结线虫拮抗活性物质以开发生物农药越来越受到国内外重视。红树林是生长在热带亚热带海岸潮间带、受周期性海水浸淹、以红树植物为主体的潮滩湿地木本生物群落。作为四大海洋高生产力生态系统之一,其创造了丰富又极具特色的微生物资源,赋予了红树林微生物产生特殊活性物质的潜在可能性,目前的研究主要集中在抗菌、抗肿瘤活性等方面,在抗根结线虫方面,国内外研究不多。本研究从红树林生态系统中采集样品,分离筛选具有杀线虫活性的放线菌资源,并对活性菌株进行分类鉴定,旨在为开发新型杀虫生物农药提供科学依据。
1 材料与方法
1.1 材料
1.1.1 样品采集 底泥样品于2011年4月采集自海南省东寨港红树林。
1.1.2 培养基[3]放线菌分离培养基:高氏一号合成培养基、腐植酸-维生素培养基、酵母粉-淀粉培养基;形态特征鉴定培养基:高氏一号合成培养基、酵母粉-淀粉培养基、无机盐淀粉培养基、甘油天门冬素培养基、燕麦汁培养基和土豆汁培养基;液体发酵培养基(%):玉米粉 1.0,酵母粉 0.1,黄豆粉 1.0,淀粉 0.5,KH2PO40.05 ,黄豆粉和玉米粉煮沸过滤,取汁,pH 7.2。所有培养基均用陈海水配制。
1.2 方法
1.2.1 放线菌分离 将底泥样品自然风干后待用。采用3种预处理方式:直接使用、55℃处理6 min、120℃干热处理1 h。取适量土壤制成水悬液,用无菌陈海水分别稀释至10-2、10-3,涂布到放线菌分离培养基,28℃倒置培养5~15 d,挑取单菌落于高氏一号培养基上划线分离,获得纯培养。
1.2.2 发酵液制备 挑取纯化后的放线菌单菌落,接种于发酵培养基,28℃、180 r/min振荡培养7 d,10000 r/min 离心10 min,备用。
1.2.3 抗根结线虫放线菌的筛选 ①供试线虫:初筛时使用松材线虫作为供试线虫,以镰刀菌培养[4];复筛时使用花生根结线虫(M.arenaria),由采自胡椒根部的根结线虫卵块28℃孵化所得;②初筛:采用24孔板法筛选[5]。在24孔板中分别加入50 μL发酵液、550 μL无菌蒸馏水和400 μL(约200条)松材线虫混悬液,混合均匀,28℃静置24 h后用倒置显微镜观察,僵直或卷曲不动的虫体视为被击倒,以发酵培养基为对照,每个处理重复3次,计算线虫校正击倒率。向24孔板中加入清水600 μL,观察恢复情况,不能恢复活性的记为死亡,计算校正死亡率。
校正击倒率(%)=100×(处理击倒率-对照击倒率)/(1-对照击倒率)
校正死亡率(%)=校正击倒率×(1-恢复率);③复筛:对初筛时校正死亡率在50%以上的菌株,使用花生根结线虫进行复筛,方法同1.2.3中②。
1.2.4 放线菌的分类鉴定 ①形态与培养特征:采用平皿插片法[6],28℃培养1~2周,观察菌株基内菌丝、气生菌丝、有无色素产生等特征,在显微镜和扫描电镜下观察菌丝及孢子形态;②生理生化特征:生理生化特征鉴定参照文献[7]的方法进行;③16S rDNA序列测定及其系统发育分析:用试剂盒法提取菌株基因组DNA。以提取的DNA为模板,扩增引物为通用引物27f(5'-AGAGTTTGATCCTGGCTCAG-3')和1492r(5'-GGTTACCTTGTTACGACTT-3')。PCR反应条件:94 ℃ 5 min;94 ℃ 1 min,55 ℃ 30 s,72 ℃ 1 min,30个循环;72℃ 10 min,4℃保存。PCR反应产物经1%琼脂糖凝胶电泳检测,检测合格后送生工生物工程(上海)有限公司测序。将所得序列通过 Blast程序和 GenBank、EzTaxon server[8]中核酸数据进行比对,采用Clustal X(Version1.8)进行多序列匹配排列,通过MEGA 4.1软件包中的Kimura 2-parameter方法计算进化距离,用Neighbor-joining法构建系统发育树[9];④DNA(G+C)mol%与DNA-DNA杂交率的测定:采用试剂盒法提取菌株基因组DNA。经高氯酸水解后,采用反相高效液相色谱法[10]测定(G+C)mol%。采用微孔板法进行DNA杂交[11],碱性磷酸酶标记链亲和素法测定杂交率[12],测定3次取平均值。
2 结果与分析
2.1 红树林放线菌的分离
对于自然风干的样品,在分离培养基上3~5 d后开始生长放线菌,同时也出现少量细菌菌落。对于55℃处理6 min的样品,细菌数量减少,放线菌种类和数量最多;对于120℃干热处理1 h的样品,培养基上没有细菌生长,链霉菌的数目也较少,稀有放线菌的数量明显增多,其中腐植酸-维生素培养基上生长出来的稀有放线菌最多。本实验从红树林土壤中共分离到206株放线菌,根据菌落形态及代表菌株的测序结果,大致分布在7个属,其中链霉菌属(Streptomyces)的数量最多,占总量的63.1%(130株);稀有放线菌占总量的36.9%(76株),其中小单孢菌属(Micromonospora)占18.4%(38 株),糖多孢菌属(Saccharopolyspora)占7.8%(16株),假诺卡氏菌属(Pseudonocardia)、束村氏菌属(Tsukamurella)、拟诺卡氏菌属(Nocardiopsis)分别占2.9%(6株),白蚁菌属(Isoptericola)占1.9%(4株)。分离结果与文献报道的链霉菌与小单孢菌是海岸湿地的主要放线菌类群结论一致[10]。
2.2 根结线虫拮抗放线菌的筛选
从206株放线菌中,初筛获得抗松材线虫校正死亡率50%以上的菌株28株,占供试菌株的13.6%;复筛时,当发酵液稀释40倍、处理时间24 h,获得抗根结线虫校正死亡率40%以上的菌株3株,其中菌株HA11166校正死亡率为51.6%。对该菌株连续继代培养5次,其抗虫活性稳定,表明其产生抗线虫活性物质的遗传性能是稳定的。
2.3 活性菌株HA11166的鉴定
2.3.1 形态和培养特征 菌株HA11166在试验用的6种固体培养基上均生长良好,形成丰富的基内菌丝和气生菌丝。基丝浅黄色至黄褐色,无可溶性色素产生。气丝白色至乳白色,分枝少,长、直或不规则弯曲,有横隔,Z字形折曲。孢子椭圆形至长柱形,表面光滑(图1)。
2.3.2 生理生化鉴定 菌株HA11166能利用D-葡萄糖、D-果糖、L-鼠李糖、L-脯氨酸、D-木糖、L-阿拉伯糖、D-甘露糖、纤维二糖、D-半乳糖、甘氨酸、麦芽糖、山梨醇、甘露醇,不能利用蔗糖、D-棉子糖、丙三醇、山梨酸、3,5-二硝基水杨酸、乙酰水杨酸、肌醇。硝酸盐还原,淀粉水解,纤维素不水解,明胶不液化,牛奶不凝固不胨化,不产生黑色素和H2S。pH生长范围为 6.0~12(最适 pH 7.0),温度生长范围为4~43℃(最适37℃),盐度生长范围为0% ~5%(最适1%)。对氯霉素、红霉素、卡那霉素、利福霉素、四环素、新生霉素、新霉素和氨苄青霉素敏感,对萘啶酸、庆大霉素不敏感。主要脂肪酸为 iso-C14:0(9.6%)、ant-C15:0(32.8%)、iso-C16:0(19.2%)、C16:0(8.3%)和C16:1ω9c(8.5%)。主要磷酸类脂为磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)、磷脂酰肌醇甘油糖苷(phosphatidylinositol mannosides,PIM)、磷脂酰胆碱(phosphatidyl choline,PC)和一种未知糖脂(unknown glycolipid,GL)。
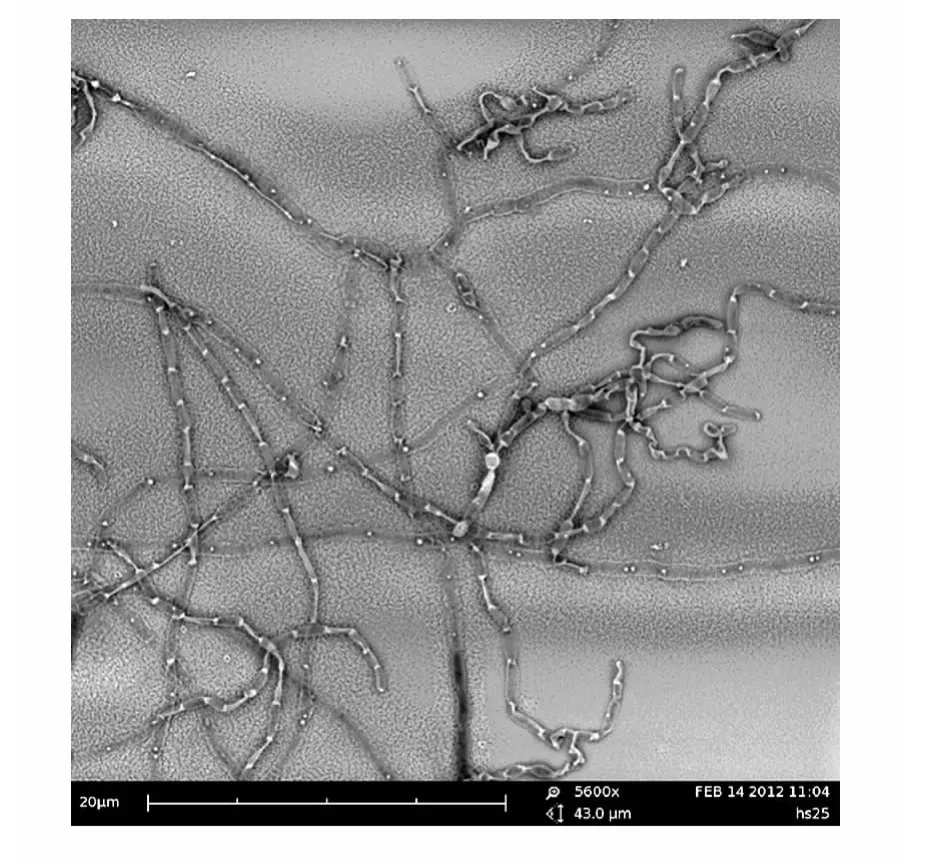
图1 菌株HA11166菌丝与孢子扫描电镜照片(5600×)Fig.1 Scanning electron micrograph of strain HA11166(5600×)
2.3.3 16S rDNA序列测定及系统发育分析 经测序获得菌株HA11166的16S rDNA近全长序列1385 bp,所得序列经校对后提交GenBank,登录号为JQ799045。采用Blast和EzTaxon软件比对,同源性高的均为Nocardiopsis(拟诺卡氏属),同源性最高的模式菌株为海藻糖拟诺卡氏菌Nocardiopsis trehalosi VKM Ac-942T(98.3%),其次为堆肥拟诺卡氏菌Nocardiopsis composta KS9T(97.6%)、苍黄拟诺卡氏菌Nocardiopsis gilva YIM 90087T(97.5%)。根据序列同源性从高到低的顺序选取8株模式菌株,利用 ClustalX(1.8)和 Mega 4.1软件构建系统发育树(图2),菌株HA11166与Nocardiopsis trehalosi VKM Ac-942T处于同一分支,亲缘关系最近。
2.3.4 (G+C)mol%与DNA-DNA杂交率测定结果 经测定,菌株HA11166的(G+C)mol%为73.7%。菌株 HA11166与 Nocardiopsis trehalosi VKM Ac-942T的DNA-DNA杂交率为38.8%。

图2 基于16S rDNA的菌株HA11166与相关菌株的系统发育树Fig.2 Phylogenetic tree of strain HA11166 and related strains based on 16S rDNA
3 讨论
根结线虫病的生物防治资源包括天敌真菌、细菌、放线菌及其代谢产物和植物等。自20世纪70年代中期,根结线虫的生物防治便开始受到全世界的关注,其中研究较多的是食线虫真菌(Nematophagous fungi)、专性寄生细菌(Obligate endoparasitic bacteria)、根际细菌(Rhizobacteria)和放线菌(Actinomycetes)。作为抗生素的主要来源,放线菌在线虫生防研究中,主要是基于杀虫活性物质来实现的。如:由放线菌产生的莫比霉素(Milbemycin)、南昌霉素(Nanchangmycin),成为安全高效低毒杀虫剂首选材料的阿维菌素(Avermectin)也是从除虫链霉菌(Streptomyces avermitilis)代谢产物中发现的[13]。田阳等[14]发现海洋放线菌 M1D14 发酵产物对3种线虫具有抑制作用,尤其对南方根结线虫(Meloidogyne incognita)毒力最强,具有很好的应用前景。国外在该方面的研究不多,Saroj等[15]曾报道筛选到15株放线菌对自由生活线虫Panagrellus redivivus具有杀线虫活性。本课题组近年来从海洋放线菌中筛选到多株放线菌对根结线虫具有拮抗作用,包括链霉菌、小单孢菌(Micromonospora)、糖多孢菌(Saccharopolyspora)、假诺卡氏菌(Pseudonocardia)、拟诺卡氏菌等属,本文对拟诺卡氏菌株HA11166进行了首次报道。
对于放线菌的分类鉴定,一般认为2菌株16S rDNA序列同源性小于97%为不同的种,但同源性大于97%时也不一定是同一个种。DNA-DNA杂交被确定为建立新种的必要标准之一,用于种水平上的分类学研究。1987年,国际系统细菌学委员会(ICSB)规定,DNA同源性≥70%或杂交分子的热解链温度差≤2℃为细菌种的界限。在本实验中,菌株HA11166与Nocardiopsis trehalosi VKM Ac-942T的16S rDNA相似性为98.3%,在发育树上处于同一分支,亲缘关系最近。2菌株DNA-DNA杂交率仅为38.8%,小于细菌定种的界限70%。在形态与生理生化特征方面二者也存在一定差异(表1)。因此,基于16S rDNA序列相似性、系统发育分析、分子水平鉴定以及生理生化特性结果,将菌株HA11166T鉴定为拟诺卡氏菌属的一个新种,建议命名为东寨港拟诺卡氏菌(Nocardiopsis dongzhaigangensis sp.nov.),HA11166T为模式菌。
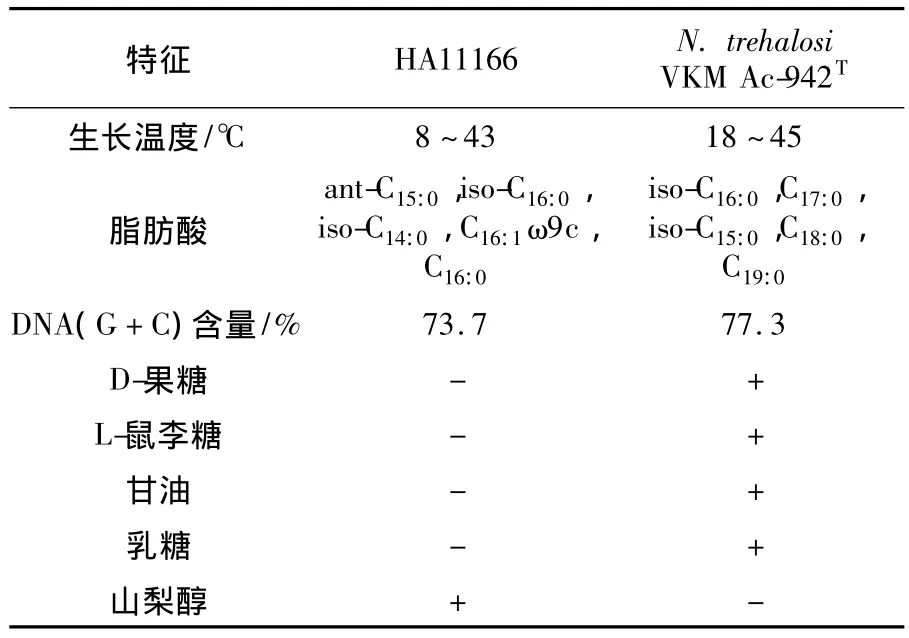
表1 菌株HA11166与N.trehalosi VKM Ac-942T特征差异比较Table 1 Differential characteristics of strain HA11166 and N.trehalosi VKM Ac-942T
模式菌株HA11166T(Nocardiopsis dongzhaigangensis sp.nov.)的特征描述:细胞革兰阳性、好氧,气丝白色至乳白色,分枝少,长、直或不规则弯曲,有横隔,Z字形折曲。孢子椭圆形至长柱形,表面光滑。基丝浅黄色至黄褐色,无可溶性色素产生。pH生长范围6.0~12.0,最适 pH 7.0。温度生长范围4~43℃,最适37℃。NaCl耐受范围0% ~5%,最适1%。能利用 D-葡萄糖、D-果糖、L-鼠李糖、L-脯氨酸、D-木糖、L-阿拉伯糖、D-甘露糖、纤维二糖、D-半乳糖、甘氨酸、麦芽糖、山梨醇、甘露醇,不能利用蔗糖、D-棉子糖、丙三醇、山梨酸、3,5-二硝基水杨酸、乙酰水杨酸、肌醇。硝酸盐还原,淀粉水解,纤维素不水解,明胶不液化,牛奶不凝固不胨化,不产生黑色素和H2S。对氯霉素、红霉素、卡那霉素、利福霉素、四环素、新生霉素、新霉素和氨苄青霉素敏感,对萘啶酸、庆大霉素不敏感。主要脂肪酸 为 iso-C14:0、ant-C15:0、iso-C16:0、C16:0和 C16:1ω9c。主要磷酸类脂为PE、PIM、PC和未知糖脂GL。(G+C)mol%为73.7%。模式种HA11166T分离于海南省东寨港红树林底泥。
[1]汪来发,杨宝君,李传道.根结线虫生物防治研究进展[J].南京林业大学学报,2002,26(1):64-68.
[2]张晓黎.穿刺巴氏杆菌的分离与鉴定[D].海南大学硕士学位论文,2011.
[3]魏华.抗根结线虫红树林放线菌的分离、筛选及3株活性菌株的鉴定[D].海南大学硕士学位论文,2012.
[4]曾永三,冯志新.松材线虫的人工培养研究[J].仲恺农业技术学院学报,1996,9(1):44-49.
[5]雷敬超,李传浩,黄惠琴.杀线虫海洋放线菌的筛选及菌株HA07011的鉴定[J].生物技术通报,2007(6):147-149.
[6]钱存柔,黄仪秀.微生物学实验教程[M].北京:北京大学出版社,1999:24.
[7]徐丽华,李文均,刘志恒,等.放线菌系统学[M].北京:科学出版社,2007:4.
[8]Chun J,Lee J H,Jung Y,et al.EzTaxon:a web-based tool for the identification of prokaryotes based on 16S ribosomal RNA gene sequences[J].Int J Syst Evol Microbiol,2007,57(10):2259-2261.
[9]Kumar S,Nei M,Dudley J,et al.MEGA:a biologist-centric software for evolutionary analysis of DNA and protein sequences[J].Brief Bioinform,2008,9(4):299-306.
[10]Tamaoka J,Komagata K.Determination of DNA base composition by reversed-phase high-performance liquid chromatography[J].FEMS Microbiol Lett,1984,25(1):125-128.
[11]Ezaki T,Hashimoto Y,Yabuuchi E.Fluorometric deoxyribonucleic acid-deoxyribonucleic acid hybridization in microdilution wells as an alternative to membrane filter hybridization in which radioisotopes are used to determine genetic relatedness among bacterial strains[J].Int J Syst Bacteriol,1989,39(3):224-229.
[12]Christensen H,Angen O,Mutters R,et al.DNA-DNA hybridization determined in microwells using covalent attachment of DNA[J].Int J Syst Evol Bacteriol,2000,50:1095-1102.
[13]Schulman M D,Valentino D,Hensens O.Biosynthesis of the avermectins by Streptomyces avernitilis.Incorporation of labled precuosors[J].J Antibiot,1986,39(4):541-549.
[14]田阳,李平,张莉,等.海洋放线菌M1D14代谢产物对几种重要植物寄生线虫的抑制作用[J].植物保护,2012,38(4):96-100.
[15]Saroj K M,James E K,James R M,et al.Insecticidal and nematicidal properties of microbial metabolites[J].J Indus Microbiol,1987,2(5):267-276.