嗜麦芽寡养单胞菌D2株2套Ⅱ型分泌系统的全基因簇序列测定及分析
2013-10-25毕春霞秦江楠闫志勇
张 卫,毕春霞,罗 玮,秦江楠,陈 豪,王 斌,闫志勇*
(1.青岛大学医学院微生物教研室,山东 青岛 266071;2.青岛市立医院 检验科,山东 青岛 266071)
嗜麦芽寡养单胞菌(Stenotrophomonas mahophilia)是一种革兰阴性非发酵菌,广泛存在于自然界及人和动物体内,是目前引起院内感染的常见病原菌之一。近年来由该菌引起的感染迅速增加,而且对抗菌药物呈现多重耐药而引起人们广泛关注[1]。随着细菌蛋白质工程研究的不断深入,人们不仅关注细菌蛋白质的结构、理化特性、生物功能,更关注其分泌过程,嗜麦芽寡养单胞菌的许多生物学活性、致病性、耐药性等与其分泌各种蛋白质密切相关。作为革兰阴性细菌蛋白分泌主要途径,T2SS(TypeⅡSecretion System,T2SS)一般由分泌途径转膜蛋白基因簇为中心[2],主要涉及12~16种蛋白,且数量具有种属特异性。T2SS在细菌的生理活动中发挥关键作用,它不仅存在于各种病原菌中,而且是攻击宿主细胞和组织的各类消化酶外排必经之路,有研究表明病原菌T2SS缺失株的毒力明显减低[3],可见,研究细菌的分泌系统具有重要的意义。本实验室从海洋双齿围沙蚕消化道分离得到1株嗜麦芽寡养单胞菌D2株,研究发现该菌能分泌大量的 SMP蛋白(GenBank 收录号 GQ413951)[4],据绘制出的 SMP基因结构草图分析显示,该基因与Ⅱ型分泌系统转膜蛋白基因簇(Gsp,general secretory pathway transmembrane protein)紧密串联,同时根据该基因的功能、氨基酸序列、信号肽(N'端24个氨基酸具有显著的Sec信号肽特征)等特征推测,该蛋白是依赖T2SS来实现跨膜转运的[5]。据此采用基因移步法,成功测定出了嗜麦芽寡氧单胞菌的2套T2SS,为进一步研究该菌T2SS的功能及蛋白分泌机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 嗜麦芽寡养单胞菌D2株是从海洋生物双齿围沙蚕消化道中分离获得菌株(中国微生物菌种保藏管理委员会普通微生物中心收藏号为 CGMCC 1868)[4];pMD18-T载体购自大连宝生物工程有限公司;大肠埃希菌JM109为本实验室保存。
1.1.2 主要试剂 细菌基因组DNA抽提试剂盒、DNA凝胶回收试剂盒购自Promega公司;Prime-STAR HS polymerase、DNA Marker、dNTPs 等购自TaKaRa公司;质粒提取试剂盒购自Omega公司;X-gal、氨苄青霉素、IPTG等均购自Sigma公司。
1.1.3 主要仪器 梯度基因扩增仪购自德国Eppendorf公司;UVP凝胶成像分析系统购自法国VILBER LOURMAT公司;RW-0525G低温水循环仪购自美国西蒙公司。
1.2 方法
1.2.1 PCR引物的设计 从GenBank细菌基因组计划数据库中下载嗜麦芽寡养单胞菌K279a(NC_01094)、JV3(NC_015947)、D457(NC_017671)、R551-3(NC_011071)株的2套T2SS相关基因序列(为表述方便,分别命名为 T2SS1、T2SS2),利用DNASTAR软件对比分析其序列的同源性,使用Primer Priemer 5.0设计引物,引物见表1。
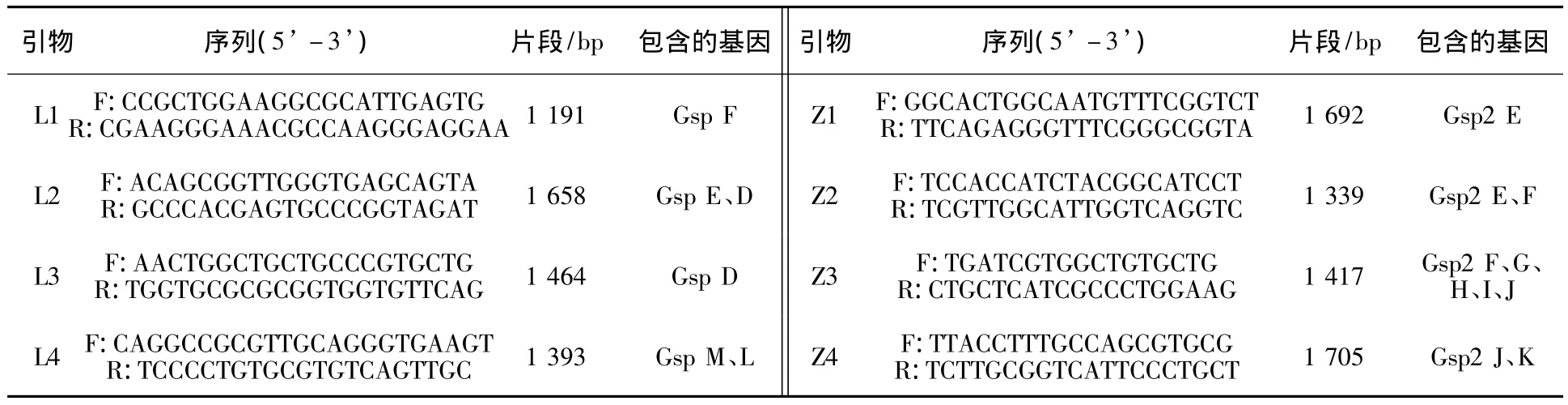
表1 嗜麦芽寡养单胞菌D2株Ⅱ型分泌系统Gsp基因簇扩增引物Table 1 The PCR primers to the Gsp of typeⅡ secretory system in S.maltophilia D2
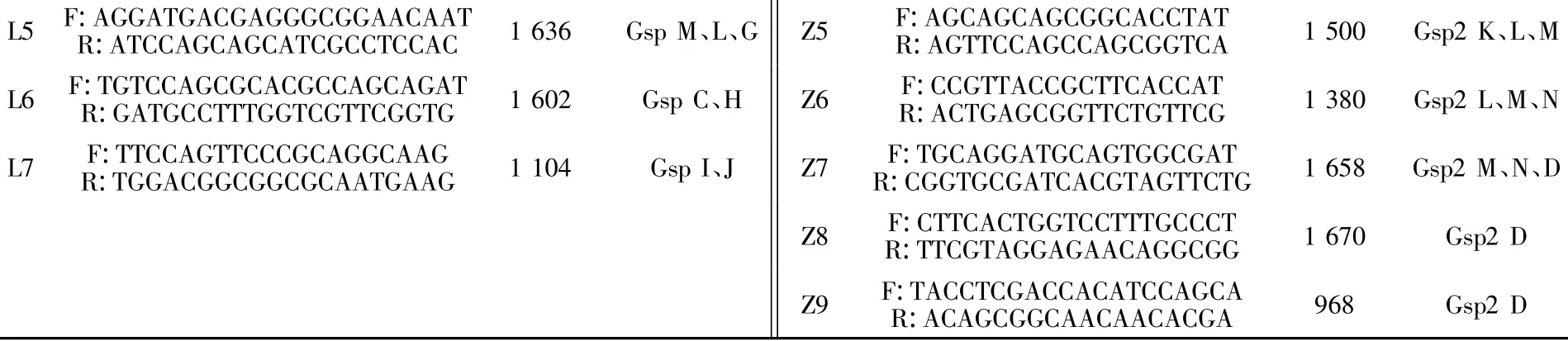
续表
1.2.2 细菌基因组DNA的提取 挑取D2株单个菌落接种LB液体培养基中,25℃震荡培养18 h,使用Promega基因组DNA提取试剂盒参照说明书提取。
1.2.3 PCR 扩增 采用 TaKaRa的 DNASTAR polymerase。50 μL反应体系中DNA模板(10 ng)3 μL,2 × PCR buffer 25 μL,dNTP mix 4 μL,Taq酶 0.5 μL,上下游引物各 1.5 μL。循环体系为95 ℃ 5 min,98 ℃ 10 s,60 ℃ 5 s,72 ℃ 90 s,30个循环之后延伸10 min。
1.2.4 PCR产物序列测定 PCR产物通过琼脂糖凝胶在紫外灯下切取目的片段,用凝胶回收试剂盒纯化。将纯化后的PCR产物在16℃低温循环仪中与pMD18-T Vector连接过夜,其10 μL连接体系为 buffer 5.0 μL,水 1.0 μL,载体 1.0 μL,PCR产物3.0 μL。次日转入用 CaCl2法制备的JM109感受态细胞中,并接种到含有IPTG(200 mg/mL)和 X-Gal(20 mg/mL)、Amp(100 mg/mL)的LB平板上,37℃培养过夜,在平板上挑选白色菌落接种于含有氨苄青霉素LB液体培养基内,37℃震荡培养12~18 h后,按Omega质粒提取试剂盒说明书提取。将所提取的质粒用EcoRⅠ和HindⅢ双酶切鉴定,阳性克隆送上海生工测序。
1.2.5 测序结果拼接及同源性分析 将先后获得的16个基因测序片段采用DNASTAR软件拼接并寻找开放读码框(Open Reading Frame,ORF),将获取的ORF以及ORF编码的氨基酸采用DNASTAR软件对比分析各自同源性。
2 结果与分析
2.1 PCR产物纯化及阳性克隆的酶切鉴定
以嗜麦芽寡养单胞菌D2株的基因组为模板,共获得16个PCR扩增产物,其中T2SS1基因簇扩增产物长度依次为 1191、1658、1464、1393、1636、1602、1104 bp;T2SS2 基因簇扩增产物长度依次为 1692、1339、1417、1705、1500、1380、1658、1670、968 bp,如图 1 所示。
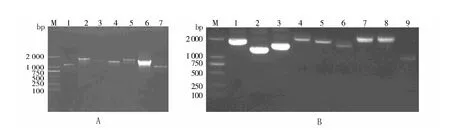
图1 D2株T2SS基因片段的PCR扩增结果Fig.1 PCR products of T2SS
2.2 GSP基因簇序列分析及基因结构草图的绘制
将获得的16个片段先后测序后进行拼接,经DNASTAR等软件进行分析显示,所获得的序列里共包含有22个完整的开放读码框架(ORF),在GenBank中进行Blast比对证实分别为T2SS1或T2SS2的组成基因,并获得GenBank收录号,其中T2SS1的11个ORF分别为GspF(GU377212)、E(HM151387)、D(JQ070336)、M(JQ070343)、L(JQ070342)、K(JQ070341)、G(JQ070335)、J(JQ070338)、L(JQ070339)、H(JQ070340)、C(JQ070337);T2SS2的的11个ORF分别为GspE(KF234409)、F(KF234410)、G(KF234411)、H(KF234412)、I(KF2344113)、J(KF234414)、K(KF234415)、L(KF234416)、M(KF234417)、N(KF234418)、D(KF234419)。采用生物信息学技术分析后发现,T2SS1基因簇中有D2蛋白酶基因和一个未知基因序列的插入;T2SS2串联成簇,共10656 bp,中间无其他基因插入。嗜麦芽寡养单胞菌D2株2套T2SS的基因结构草图如图2所示(图2A、B)。

图2 嗜麦芽寡氧单胞菌D2株T2SS1、T2SS2基因簇结构草图Fig.2 The draft of T2SS1 and T2SS2 gene clusters of S.maltophilia D2
2.3 Gsp基因的同源性比较
将T2SS1和T2SS2的基因簇序列使用wibur-Lipman法,蛋白序列使用Lipman-pearson法做对比,发现2套T2SS的E基因同源性相比其他基因簇的同源性要高,其基因和氨基酸同源性均在50%以上,其他基因簇序列在20% ~50%之间不等。具体对比结果如表2所示。
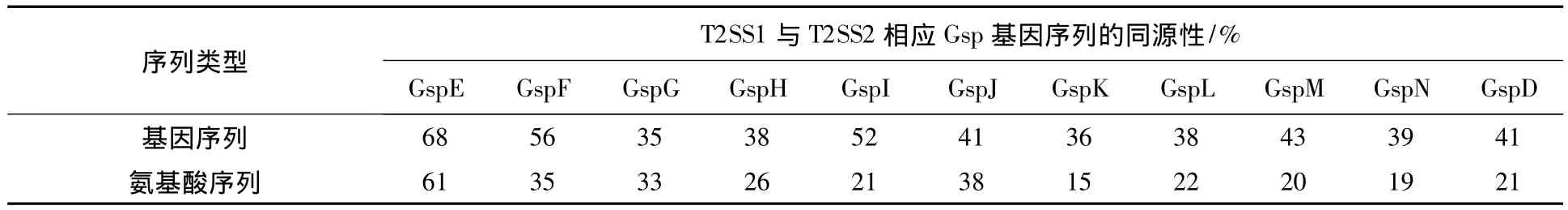
表2 D2株2套T2SS基因簇的相应基因的对比分析Table 2 The Comparison and analysis the corresponding 2 T2SSs gene clusters in D2
将上述22个完整的ORF在Pubmed上运用Blast分析发现,T2SS1的基因簇序列与K279a的对应蛋白基因序列同源性较高,最高为97%,与R551-3的相应蛋白基因序列同源性均能达到80%以上,最高为99%。T2SS2的氨基酸序列与K279a及R551-3同源性均能达到85%以上,具体见表3和表4。
通过上述比较发现,嗜麦芽寡养单胞菌D2株各基因簇序列均与同种属细菌的同种属对应基因簇亲缘关系最近,而与假单胞菌属同种蛋白亲缘关系相对较近,与其他种属同种蛋白的亲缘关系较远。
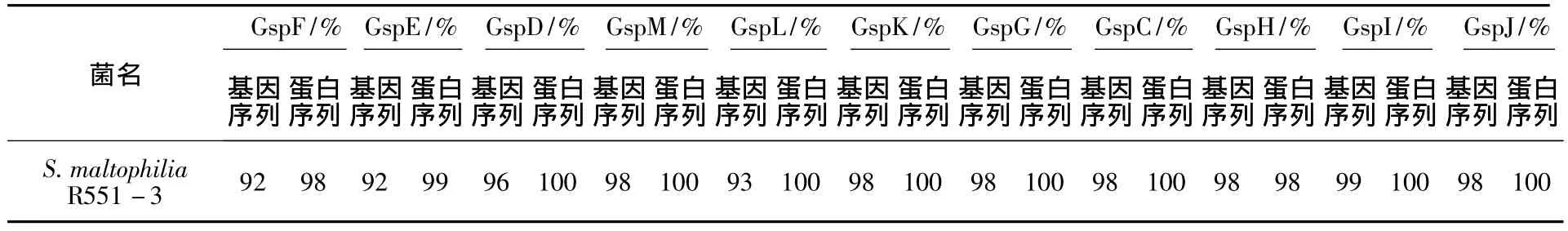
表3 D2株与其他菌株的T2SS1基因簇及其氨基酸同源性分析Table 3 The homology analysis of gene clusters and its amino acid of T2SS1 between D2 strain and other strains
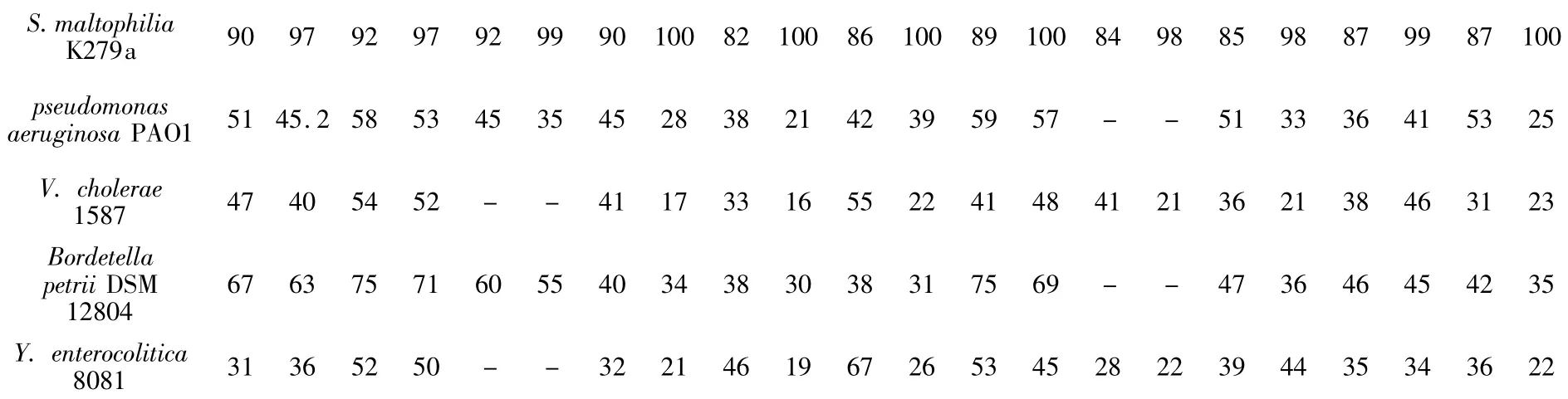
续表
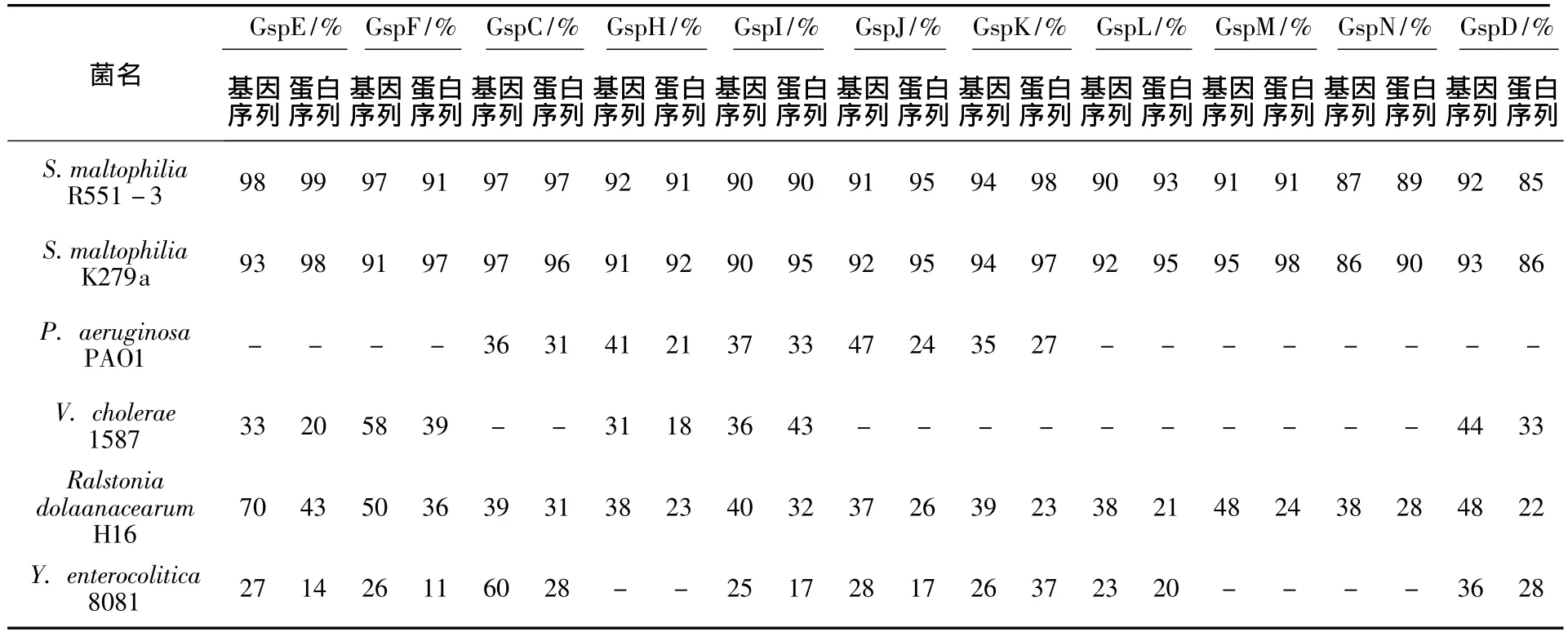
表4 D2株与其他菌株T2SS2基因簇及其氨基酸同源性分析Table 4 The homology analysis of gene clusters and its amino acid of T2SS2 between D2 strain and other strains
3 讨论
本研究室2004年从海洋生物双齿围沙蚕消化道内分离得到1株嗜麦芽寡氧单胞菌D2株,能大量胞外分泌SMP蛋白。前期研究发现SMP蛋白完整编码序列前有一个跨膜的Sec信号肽,且与T2SS的Gsp基因簇串联在一起,据此推测D2株SMP蛋白高效胞外分泌机制可能与T2SS密切相关。在所有蛋白分泌系统中,T2SS与细菌的致病性和耐药性关系密切,该系统是在1993年产酸克雷伯菌分泌支链淀粉酶时被发现,后来发现它是革兰阴性菌的常规分泌途径[6]。以前认为细菌体内只有 1套 T2SS,然而自 2002年Geneviève Ball发现铜绿假单胞菌PAO1株有2套Ⅱ分泌系统[7],随后研究人员相继发现菊欧杆菌、阴沟肠杆菌、恶臭假单胞菌、青枯菌、小肠结肠炎耶尔森菌、产肠毒素大肠埃希菌(ETEC)的某些株中也具有2套Ⅱ型分泌系统[8]。
本研究发现,嗜麦芽寡养单胞菌D2株也存在2套T2SS(分别命名为T2SS1和T2SS2),进一步对测定出的2套T2SS序列运用生物信息学软件对比分析显示,T2SS1和T2SS2各有11个GSP蛋白的开放读码框。通过绘制基因结构草图显示,虽然D2株的2套GSP基因簇的基因种类和数量相同,但是各基因在基因簇中的排列顺序不同;此外,T2SS1的基因簇中插入了SMP基因和一段未知基因的序列,相对于基因簇紧密串联的T2SS2来说是一个显著差别。对比发现2套分泌系统之间有一定的同源性,GspE的基因序列同源性为68%,氨基酸同源性为51%,其次为GspJ的氨基酸同源性为38%,其他基因簇氨基酸同源性为15%~38%,该结果与铜绿假单胞菌XcpT和HxcT的同源性具有一定的相似性[9],提示2套T2SS的功能不完全相同。
T2SS1的基因簇数目一般为12~16个,但是D2株却只有11个基因簇,与野生黄杆菌属Gsp基因簇比较,该菌株缺乏XpsO蛋白(在其他种属中称为GspA)。Ⅱ型分泌系统中,GspA与GspG、GspH、GspI、GspJ及GspK蛋白发挥同样的功能,共同参与菌毛蛋白的组装,有些种属中没有编码GspA的基因[10]。D2株的T2SS2基因簇数目变异较大,与同种属的K279A、R551-3相比,数量上一样,却比铜绿假单胞菌PAO1株多了6个基因,分别是 GspE、F、L、M、N、D,比小肠结肠炎耶尔森多了GspH、M、N却少了GspC。比较分析各基因簇的基因及相应氨基酸序列发现,T2SS的基因簇有明显的种属特异性,D2株各Gsp基因序列与K279a及R551-3 Gsp相应基因序列的同源性均在82%以上,而氨基酸序列同源性均在97%以上,有的甚至完全相同。与T1SS相比,T2SS2的Gsp基因序列和K279a及R551-3的基因序列同源性稍低,基因序列同源性最高为98%,氨基酸序列最低为85%。2套T2SS与铜绿假单胞菌相比其同源性均有所下降,且T2SS2比T2SS1下降更为明显,与不同科的小肠结肠炎耶尔森菌和霍乱弧菌相比其同源性均较低。
本研究获得了嗜麦芽寡养单胞菌T2SS的基因序列,从而为进一步研究该菌的蛋白的分泌机制奠定基础,也为从基因和蛋白水平上在嗜麦芽寡氧单胞菌的生理、功能、致病性、耐药机制、活性物质的开发、生物工程改造和利用等领域的深入研究提供更多参考。
[1]王爽,李东.2005年至2008年嗜麦芽窄食单胞菌的耐药性变迁[J].微生物学杂志,2010,30(3):93-95.
[2]Maria Sandkvist.Biology of type Ⅱ secretion[J].Molecular Microbiology,2010,40(2):271-283.
[3]A.Iwobi,J.Heesemann.Novel Virulence-Associated Type II Secretion System Unique to High-Pathogenicity Yersinia enterocolitic[J].Infection and immunity,2004,71(4):1872-1879.
[4]闫志勇,毕春霞,辛晓妮,等.1株高产蛋白酶嗜麦芽寡养单胞菌的分离鉴定及其酶学活性的研究[J].微生物学杂志,2010,30(5):7-11.
[5]辛晓妮,闫志勇,罗玮,等.嗜麦芽寡养单胞菌D2株Ⅱ型分泌系统F和E基因序列测定[J].青岛大学医学院学报,2011,47(1):1-4.
[6]Pugsley A.P.The complete general secretory pathway in gramnegative bacteria[J].Microbiol Rev,1993,57:50-108.
[7]Geneviève Ball,E'ric Durand,Andrée Lazdunski and Alain Filloux.A novel type II secretion system in Pseudomonas aeruginosa[J].Molecular Microbiology,2002,43(2):475-485.
[8]Nicholas P.Cianciotto,Type II secretion:a protein secretion system for all seasons[J].Trends in Microbiology,2005,13(12):581-588.
[9]Eric Durand,Sebastien Alphonse,Genevieve Ball,et al.The Assembly Mode of the Pseudopilus:A hell mark to distinguish a novel secretion system subtype the journal of biological chemistry[J].The EMBO Journal,2011,27(24):07-16.
[10]Tanya L.Johnson,Jan Abendroth,Wim G.J.Hol,et al.Type Ⅱsecretion:from structure to function[J].FEMS Microbiol Lett,2006,25(5):175-186.
