抗组胺治疗对实验性肝炎大鼠肥大细胞浸润及c-Kit和SCF表达的影响*
2013-10-24赵龙凤郝彦琴赵元昌韩德五
李 红, 赵龙凤, 郝彦琴, 尹 镭, 赵元昌, 韩德五
(山西医科大学 1第一医院感染病科, 2肝病研究所, 山西 太原 030001)
抗组胺治疗对实验性肝炎大鼠肥大细胞浸润及c-Kit和SCF表达的影响*
李 红1△, 赵龙凤1, 郝彦琴1, 尹 镭2, 赵元昌2, 韩德五2
(山西医科大学1第一医院感染病科,2肝病研究所, 山西 太原 030001)
目的研究c-Kit和干细胞因子(SCF)在实验性肝炎大鼠肝脏组织的表达及抗组胺治疗后的变化。方法取Wistar大鼠30只,随机分为3组:正常对照组(NC)、慢性肝炎组(CH)和抗组胺治疗组(AH)。CH组采用复合因素造模(用40%四氯化碳油溶液皮下注射,同时辅以低蛋白、低胆碱、高脂肪、高醇饮食),AH组在CH的基础上给予抗组胺治疗(酮替芬)。4周末处死动物,取血分别检测血浆类胰蛋白酶(TS)和组胺(HA)水平,同时观察肝脏组织学变化及肥大细胞形态改变。应用免疫组织化学方法观察肝脏c-Kit和SCF的表达。用RT-PCR方法观察肝组织c-Kit和SCF mRNA的表达水平。结果(1)与正常对照组比较,慢性肝炎组TS、血和肝组织HA水平均有明显升高(P<0.05),经抗组胺治疗后,TS、血和肝组织HA水平均明显降低(P<0.05)。(2)光镜下,慢性肝炎组有脂肪变性和纤维化形成,而治疗组肝损伤明显减轻;甲苯胺蓝染色可见慢性肝炎组肝脏血管周围及纤维间隔内大量正在脱颗粒和已经脱颗粒的充满紫色颗粒的肥大细胞。治疗组仅见胞浆中充有少量紫色颗粒。定量统计发现,慢性肝炎组肥大细胞数目较正常对照组明显升高(P<0.05),抗组胺治疗后,肥大细胞数目明显减少(P<0.05)。(3)RT-PCR结果显示抗组胺治疗可以下调c-Kit和SCF mRNA表达水平(P<0.05)。免疫组织化学染色显示慢性肝炎组高表达c-Kit和SCF(均P<0.05),抗组胺治疗可以下调二者的表达(P<0.05),而且二者的表达均与HA水平呈明显正相关。结论肥大细胞参与了实验性肝炎的炎症过程。酮替芬可以通过下调肥大细胞膜受体c-Kit及其配体SCF的表达使肥大细胞脱颗粒减少,组胺释放减少,从而减轻肝脏炎症。
肝炎,慢性; 大鼠; 抗组胺药; 肥大细胞; c-Kit蛋白; 干细胞因子
干细胞因子(stem cell factor,SCF)又名肥大细胞生长因子(mast cell growth factor,MGF),是c-Kit配体,是一种新型多功能细胞因子[1]。SCF是一种不依赖IgE介导的成熟肥大细胞的激活因子[2],它与肥大细胞的受体c-Kit结合发挥作用,激活肥大细胞释放多种介质,如组胺、肝素、蛋白激酶、白细胞介素等。局部组织长时间表达SCF可导致肥大细胞大量释放活性介质,从而引起局部微循环机能障碍和组织损伤。那么在肝病是否如此?我们前期研究[3]结果表明:慢性乙型肝炎患者普遍存在的肠源性内毒素血症,通过补体激活肥大细胞使之脱颗粒释放组胺,组胺通过降低Th1细胞因子使慢性乙型肝炎(chronic hepatitis B,CHB)患者细胞免疫功能低下。那么有必要进行抗组胺治疗以观察其疗效,在此我们拟观察肝脏肥大细胞浸润及c-Kit和SCF在肝脏组织的表达,以揭示酮替芬在受体水平上的抗组胺机制。
材 料 和 方 法
1材料
1.1动物 Wistar大鼠 30只,雌雄各半,体重230~290 g,山西医科大学实验动物中心提供。
1.2主要试剂 兔抗c-Kit和SCF多克隆抗体、正常羊血清、SABC免疫组化染色试剂盒和二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒均购自武汉博士德公司;c-Kit和SCF mRNA引物由上海生工合成。
1.3动物处理及分组 肝炎模型的复制依据本室已建立的方法进行[4]。大体方法:除对照组动物以正常饮食外,其余22只动物以单纯玉米面作为饲料(前2周为80%玉米面,20%猪油),并混入0.5%胆固醇。10%乙醇为其唯一饮料。实验组动物按上述条件饲养,每周测定其体重。实验第1天,开始皮下注射40%四氯化碳(carbon tetrachloride,CCl4) 5 mL/kg,以后每3 d皮下注射3 mL/kg CCl4。实验第4周末处死动物。
动物分3组:(1)正常对照组(normal control,NC):8只正常动物,用无热原生理盐水灌胃,剂量同下; (2)慢性肝炎组(chronic hepatitis,CH):11只肝炎动物,用无热原生理盐水灌胃,剂量同下,实验过程中死亡1只,结束时剩10只动物;(3)抗组胺治疗组(antihistamine,AH):9只肝炎动物,同时灌胃:酮替芬1.25 mg/kg体重[5]。
2方法
2.1类胰蛋白酶(tryptase,TS)活力测定方法 采用专性底物(Nα-benzoyl-L-arginine-p-nitroanilide hydrochloride,BAPNA;购自Sigma),在405 nm测吸光度值。
2.2组胺测定
2.2.1血浆组胺测定 微量荧光测定法测定血中组胺含量。
2.2.2肝组织组胺测定 取10%三氯乙酸5 mL置于匀浆器内,再加入500 mg肝组织,用搅拌器将肝组织研成匀浆将匀浆离心15 min(3 000 r/min),取1.6 mL上清液,置低温冰箱待测。荧光法步骤同前。
2.3组织病理学和肥大细胞定量观察 取大鼠肝左叶于10%中性甲醛固定,石蜡包埋,5 μm切片,用于HE及甲苯胺蓝(toluidine blue,TB)染色。后者在每一切片任取10个视野(×200倍),取其平均值,为该例组织的肥大细胞数。
2.4RT-PCR 总RNA的抽提:称取100 mg肝组织,在液氮中将组织研磨成粉末,将粉末转移到离心管中,加1.0 mL Trizol。加入200 μL氯仿/异戊醇(24∶1),剧烈振荡混匀30 s。12 000 r/min室温离心5 min。将上清液小心转移到RNase-free离心管中,加入等体积的异丙醇,室温下放置5 min。12 000 r/min室温离心5 min。小心移去上清液,防止RNA沉淀丢失。用70%乙醇洗涤2次,每次700 μL,12 000 r/min室温离心2 min。尽可能彻底地吸走上清,在室温下使乙醇完全挥发。沉淀用50 μL DEPC-H2O溶解(68 ℃10 min),-20 ℃保存备用。
引物及扩增条件见表1。
用1.5%琼脂糖凝胶,电泳电压122 V,将 10 μL PCR 扩增产物和2 μL溴酚蓝混匀后上样。结果观察:JDS7500紫外凝胶成像系统观察电泳结果。图像分析软件分析其条带相对强度,再除以β-actin 的灰度值为最终结果。
2.5免疫组化 用免疫组织化学 SABC 染色法。以 c-Kit和SCF阳性的肝组织切片作为阳性对照,用 PBS 和正常羊血清代替多克隆抗体作阴性对照。主要步骤:取大鼠左侧肝组织,10%中性甲醛固定 48 h,经脱水、透明、浸蜡、包埋后切片,常规脱蜡至水化,3% H2O2灭活内源性过氧化物酶,热抗原修复,封闭,加Ⅰ抗(c-Kit 为 1∶200,SCF 为1∶150), 4 ℃过夜;加生物素标记羊抗兔抗体;加 SABC 复合物,显色,树胶封片。光学显微镜观察结果判定: 阳性染色为分布于细胞胞浆的棕黄色颗粒,阳性细胞记数方法为随机记录10个中倍(×200)视野阳性细胞数,求其平均值。

表1 引物及扩增条件
3统计学处理
数据以均数±标准差(mean±SD)表示,组间比较采用SPSS统计学软件进行单因素方差分析,进一步两两比较用SNK法,两变量的相关性用Pearson积矩相关分析法,以P<0.05为差异有统计学意义。
结 果
1血和肝组织中组胺浓度的变化
由表2可见,各组动物血浆和肝组织中组胺浓度具有相同的变化趋势,慢性肝炎组明显高于正常对照组,经抗组胺治疗后浓度明显降低(P<0.05)。
2肝脏病理改变
正常组动物肝组织HE染色见图1A。4周末慢性肝炎组HE染色可见肝细胞脂肪变性,有大量炎症
细胞浸润及纤维组织增生,增生的纤维组织沿汇管区呈星状分布,在远端吻合有形成假小叶趋势,但尚未形成假小叶,见图1B。抗组胺治疗组肝细胞脂肪变性,仅有少量纤维组织增生,伴炎症细胞浸润,见图1C。
表2各组大鼠血浆和肝匀浆组胺浓度变化
Table 2. The changes of plasma and liver homogenate HA content(Mean±SD)

GroupnPlasma(μg/L)Liverhomogenate(ng/100mg)NC878.09±38.5551.58±20.45CH10145.14±52.54*#106.59±43.15*#AH779.57±36.0160.71±26.51
NC:normal control;CH:chronic hepatitis;AH:antihistamine.*P<0.05vsNC;#P<0.05vsAH.
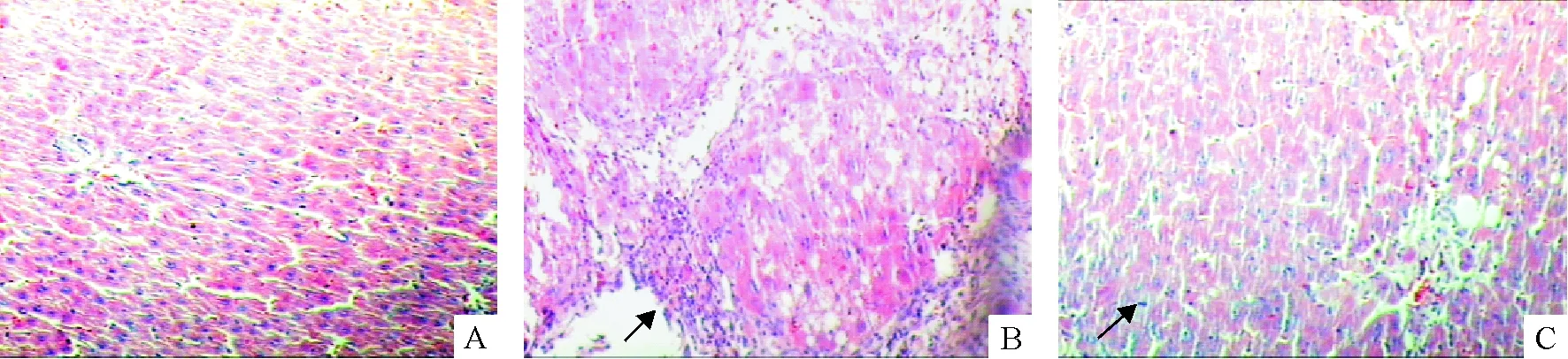
Figure 1. Pathological changes of hepatic tissues in rats (HE staining,×100).A: NC group; B: CH group; C: AH group.
图1大鼠肝组织病理改变
3肥大细胞定量观察结果和TS的变化
正常肝组织中肥大细胞数量极少,部分肝组织汇管区偶见3~5个,见图2A。肥大细胞多分布在血管旁,呈弥散分布。肥大细胞胞浆内可见红紫色颗粒,胞核呈蓝色或无色。慢性肝炎组肝脏血管周围及纤维间隔内可见正在脱颗粒和已经脱颗粒的充满紫色颗粒的肥大细胞,见图2B。治疗组仅见胞浆中有少量紫色颗粒,见图2C。由表3可见,慢性肝炎组肥大细胞数目较正常对照组明显升高,抗组胺治疗后,肥大细胞数目明显减少,但仍较正常对照组增多(P<0.05)。TS水平在治疗组明显低于慢肝组(P<0.05)。

Figure 2. Mast cells in rat liver tissues (toluidine blue staining×200). A: NC group; B: CH group; C: AH group.
图2大鼠肝脏肥大细胞
表3肥大细胞定量观察结果和类胰蛋白酶的变化
Table 3. The results of mast cell quantitative observation and the changes of tryptase level(Mean±SD)

GroupnToluidineblueintensityTryptase(g/L)NC82.167±0.9240.476±0.143CH1010.920±1.575*#0.753±0.210*#AH76.525±1.534*0.551±0.196
*P<0.05vsNC;#P<0.05vsAH.
4肝组织中c-Kit和SCFmRNA表达水平
c-Kit mRNA(图3)与SCF mRNA(图4)的表达有相同的趋势。在NC 肝组织中有少量表达,在CH 组表达上调,抗组胺治疗可以下调二者的表达。
5肝组织c-Kit和SCF蛋白的表达
在正常肝脏门管区有少量c-Kit阳性细胞表达(胞浆着棕色颗粒)(图5A),而在慢性肝炎组(图5B),除了门管区有大量阳性细胞外,胆管细胞也有部分表达,经抗组胺治疗后,表达量明显减少(图5C)。正常肝脏中几乎不表达SCF(图6A),在慢肝组,管腔周围和纤维浸润区有SCF高表达(图6B),治疗后表达明显减少(图6C)。经定量分析,二者有相同的变化趋势,与正常对照组比较,慢肝组的阳性细胞明显增多(P<0.05),抗组胺治疗后,阳性细胞数均明显减少(P<0.05),见表4。
6相关性分析
相关性分析可见,肝匀浆HA分别与c-Kit和SCF的表达呈正相关(r值分别为0.458和0.520,P<0.05)。结果表明,酮替芬通过下调c-Kit和SCF水平起到抗组胺作用。
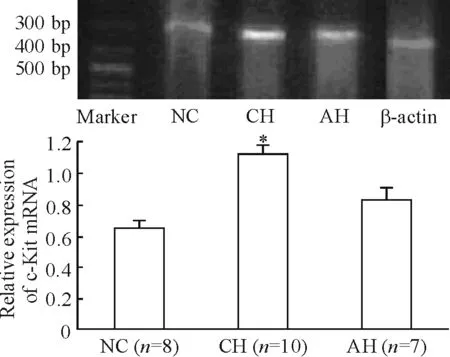
Figure 3. The expression of c-Kit mRNA.Mean±SD.*P<0.05vsNC.
图3c-KitmRNA的表达
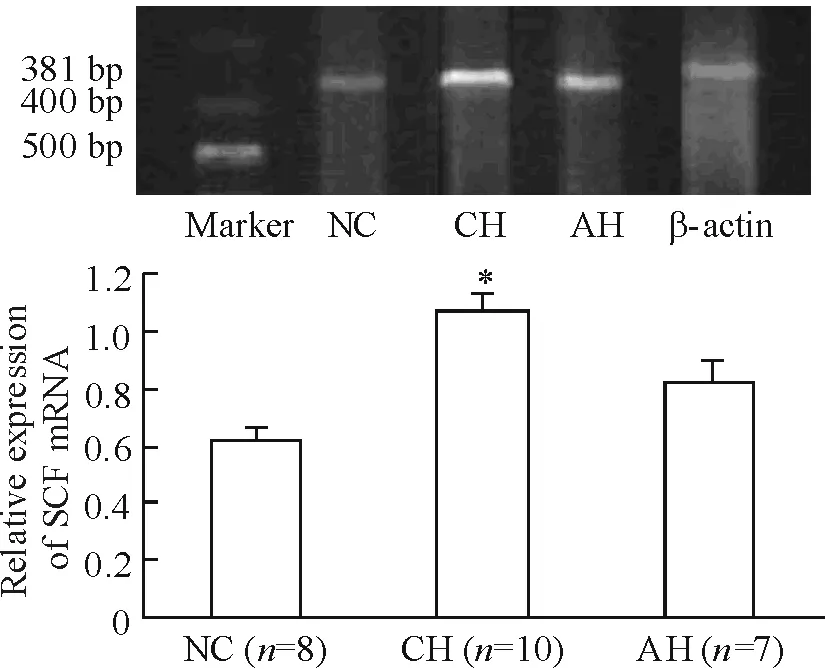
Figure 4. The expression of SCF mRNA.Mean±SD.*P<0.05vsNC.
图4SCFmRNA的表达
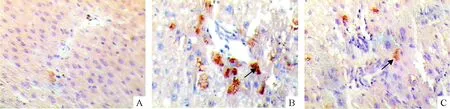
Figure 5. Expression of c-Kit in rat liver tissues (SABC,×200). A:NC group; B:CH group;C:AH group.
图5大鼠肝组织c-Kit蛋白的表达
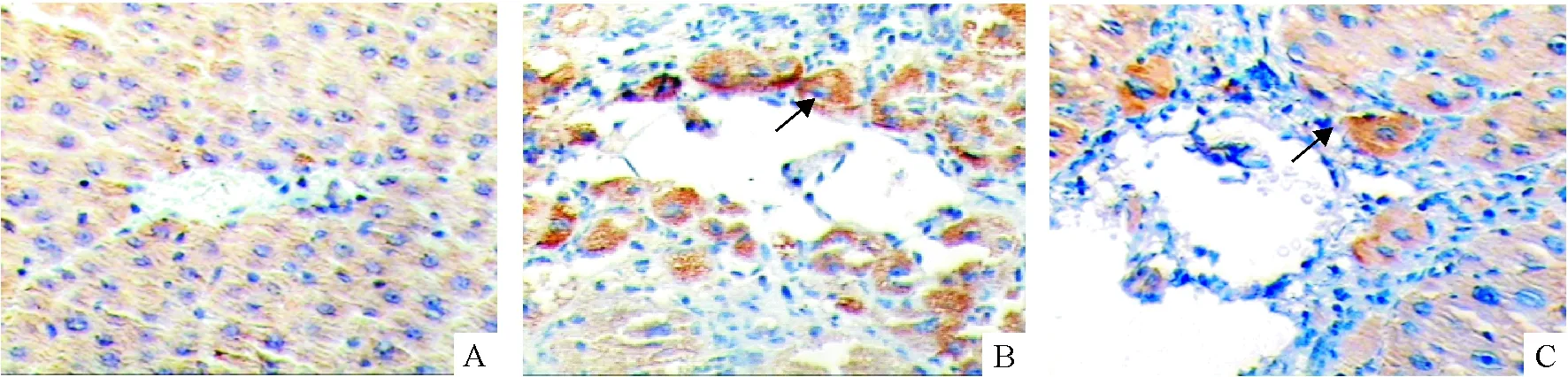
Figure 6. Expression of SCF in rat liver tissues (SABC,×200).A:NC group; B:CH group;C:AH group.
图6大鼠肝组织SCF蛋白的表达

表4 肝组织中 c-Kit和SCF蛋白表达
*P<0.05vsNC;#P<0.05vsAH.
讨 论
本实验结果显示,慢性肝炎组HE染色可见肝细胞脂肪变性,有大量炎症细胞浸润及纤维组织增生,但尚未形成假小叶;TB染色显示肥大细胞数目增加;生化结果显示组胺、类胰蛋白酶水平及肝脏组胺水平明显升高,说明慢性肝炎时肥大细胞释放组胺增多而形成高组胺血症,与Ishii等[6]的研究结果相同。Shen[7]也发现尽管单纯肝炎病毒感染与肝脏中肥大细胞数量无直接关联,但肝脏炎症时肥大细胞及其它免疫细胞聚集可导致肝脏炎症更易朝慢性化发展。因此我们设想抗组胺治疗不失为一种病毒性肝炎的辅助治疗。
在抗组胺药物选择中,我们着重选择能降低组胺水平的药物。酮替芬为一新的抗变态反应药物。其特点是兼具有很强的组胺H受体拮抗作用和肥大细胞膜稳定作用,能阻抑肥大细胞和嗜碱性粒细胞释放组胺、慢反应物质等反应介质,口服有效,作用持续时间较长[8]。故我们选用酮替芬来进行抗组胺治疗。实验证明,抗组胺治疗后,组织学观察发现肥大细胞数目和脱颗粒均减少,血液和肝脏组胺浓度均明显降低,类胰蛋白酶水平降低,再次证明前述关于慢肝时高组胺血症的发生机制假说。抗组胺治疗组肝细胞脂肪变性,仅有少量纤维组织增生,伴炎症细胞浸润,说明抗组胺治疗后肝脏炎症有所改善,纤维化程度减轻。Sanchez-Patan等[9]研究发现门脉高压时肥大细胞数目及脱颗粒增多,预防性使用酮替芬后可以减轻炎症、降低门静脉压力。与我们的结果类似,那么机制如何呢?
肥大细胞是功能活跃的先天和继发免疫的效应细胞[10],分别由MC表面的2种受体,即c-Kit受体(c-Kit原癌基因的产物)和IgE高亲和力的FcεRI激活[11]。其中c-Kit受体对肥大细胞生物功能影响较大。在所有被检测过的器官组织(如肝、肺、心脏、皮肤、子宫、消化道黏膜及肾) 中的肥大细胞表面均有c-Kit 的表达。c-Kit及其配体SCF 相互作用,在MC的成熟、增殖、分化[12-13]和介质释放[14-15]过程中起重要作用,其分子机制可能与早期应答基因激活有关。Koyama等[16]研究发现,酮替芬可以抑制培养的鼻上皮细胞产生SCF。本实验用免疫组化和RT-PCR两种方法分别观察了肝脏c-Kit和SCF的表达水平,结果显示,经抗组胺治疗后,肝组织c-Kit和SCF阳性细胞数目明显减少,相应的mRNA水平降低,并且与肝匀浆组胺水平呈明显正相关,可见酮替芬是通过下调肥大细胞膜表面受体c-Kit及其配体SCF水平来抑制肥大细胞脱颗粒,使得组胺释放减少。
综上所述,肥大细胞参与了实验性肝炎的炎症过程。酮替芬可以通过下调肥大细胞膜受体c-Kit及其配体SCF的表达使肥大细胞脱颗粒减少,组胺释放减少,从而减轻肝脏炎症,阻止肝纤维化发生。
[1] Reber L, Da Silva CA,Frossard N.Stem cell factor and its receptor c-Kit as targets for inflammatory diseases[J]. Eur J Pharmacol, 2006,533(1-3):327-340.
[2] Taylor AM,Galli SJ,Coleman JW.Stem-cell factor,the kit ligand,induces direct degranulation of rat peritoneal mast cellsinvitroandinvivo:dependence of theinvitroeffect on period of culture and comparisons of stem-cell factor with other mast cell-activating agents[J]. Immunology,1995,86(3):427-433.
[3] 李 红,韩德五,张素美,等.乙型肝炎患者肠源性内毒素血症、高组胺血症与细胞免疫功能之间的关系[J].中国病理生理杂志,2006,22(3):559-562.
[4] 韩德五,马学惠,赵元昌.肝硬化动物模型的研究[J].陕西医药杂志,1979,(4):1-6.
[5] Kalia N,Brown NJ,Wood RE, et al.Ketotifen abrogates local and systemic consequences of rat intestinal ischemia-reperfusion injury[J].J Gastroenterol Hepatol, 2005,20(7):1032-1038.
[6] Ishii M, Iwai M, Harada Y, et al.A role of mast cells for hepatic fibrosis in primary sclerosing cholangitis[J]. Hepatol Res, 2005,31(3):127-131.
[7] Shen DZ.A target role for mast cell in the prevention and therapy of hepatic fibrosis[J].Med Hypotheses,2008,70(4): 760-764.
[8] Berger G, Berger R, Goldberg A.Ketotifen induced inhibition of histamine release in a non-IgE model of middle ear effusion[J]. Pediatr Allergy Immunol,2006,17(1):43-48.
[9] Sanchez-Patan F, Anchuelo R, Vara E, et al.Prophylaxis with ketotifen in rats with portal hypertension: involvement of mast cell and eicosanoids[J].Hepatobil Pancreat Dis Int,2008,7(4):383-394.
[10] Tsai M, Grimbaldeston M, Galli SJ.Mast cells and immunoregulation/immunomodulation[J]. Adv Exp Med Biol, 2011,716:186-211.
[11] Cruse G, Kaur D, Leyland M,et al.A novel FcεRIβ-chain truncation regulates human mast cell proliferation and survival[J].FASEB J, 2010,24(10):4047-4057.
[12] Huang B, Lei Z, Zhang GM, et al.SCF-mediated mast cell infiltration and activation exacerbate the inflammation and immunosuppression in tumor microenvironment[J]. Blood,2008,112(4):1269-1279.
[13] Ronnstrand L. Signal transduction via the stem cell factor receptor/c-Kit[J]. Cell Mol Life Sci,2004,61(19-20):2535-2548.
[14] Wang XS, Lau HY. Histamine release from human buffy coat-derived mast cells[J].Int Immunopharmacol,2007,7(4):541-546.
[15] Makowska JS, Cieslak M, Kowalski ML. Stem cell factor and its soluble receptor (c-Kit) in serum of asthmatic patients- correlation with disease severity[J]. BMC Pulm Med,2009,9:27.
[16] Koyama M, Otsuka H, Kusumi T, et al.Stem cell factor production from cultured nasal epithelial cells: effect on SCF production by drugs[J].Nihon Jibiinkoka Gakkai Kaiho,2002,105(2):166-173.
Effectsofantihistaminetreatmentonmastcellinfiltrationandc-KitandSCFexpressioninlivertissuesofratswithexperimentalhepatitis
LI Hong1, ZHAO Long-feng1, HAO Yan-qin1, YIN Lei2, ZHAO Yuan-chang2, HAN De-wu2
(1DepartmentofInfectiousDiseases,FirstHospital,2InstituteofHepaticDiseases,ShanxiMedicalUniversity,Taiyuan030001,China.E-mail:lihong6403@126.com)
AIM: To study the infiltration of mast cells and the expression of c-Kit and stem cell factor (SCF) in liver tissues of rats with experimental hepatitis and their changes after antihistamine (AH) treatment.METHODSThirty Wistar rats were divided into 3 groups at random: normal control (NC) group, chronic hepatitis (CH) group and AH group. The rat model of CH was established by composite factors (subcutaneous injection of carbon tetrachloride, accompanied by a diet containing high cholesterol, high alcohol, low protein and low choline). The rats in AH group were treated with ketotifen based on CH. At the end of the 4th week, blood samples were taken to determine plasma tryptase (TS) and histamine (HA) levels. Liver tissues were taken to detect HA content, observe the histological changes with HE staining and count the number of mast cells with toluidine blue (TB) staining. The mRNA and protein expression of c-Kit and SCF in liver tissues was detected by RT-PCR and immunohistochemistry.RESULTS(1) The plasma TS and HA levels and liver HA content in CH group were significantly increased compared with NC group (P<0.05), while those in AH group were obviously decreased compared with CH group (P<0.05). (2) Fatty degeneration and fibrosis were observed in CH group under light microscope, but the hepatic injury was obviously attenuated in AH group. TB staining showed there were many degranulating and degranulated mast cells filled with purple granules around liver blood vessels and in fiber interval in CH group, and there were few purple granules in the cytoplasm of mast cells in AH group. The number of mast cells in CH group was increased compared with NC group (P<0.05), and that in AH group was reduced compared with CH group (P<0.05). (3) The results of RT-PCR showed that AH down-regulated the expression of c-Kit and SCF mRNA (P<0.05). The expression of c-Kit and SCF proteins in liver tissues increased in CH rats (P<0.05vsNC group), decreased after AH treatment (P<0.05vsCH group) and was positively correlated with liver HA content (P<0.05).CONCLUSIONThese data suggest that an inflammatory pathway mediated by mast cell activation is involved in experimental hepatitis. Ketotifen can reduce mast cell degranulation by down-regulating the expression of mast cell membrane receptor c-Kit and its ligand SCF, thereby attenuating the liver inflammation.
Hepatitis,chronic; Rats; Antihistamines; Mast cells; c-Kit protein; Stem cell factor
R363
A
1000- 4718(2013)09- 1609- 06
2013- 03- 29
2013- 07- 30
山西省高校科技开发项目(No.20091174);山西医科大学细胞生理学省部共建教育部重点实验室主任基金资助项目(No.2010-03)
△通讯作者 Tel: 0351-4639767; E-mail: lihong6403@126.com
10.3969/j.issn.1000- 4718.2013.09.012
