侧壁开窗法上颌窦底提升术植入Bio-Oss后骨生成的mRNA表达谱*
2013-10-24朱双喜陈松龄黄代营
荣 琼, 朱双喜, 陈松龄△, 李 祥, 黄代营, 张 兴
(1中山大学第一附属医院口腔科,广东 广州 510080; 2广东省中医院口腔科,广东 广州 510120)
侧壁开窗法上颌窦底提升术植入Bio-Oss后骨生成的mRNA表达谱*
荣 琼1, 朱双喜1, 陈松龄1△, 李 祥1, 黄代营1, 张 兴2
(1中山大学第一附属医院口腔科,广东 广州 510080;2广东省中医院口腔科,广东 广州 510120)
目的探讨侧壁开窗法上颌窦底提升术这种特殊的引导性骨再生(guided bone regeneration, GBR)过程的转录组特点。方法3只Beagle犬,随机选择一侧经侧壁开窗行上颌窦底提升术,同时植入Bio-Oss骨粉,术后2周,对另一侧用相同的方法行上颌窦底提升术。第2次术后2周,收集植入的Bio-Oss骨粉组织块,提取总RNA,全基因组表达谱芯片检测分析上颌窦底提升后2周和4周时的差异表达基因。利用基因本体论(gene ontology, GO)对差异表达的基因进行功能分类,以及京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)进行信号通路分析。结果在2周时表达升高的基因与刺激反应、免疫-炎症反应和细胞增殖有关,同时,与神经元分化、破骨细胞分化和早期血管化过程相关的基因也高表达。在4周时,与细胞代谢和发育相关的基因表达升高,重要的是,与血管生成和骨骼发育相关的基因都高表达,与骨骼发育相关的基因包括骨生成相关的生长和分化因子[转化生成因子β1(transforming growth factor beta 1, TGFB1)和骨形态发生蛋白4(bone morphogenetic protein 4, BMP4)]、软骨和骨胞外基质[软骨黏附素(chondroadherin, CHAD)、Ⅰ型胶原α1链(collagen type I, alpha 1 chain, COL1A1)、Ⅰ型胶原α2链(collagen type I, alpha 2 chain, COL1A2)、Ⅴ型胶原α2链(collagen type Ⅴ, alpha 2 chain, COL5A2)、核心蛋白聚糖(decorin, DCN)、骨连接蛋白(osteonectin, SPARC)和骨钙素(osteocalcin, BGLAP)]等相关的基因。信号通路分析显示4周时表达升高的基因与转化生长因子β/骨形态发生蛋白(transforming growth factor beta/bone morphogenetic protein, TGF-β/BMP)信号通路有关。无翅型MMTV整合位点家族(wingless-type MMTV integration site family, WNT)信号通路中的关键基因WNT5A和卷曲蛋白受体9(frizzled receptor 9, FZD9)在2周时表达升高,而连环蛋白β1(catenin beta 1, CTNNB1)在4周时表达升高。结论侧壁开窗法上颌窦底提升术2周后转录表达谱变化以免疫-炎症反应和破骨反应下调、骨生成相关基因表达升高为特点,骨再生的过程还与神经生成和血管生成过程相关。在骨再生的过程中,TGF-β/BMP和WNT信号通路起重要作用,WNT信号通路的作用复杂。
上颌窦底提升; 引导骨组织再生; 成骨; 转录组; TGF-β/BMP信号通路
侧壁开窗法上颌窦底提升术(maxillary sinus floor elevation by lateral window approach)可显著增加上颌窦底剩余牙槽骨的高度,为上颌后牙区牙种植创造条件。该手术通过骨移植材料支撑分离的上颌窦底黏膜和下方骨壁产生的空间,颊侧开窗部位由复位的骨块和/或屏障膜覆盖,使骨移植材料位于密闭稳定的空间,保证骨原细胞从下方牙槽骨或上方黏膜中迁移、分化[1-2],在骨移植材料内逐渐成骨,这是引导性骨再生(guided bone regeneration, GBR)的过程[3]。Bio-Oss是由牛骨经脱蛋白等特殊处理后得到的一种碳酸盐磷灰石晶体,在理化性能上与人骨非常相似,具有良好的生物相容性和骨引导能力,在人体内吸收速率慢,已成为最常用的上颌窦底提升骨移植材料[4]。侧壁开窗法上颌窦底提升术后骨再生和重建需3~6个月,才能植入种植体,等待时间太久,因此了解窦底提升后引导骨组织再生的细胞和分子机制,可以为寻找加速骨组织再生的方法提供依据。
已有研究用芯片技术检测长骨骨折[5]和颅骨临界性缺损(critical-size defect, CSD)GBR[6]时的转录表达谱,发现骨愈合的过程非常复杂,涉及多种多样的生物学过程及信号通路,并且骨组织的再生与血管和神经的再生密切相关。但是,长骨骨折的愈合是软骨内成骨,而颅颌面骨生成以膜内成骨为特点,而且,长骨骨折愈合和颅骨临界性缺损GBR都是在新鲜骨创周围成骨,与上颌窦底提升新骨形成明显不同。上颌窦底提升没有骨创面,新骨形成位于皮质骨外侧[1],成骨时间远远长于长骨骨折和颅骨临界性缺损GBR的愈合期限,因此,上颌窦底提升是一种特殊的GBR,研究其成骨的生物学机制有非常重要的意义。
本研究将采用全基因组芯片检测比较犬侧壁开窗法上颌窦底提升后2周和4周时的mRNA表达谱,了解这种特殊的GBR早期成骨的分子学过程,同时,期待发现一些与成骨密切相关的重要基因,为进一步研究在临床上促进上颌窦底提升成骨提供分子生物学基础。
材 料 和 方 法
1动物
健康的1~2周岁Beagle犬,购于高要市康达实验动物科技有限公司,许可证号为SCXK(粤)2009-6679。
2试剂
速眠宁Ⅱ购自吉林省华牧动物保健品有限公司,戊巴比妥钠购自Sigma,Bio-Oss骨粉购自Geistlich,TRIzol购自Invitrogen,RNasey Mini Kit购自Qiagen,Baseline-ZERO DNase购自Epicenter,Quick Amp Labeling Kit、Agilent Gene Expression Hybridization Kit和Gene Expression Wash Buffer购自Agilent。
3方法
3.1侧壁开窗法上颌窦底提升术 速眠宁Ⅱ0.08 mL/kg肌注,待Beagle犬安静入睡后,按戊巴比妥钠25 mg/kg进行腹腔注射。常规消毒铺巾。随机选择一侧上颌沿上颌第3前磨牙近中和第4前磨牙远中做垂直切口达前庭沟,翻开黏骨膜瓣,暴露眶下神经管外侧骨壁,凿开骨质,分离,结扎并切断去除眶下神经血管束。在眶下神经管内侧,即上颌窦颊侧设计大小约20 mm×8 mm的骨窗边界,沿界线凿开骨板形成骨窗,小心剥离上颌窦底黏膜,生理盐水冲洗,提升窦底黏膜约10 mm,植入Bio-Oss骨粉。然后复位上颌窦颊侧骨板,覆盖黏骨膜瓣,缝合。术后单独饲养,予半流饮食、庆大霉素(80 mg/d)肌注3 d,之后常规饲养。术后2周,另一侧同法行上颌窦底提升。
3.2样本准备 第2次手术后2周全麻下放血处死Beagle犬,小心分离新生组织包裹的Bio-Oss骨粉,生理盐水轻轻漂洗后,沿窦底提升方向剪取1/3组织,置于1.5 mL无酶EP管中,加入1 mL TRIzol,液氮中保存。样本遂分为2组,即上颌窦底提升2周组和上颌窦底提升4周组,各组3个样本。
3.3样本总RNA的提取及质检 取约100 mg组织,用BiopulverizerTM生物粉碎机冰冻粉碎组织,加入1 mL的总RNA抽提试剂TRIzol,用Mini-Bead-Bea-ter-16抽提总RNA,按照厂家产品说明书用RNasey Mini Kit纯化总RNA。再用NanoDrop ND-1000检测RNA在260 nm、280 nm和230 nm的吸收值,计算RNA浓度及评估其纯度,变性琼脂糖凝胶电泳检测RNA的纯度及完整性。
3.4RNA标记及芯片杂交 依靠Agilent 服务平台行犬全基因组表达谱分析,芯片版本为Agilent Canine 4×44K Gene Expression Microarrays V2,含43 803个探针。基本检测过程为,1 μg总RNA用Quick Amp Labeling Kit, One-Color逆转录为cDNA,扩增后转录为cRNA,并用Cy3-UTP标记。标记的cRNAs用RNasey Mini Kit纯化后,NanoDrop ND-1000检测cRNA和Cy3浓度,计算Cy3特异性活性,cRNA总量≥1.65 μg且Cy3特异性活性≥9.0 μmol/g的cRNA可进行后续杂交。用Agilent Gene Expression Hybridization Kit将标记好的cRNA断裂,在标准条件下与表达谱芯片杂交,洗脱后,Agilent Microarray Scanner扫描图像。
3.5数据处理及分析 Agilent Feature Extraction 11.0.1.1将扫描图像上各点的荧光强度转化为原始数据,用GeneSpring GX 11.5.1软件包对原始数据行分位数标准化,除去低表达的基因,然后进行统计学分析,筛选出2周和4周比较时改变倍数在3倍以上的差异表达基因,以P<0.05为差异有统计学意义。对有统计学差异的基因采用标准富集计算法进行基因本体论(gene ontology, GO)分析及京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)通路分析。
结 果
与2周时相比,4周时表达降低的基因有514个,参与生物学过程(biological process, BP)的GO条目有363条,参与细胞组分(cellular component, CC)的GO条目有31条,参与分子功能(molecular function, MF)的GO条目有46条;4周时表达升高的基因是1 069个,参与BP的GO条目有657条,参与CC的GO条目有172条,参与MF的GO条目有147条。
12周时上调的GO分类
2周时,新长入Bio-Oss骨粉中的组织高表达的基因(即4周时表达降低的基因)所属的关键GO分类见表1。在BP中,与刺激反应和免疫-炎症反应有关的基因高表达,与细胞增殖和凋亡有关的基因也高表达,同时,可以发现与神经元分化和破骨细胞分化相关的基因高表达,早期血管化过程相关的基因也高表达,G蛋白偶联受体信号通路和丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)级联反应相关基因表达升高。在CC中,与细胞周缘、胞浆膜和胞外区域相关的基因高表达。在MF中,与信号转导活性有关的基因高表达。
与破骨过程相关的基因见表2,上调的基因为连接斑蛋白(junction plakoglobin, JUP)、G蛋白偶联受体55(G-protein-coupled receptor 55, GPR55)、趋化因子C-C模序配体5(chemokine C-C motif ligand 5, CCL5)、 CCL3、肿瘤坏死因子(tumor necrosis factor, TNF)、CD38、黑皮质素4受体(melanocortin 4 receptor, MC4R)和组织蛋白酶S(cathepsin S, CTSS)。
表12周时表达升高基因所属的功能相关的上调GO分类
Table 1. Up-regulated genes whose functionally relevant gene ontology (GO) terms were over-represented (P<0.05) at 2 weeks

GOIDTermCountBiologicalprocessGO:0050896Responsetostimulus268GO:0006950Responsetostress102GO:0009611Responsetowounding40GO:0006952Defenseresponse39GO:0006955Immuneresponse32GO:0002376Immunesystemprocess65GO:0045321Leukocyteactivation26GO:0006954Inflammatoryresponse23GO:0002526Acuteinflammatoryresponse9GO:0050729Positiveregulationofinflammatoryresponse6GO:0008283Cellproliferation58GO:0006915Apoptoticprocess57GO:0000902Cellmorphogenesis43GO:0048812Neuronprojectionmorphogenesis30GO:0048667Cellmorphogenesisinvolvedinneurondifferentiation29GO:0007409Axonogenesis26GO:0021675Nervedevelopment8GO:0003018Vascularprocessincirculatorysystem13GO:0045670Regulationofosteoclastdifferentiation5GO:0045453Boneresorption5GO:0030316Osteoclastdifferentiation5GO:0007186G-protein-coupledreceptorsignalingpathway59GO:0000165MAPKcascade18CellularcomponentGO:0071944Cellperiphery112GO:0005886Plasmamembrane109GO:0005576Extracellularregion63MolecularfunctionGO:0004871Signaltransduceractivity70
24周时上调的GO分类
与2周时相比,4周时新长入Bio-Oss骨粉中的组织高表达基因所属的关键GO分类见表3。在BP中,与细胞代谢(蛋白质、核酸和RNA代谢)过程、生长和发育(细胞、组织、器官和系统)相关的基因表达升高,其中,与血管生成和骨骼发育相关的基因都高表达,同时,与应激反应、细胞周期和凋亡相关的基因也高表达,I-κB激酶/NF-κB级联反应和ER-核信号通路相关基因表达升高。在CC中,胞内组分(包括细胞质、细胞核、线粒体、核糖体、高尔基体等)和细胞外基质相关的基因都高表达。在MF中,与结合(包括蛋白、核酸、RNA、ATP、辅酶、转录因子等)和催化活性(包括水解酶、ATP酶、核糖核酸酶等)相关的基因高表达,重要的是,与生长因子,特别是胰岛素样生长因子和血小板源性生长因子结合基因表达都升高。
4周比2周表达升高的、与成骨过程直接相关的基因见表4。GO分类涉及软骨发育、软骨内骨形态发生、骨小梁形成、骨骼系统发育、调节骨化、骨改建、成骨细胞分化以及胞外结构形成等生物学过程。另外,胰岛素样生长因子和血小板源性生长因子及其结合相关的基因,如胰岛素样生长因子2(insulin-like growth factor 2, IGF2)(4.07倍)、胰岛素样生长因子结合蛋白4(insulin-like growth factor binding protein 4, IGFBP4)(19.90倍)、胰岛素样生长因子2受体(insulin-like growth factor 2 receptor, IGF2R)(8.79倍)、胰岛素样生长因子结合蛋白7(insulin-like growth factor binding protein 7, IGFBP7)(4.31倍)和血小板源性生长因子D(platelet-derived growth factor D, PDGFD)(16.99倍)的表达都显著升高。
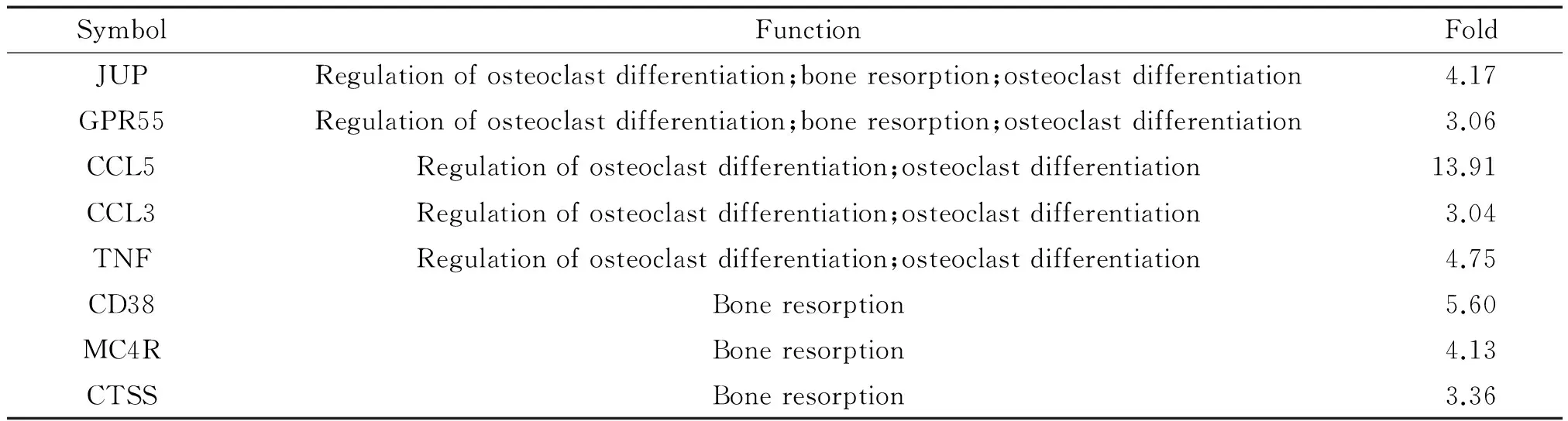
表2 2周时表达升高的与骨吸收过程相关的基因
表34周时表达升高基因所属的功能相关的上调GO分类
Table 3. Up-regulated genes whose functionally relevant gene ontology (GO) terms were over-represented (P<0.05) at 4 weeks
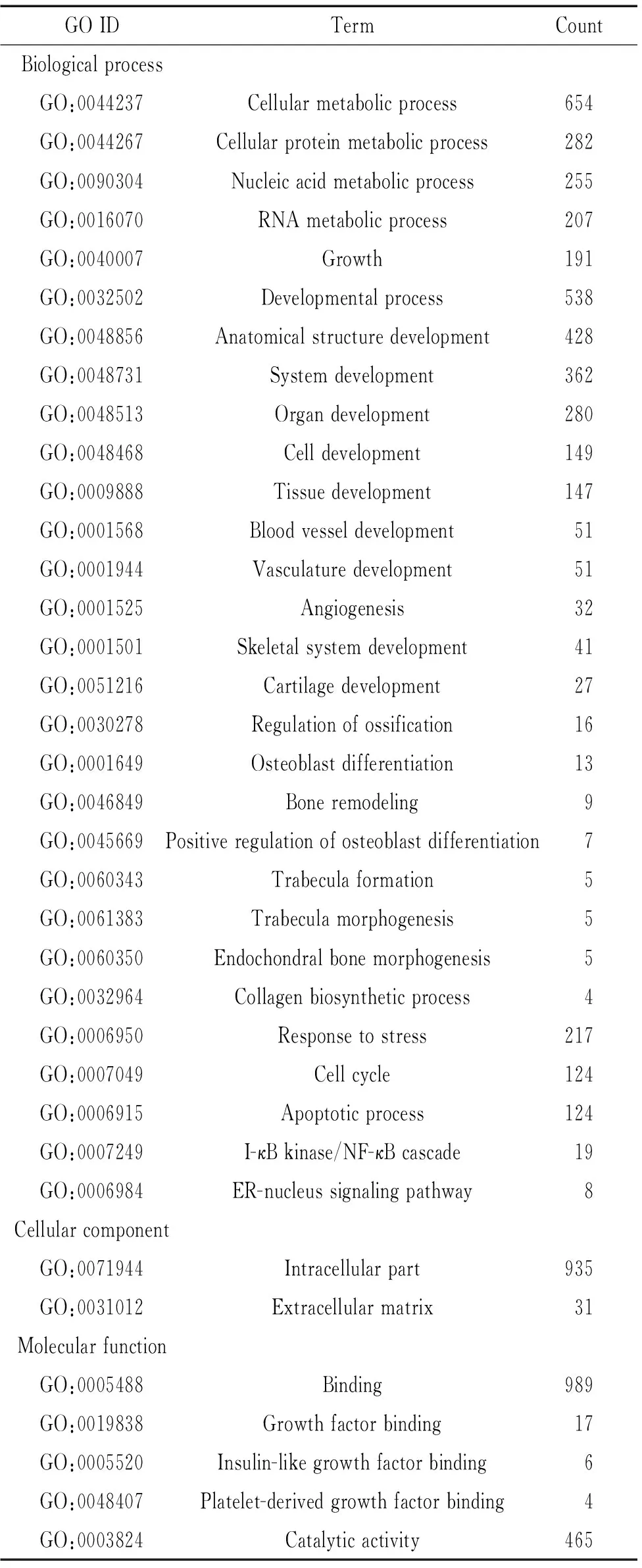
GOIDTermCountBiologicalprocessGO:0044237Cellularmetabolicprocess654GO:0044267Cellularproteinmetabolicprocess282GO:0090304Nucleicacidmetabolicprocess255GO:0016070RNAmetabolicprocess207GO:0040007Growth191GO:0032502Developmentalprocess538GO:0048856Anatomicalstructuredevelopment428GO:0048731Systemdevelopment362GO:0048513Organdevelopment280GO:0048468Celldevelopment149GO:0009888Tissuedevelopment147GO:0001568Bloodvesseldevelopment51GO:0001944Vasculaturedevelopment51GO:0001525Angiogenesis32GO:0001501Skeletalsystemdevelopment41GO:0051216Cartilagedevelopment27GO:0030278Regulationofossification16GO:0001649Osteoblastdifferentiation13GO:0046849Boneremodeling9GO:0045669Positiveregulationofosteoblastdifferentiation7GO:0060343Trabeculaformation5GO:0061383Trabeculamorphogenesis5GO:0060350Endochondralbonemorphogenesis5GO:0032964Collagenbiosyntheticprocess4GO:0006950Responsetostress217GO:0007049Cellcycle124GO:0006915Apoptoticprocess124GO:0007249I-κBkinase/NF-κBcascade19GO:0006984ER-nucleussignalingpathway8CellularcomponentGO:0071944Intracellularpart935GO:0031012Extracellularmatrix31MolecularfunctionGO:0005488Binding989GO:0019838Growthfactorbinding17GO:0005520Insulin-likegrowthfactorbinding6GO:0048407Platelet-derivedgrowthfactorbinding4GO:0003824Catalyticactivity465
3成骨通路分析
对与成骨过程直接密切相关的转化生长因子β(transforming growth factor beta, TGF-β)信号通路分析发现,2周时表达升高的基因有2个在TGF-β信号通路中,是TNF(4.75倍)和蛋白质磷酸酶2调节亚基A α亚型(protein phosphatase 2, regulatory subunit A, alpha isoform, PPP2R1A)(3.04倍)。4周时表达升高的基因有13个出现在TGF-β信号通路中,见表5,在通路表中的标记见图1。
对与成骨过程密切相关的另一信号通路无翅型MMTV整合位点家族(wingless-type MMTV integration site family, WNT)分析发现,2周时表达升高的基因,5个出现在WNT信号通路中,分别是WNT5A(4.44倍)、卷曲蛋白受体9(frizzled receptor 9, FZD9)(4.47倍)、FOS样抗原1(FOS-like antigen 1, FOSL1)(3.08倍)、PPP2R1A(3.04倍)和蛋白激酶C β型(protein kinase C, beta type, PPKCB)(8.33倍)。4周时,14个表达升高的基因包含在WNT信号通路中,见表6,值得注意的是,没有观察到通路起始的关键基因WNT、低密度脂蛋白受体相关蛋白(low-density lipoprotein receptor-related protein, LRP)、FZD等的表达。其中,WNT/β-catenin通路中表达升高的基因是分泌型卷曲相关蛋白4(secreted frizzled-related protein 4, SFRP4)、连环蛋白β1(catenin beta 1, CTNNB1)、酪蛋白激酶2 β多肽(casein kinase 2, beta polypeptide, CSNK2B)、蛋白磷酸酶2催化亚基α亚型(protein phosphatase 2, catalytic subunit, alpha isoform, PPP2CA)、蛋白磷酸酶2催化亚基β亚型(protein phosphatase 2, catalytic subunit, beta isoform, PPP2CB)、酪蛋白激酶1 α1(casein kinase 1, alpha 1, CSNK1A1)、CREB结合蛋白(CREB binding protein, CREBBP)、jun原癌基因(junproto-oncogene, JUN)和v-myc髓细胞组织增生病毒原癌基因同源物(v-mycmyelocytomatosis viral oncogene homolog, MYC);WNT/平面细胞极化(planar cell polarity, PCP)通路中表达升高的基因是磷脂酰肌醇蛋白聚糖4(glypican 4, GPC4)、ras同源基因家族成员A(rashomolog gene family, member A, RHOA)和ras相关C3肉毒素底物1(ras-related C3 botulinum toxin substrate 1, RAC1);WNT/Ca2+通路中则包含蛋白磷酸酶3催化亚基β亚型(protein phosphatase 3, catalytic subunit, beta isoform, PPP3CB)和钙/钙调蛋白依赖性蛋白激酶2δ(calcium/calmodulin-dependent protein kinase II delta, CAMK2D)这2个基因。

表4 4周时表达升高的与骨形成过程相关的基因

ENPP1Ectonucleotidepyrophosphatase/phosphodiesterase1RegulationofossificationBoneremodeling6.25PDLIM5PDZandLIMdomain5Positiveregulationofosteoblastdifferentiation3.35GPNMBGlycoprotein(transmembrane)NMBOsteoblastdifferentiation3.54CTSKCathepsinKBoneremodeling28.96CA2CarbonicanhydraseIIBoneremodeling6.78IL6Interleukin6Boneremodeling4.58CALCRLCalcitoninreceptor-likeBoneremodeling3.74COL1A2CollagentypeI,alpha2chainCartilagedevelopmentExtracellularstructureorganizationResponsetogrowthfactorstimulus11.62COL5A2CollagentypeV,alpha2chainCartilagedevelopmentResponsetogrowthfactorstimulusSkeletalsystemdevelopmentRegulationofossification4.77COL3A1CollagentypeⅢ,alpha1chainCartilagedevelopmentExtracellularstructureorganizationResponsetogrowthfactorstimulusSkeletalsystemdevelopmentRegulationofossification3.81COL1A1CollagentypeI,alpha1chainCartilagedevelopmentExtracellularstructureorganizationTrabeculaformationSkeletalsystemdevelopmentOsteoblastdifferentiationEndochondralbonemorphogenesis3.72COL5A1CollagentypeV,alpha1chainCartilagedevelopmentExtracellularstructureorganizationSkeletalsystemdevelopment3.43
讨 论
本研究采用全基因组芯片研究侧壁开窗法上颌窦底提升术后mRNA表达谱的情况。侧壁开窗法上颌窦底提升术是一种典型的GBR手术[2],复位的颊侧骨壁和/或屏障膜阻挡外部软组织来源的细胞长入提升的密闭的上颌窦底空间,保证新生骨组织缓慢形成。现在,大多数学者都是用临界性骨缺损模型研究GBR的生物学过程[6-8],这种骨缺损模型是新鲜制作的,创面血凝块充足,含有大量的生长因子,如血小板源性生长因子、血管生成素、转化生长因子β、胰岛素样生长因子、血管内皮生长因子、碱性成纤维细胞生长因子等,它们在骨再生的过程中都有促进作用。并且,临界性骨缺损新骨形成是位于缺损区内。这些与侧壁开窗法上颌窦底提升的GBR情况差异较大,侧壁开窗法上颌窦底提升只在侧壁骨窗有少量的新鲜骨创面,后期新骨的形成是位于原皮质骨的外侧。所以,在成骨过程和成骨机制上都会有所差别,全基因组表达谱芯片检测可以全面地了解这种特殊的GBR的成骨机制。
本研究通过比较2周和4周时mRNA的表达谱,筛选差异表达的基因以便了解侧壁开窗法上颌窦底提升早期成骨过程中细胞和分子发生的改变。研究结果显示2周和4周之间是早期成骨的关键过程,这表明实验设计时点的选择是合理的。
2周时,有514个基因表达升高,与之相关的GO条目有440个,主要是与刺激反应、免疫-炎症反应有关的基因高表达。而4周时,有1 069个基因高表达,与之相关的GO条目有657个,主要是与细胞代谢和生长发育相关的基因高表达。显然,4周时的生物学过程更精细复杂,直接影响骨组织的再生。Ivanovski等[6]比较Wistar大鼠颅骨临界性骨缺损GBR术后7 d和14 d的新生组织mRNA转录表达谱发现7 d时表达升高的基因与早期创伤愈合相关,包含免疫-炎症反应,14 d时随之升高的基因与骨再生过程相关。Rundle等[9]研究大鼠腓骨骨折愈合3 d和11 d时的基因表达谱发现3 d时炎症反应的基因高表达,11 d时与骨化有关的基因高表达。本研究结果与Ivanovski等[6]和Rundle等[9]的研究结果呈现了相似的生理学过程,即早期为免疫-炎症反应,之后才有骨组织再生。免疫-炎症反应在骨生成过程中的确切作用并不十分清楚,但是炎症是骨折愈合、骨生成关键的第一步,避免炎症反应时间过长、调节炎症反应可促进骨愈合[10]。

Figure 1. Mapping of gene members of the “TGF-β signaling pathway” up-regulated at 4 weeks. Yellow marked nodes are associated with up-regulated genes, while green nodes have no significance.
图14周时表达升高的基因在“TGF-β信号通路”中的标记

表5 4周时表达升高的属“TGF-β信号通路”的基因
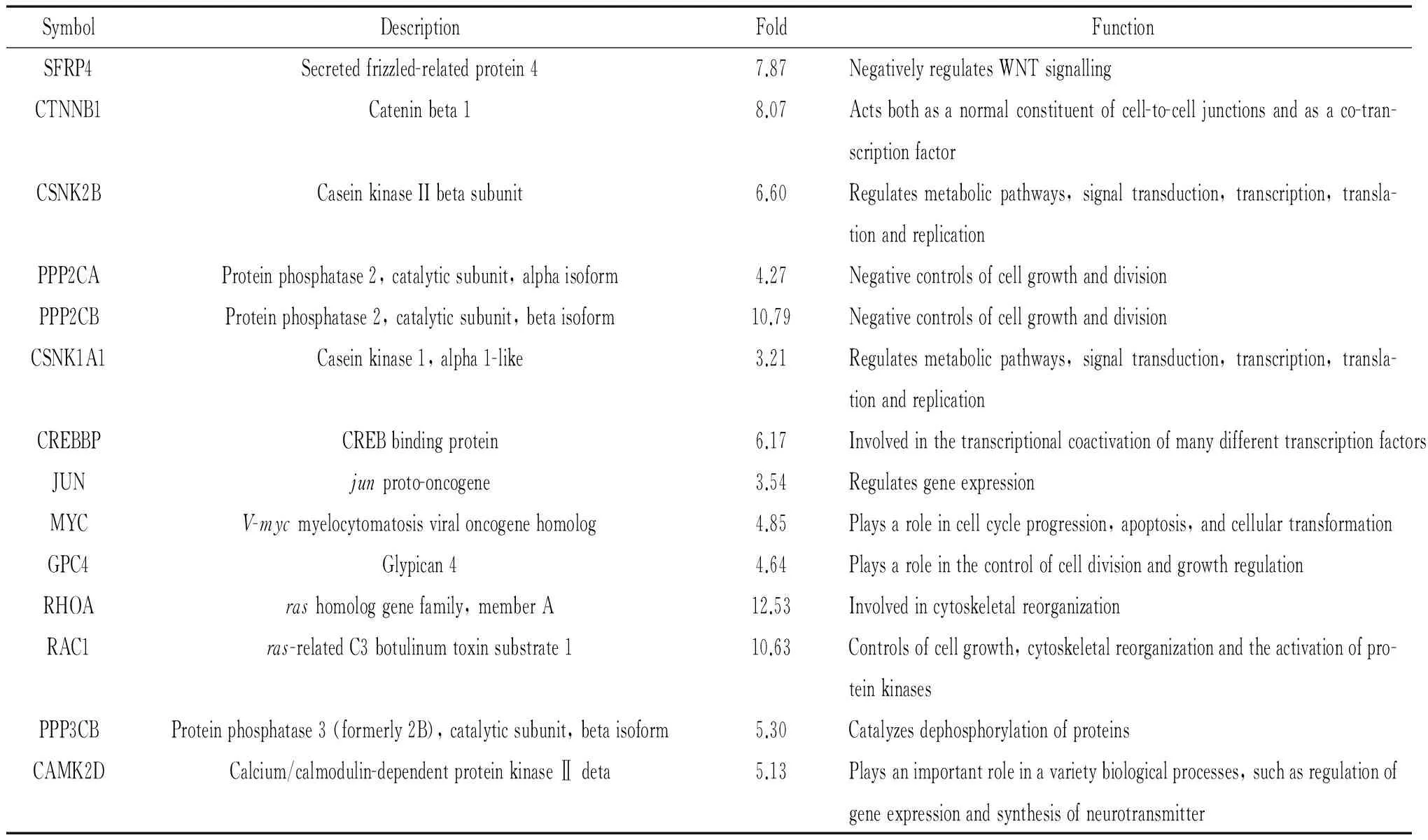
表6 4周时表达升高的属“WNT信号通路”的基因
在本研究中,我们发现2周时,除了与刺激反应、免疫-炎症反应有关的基因表达升高外,与破骨细胞分化、骨吸收相关的基因表达明显升高,而在骨折愈合和临界性骨缺损GBR愈合的早期都未发现与破骨反应相关的基因差异性高表达[6,9]。有学者发现上颌窦底提升Bio-Oss植入后6月以上仍能在Bio-Oss颗粒周围观察到破骨样细胞,与骨吸收相关的蛋白水解酶基质金属蛋白酶(matrix metalloproteina, MMP)2、MMP9和MMP13高表达[11-12]。同时,上颌窦底提升新骨生成过程中,首先需要下方皮质骨吸收,骨髓腔暴露,骨原细胞才可从下方牙槽骨迁移至表面分化成骨[13-14]。本研究结果提示与骨折愈合和临界性骨缺损GBR愈合不同,上颌窦底提升术早期除了刺激反应、免疫-炎症反应外,同时存在明显的破骨反应现象,与破骨细胞分化、骨吸收相关基因的高表达可能跟骨移植材料Bio-Oss植入后吸收和周围骨皮质吸收有关。
2周时,在与破骨细胞分化、骨吸收相关的基因表达升高的同时,与神经元分化相关的基因也高表达。然而,神经元分化在骨再生中的确切作用仍不清楚。近年来,有研究显示破骨前体细胞和成骨前体细胞表达P物质受体NK1,感觉神经元释放神经递质P物质可刺激破骨细胞和成骨细胞的分化,调节局部骨的转化[15]。可以推测,本研究上颌窦底提升术中与神经元分化相关的基因表达升高可能与破骨细胞分化和骨吸收相关,最终促进骨的生成。
成骨相关基因在4周时表达明显升高,GO分类中包括软骨发育、软骨内骨形态发生、骨小梁形成、骨骼系统发育、调节骨化、骨改建、成骨细胞分化以及胞外结构形成等生物学过程,以及胰岛素样生长因子结合、血小板源性生长因子结合等分子功能。与软骨胞外基质[软骨黏附素(chondroadherin, CHAD)]和骨胞外基质[Ⅰ型胶原α1链(collagen type I, alpha 1 chain, COL1A1)、Ⅰ型胶原α2链(collagen type I, alpha 2 chain, COL1A2)、Ⅴ型胶原α2链(collagen type Ⅴ, alpha 2 chain, COL5A2)、核心蛋白聚糖(decorin, DCN)、骨连接蛋白(osteonectin, SPARC)和骨钙素(osteocalcin, BGLAP)]、促进骨生成的生长和分化因子[转化生成因子β1(tranforming growth factor beta 1, TGFB1)和骨形态发生蛋白4(bone morphogenetic protein 4, BMP4)]有关的基因表达在4周时升高,其中CHAD(18.02倍)、TGFB1(17.00倍)、COL1A2(11.62倍)和SPARC(10.81倍)升高显著,表明2周和4周间成骨过程活跃。虽然颅颌面骨生成是以膜内成骨为特点,但经GO分析发现在侧壁开窗法上颌窦底提升Bio-Oss骨粉植入后4周新骨生成有软骨内成骨现象的发生,其明显的依据是上述的软骨特异性胞外基质(CHAD)表达升高了18.02倍。有研究显示,不同的骨移植材料所激活的骨再生信号通路也有所不同,如与成骨样细胞共培养时,生物活性玻璃PerioGlas激活骨形成信号通路,Bio-Oss还可激活软骨形成相关通路[16]。显然,尽管先天性胚胎发育时机体控制各种细胞包括骨细胞分化和生长的很多分子机制,在骨再生时这些机制会重新发生,但是骨再生过程中这些机制也可能受后天某些局部环境的影响,从而与胚胎发育时不同[17]。上颌窦底提升后新骨生成的过程中同时存在软骨内成骨的机制可能与手术方式、骨移植材料等局部环境的影响有关。
血管生成对骨形成至关重要,血管不仅为新骨生成输送氧和营养物质,还是骨改建和修复前体细胞的重要来源[18]。上颌窦底提升2周时便发现与血管化过程相关的13个基因表达升高,4周时,更多(51个)与血管发育相关的基因表达升高。在上颌窦底提升4周时发现缺氧诱导因子1 α亚基(hypoxia inducible factor 1, alpha subunit, HIF1A)表达较2周时升高15.34倍,成骨微环境中低氧可以诱导成骨细胞的成熟[19],在HIFs的刺激下,成熟的成骨细胞可分泌大量的血管内皮生长因子(vascular endothelial growth factor, VEGF),VEGF直接作用于成骨细胞表面受体诱导骨生成,除此之外,VEGF还可作用于内皮细胞诱导血管生成,增加对多能干细胞或成骨前体细胞、成骨生长因子及营养的供应,间接促进骨生成[20]。
TGF-β/BMP和WNT信号级联反应可以刺激骨原细胞增殖和分化,促进骨形成,本研究同时对2周和4周表达升高的基因利用KEGG网站对与成骨过程密切相关的TGF-β和WNT信号通路进行标记。发现在TGF-β信号通路中,2周时TNF和PPP2R1A表达升高,但这2个基因都不是在TGF-β信号通路中特异性表达,明显地,TGF-β信号通路在2周时对新骨形成的作用不突出。相反,4周时,与TGF-β信号通路相关的13个基因表达升高,包括关键的TGFB1、BMP4和Smad家族成员5(Smad family member 5, SMAD5)等,显然,TGF-β/BMP信号通路与4周时骨生成有关。对WNT信号通路分析发现,特异性的WNT5A(4.44倍)和FZD9(4.47倍)在2周时表达升高,而CTNNB1(8.07倍)在4周时表达升高,推测WNT/β-catenin信号通路在2周至4周骨吸收至骨生成阶段的表达可能还有其它通路的介入,使WNT与β-catenin的改变并不同步,但WNT信号通路在窦底提升成骨过程中的作用是肯定的。本实验研究结果表明TGF-β/BMP和WNT信号通路是上颌窦提升成骨过程中的2条主要信号通路,此前Ivanovski等[6]和Rundle等[9]的实验也发现与TGF-β/BMP和WNT信号通路有关的基因在成骨过程中表达升高,说明这2条信号通路在其它部位的成骨反应中同样起到极其重要的作用。
虽然我们利用全基因组表达谱芯片检测技术对侧壁开窗法上颌窦底提升这种特殊的GBR成骨的分子机制有了全面的认识,并发现早期影响成骨的一些关键的基因,但是很难全面了解这一过程不同时间、不同部位的基因表达情况,因为成骨相关基因随时间延续表达一直在改变,2周和4周基因表达的改变不足以代表整个成骨过程,而且,上颌窦底提升后新骨在Bio-Oss内的生长是从周围向中间逐渐进行的,每个部位的成骨过程不一样,基因表达谱的情况也不一样。因此,还需要对更多时点进行检测,对与骨再生关键基因相关的蛋白进行原位杂交和免疫组化检测以定位它们的表达,才能对它们的作用有更深入的认识。
本研究首次认识了侧壁开窗法上颌窦底提升骨生成的转录机制,有助于全面了解这种特殊的GBR的生物学过程和信号转导通路。我们发现炎症反应、骨吸收、神经生成和血管生成都与骨再生密切相关,其确切作用需要更深入的研究。TGF-β/BMP和WNT信号通路在窦底提升成骨中起重要作用,这2条信号通路中的TGFB1、BMP4、SMAD5和CTNNB1与成骨密切相关。已有研究显示,上颌窦底提升后若能通过转染细胞或生物材料携带方式加入某些成骨促进因子后,可促进新骨生成和成熟[21-23]。本研究除了能有助于理解侧壁开窗法上颌窦底提升骨生成的基本细胞和分子机制外,我们推测这些与成骨密切相关的基因还可为促进骨生成提供潜在的调控靶点。
[1] Lundgren S, Andersson S, Gualini F, et al. Bone reformation with sinus membrane elevation: a new surgical technique for maxillary sinus floor augmentation[J]. Clin Implant Dent Relat Res, 2004, 6(3):165-173.
[2] Cricchio G, Palma VC, Faria PE, et al. Histological findings following the use of a space-making device for bone reformation and implant integration in the maxillary sinus of primates[J]. Clin Implant Dent Relat Res, 2009, 11 (Suppl 1):e14-e22.
[3] Buser D, Dula K, Belser U, et al. Localized ridge augmentation using guided bone regeneration. 1. Surgical procedure in the maxilla[J]. Int J Periodontics Restorative Dent, 1993, 13(1):29-45.
[4] Piattelli M, Favero GA, Scarano A, et al. Bone reactions to anorganic bovine bone (Bio-Oss) used in sinus augmentation procedures: a histologic long-term report of 20 cases in humans[J]. Int J Oral Maxillofac Implants, 1999, 14(6):835-840.
[5] Bais M, McLean J, Sebastiani P, et al. Transcriptional analysis of fracture healing and the induction of embryonic stem cell-related genes[J]. PLoS One, 2009, 4 (5):e5393.
[6] Ivanovski S, Hamlet S, Retzepi M, et al. Transcriptional profiling of “guided bone regeneration” in a critical-size calvarial defect[J]. Clin Oral Implants Res, 2011, 22 (4):382-389.
[7] Donos N, Graziani F, Mardas N, et al. The use of human hypertrophic chondrocytes-derived extracellular matrix for the treatment of critical-size calvarial defects[J]. Clin Oral Implants Res, 2011, 22 (12):1346-1353.
[8] Miyahara T, Nyan M, Shimoda A, et al. Exploitation of a novel polysaccharide nanogel cross-linking membrane for guided bone regeneration (GBR)[J]. J Tissue Eng Regen Med, 2012, 6(8):666-672.
[9] Rundle CH, Wang H, Yu H, et al. Microarray analysis of gene expression during the inflammation and endochondral bone formation stages of rat femur fracture repair[J]. Bone, 2006, 38(4):521-529.
[10] Kolar P, Schmidt-Bleek K, Schell H, et al. The early fracture hematoma and its potential role in fracture healing[J]. Tissue Eng Part B Rev, 2010, 16(4):427-434.
[11] Bassil J, Senni K, Changotade S, et al. Expression of MMP-2, 9 and 13 in newly formed bone after sinus augmentation using inorganic bovine bone in human[J]. J Periodontal Res, 2011, 46(6):756-762.
[12] Chackartchi T, Iezzi G, Goldstein M, et al. Sinus floor augmentation using large (1-2 mm) or small (0.25-1 mm) bovine bone mineral particles: a prospective, intra-individual controlled clinical, micro-computerized tomography and histomorphometric study[J]. Clin Oral Implants Res, 2011, 22(5):473-480.
[13] Lundgren AK, Lundgren D, Hämmerle CH, et al. Influence of decortication of the donor bone on guided bone augmentation. An experimental study in the rabbit skull bone[J]. Clin Oral Implants Res, 2000, 11(2):99-106.
[14] Slotte C, Lundgren D. Impact of cortical perforations of contiguous donor bone in a guided bone augmentation procedure: an experimental study in the rabbit skull[J]. Clin Implant Dent Relat Res, 2002, 4(1):1-10.
[15] Wang L, Zhao R, Shi X, et al. Substance P stimulates bone marrow stromal cell osteogenic activity, osteoclast differentiation, and resorption activityinvitro[J]. Bone, 2009, 45(2):309-320.
[16] Annalisa P, Furio P, Ilaria Z, et al. Anorganic bovine bone and a silicate-based synthetic bone activate different microRNAs[J]. J Oral Sci, 2008, 50(3):301-307.
[17] Bahar H, Benayahu D, Yaffe A, et al. Molecular signaling in bone regeneration[J]. Crit Rev Eukaryot Gene Expr, 2007, 17(2):87-101.
[18] Sacchetti B, Funari A, Michienzi S, et al. Self-renewing osteoprogenitors in bone marrow sinusoids can organize a hematopoietic microenvironment[J]. Cell, 2007, 131 (2):324-336.
[19] 刘晓奇, 闫景龙. 低氧影响干细胞成骨分化的研究进展[J]. 中国病理生理杂志, 2011, 27(10):2027-2029.
[20] Mamalis AA, Cochran DL. The therapeutic potential of oxygen tension manipulation via hypoxia inducible factors and mimicking agents in guided bone regeneration. A review[J]. Arch Oral Biol, 2011, 56(12):1466-1475.
[21] Jiang XQ, Sun XJ, Lai HC, et al. Maxillary sinus floor elevation using a tissue-engineered bone complex with β-TCP and BMP-2 gene-modified bMSCs in rabbits[J]. Clin Oral Implants Res, 2009, 20(12):1333-1340.
[22] Gutwald R, Haberstroh J, Stricker A, et al. Influence of rhBMP-2 on bone formation and osseointegration in different implant systems after sinus-floor elevation. Aninvivostudy on sheep[J]. J Craniomaxillofac Surg, 2010, 38 (8):571-579.
[23] Zhang W, Wang X, Wang S, et al. The use of injectable sonication-induced silk hydrogel for VEGF165and BMP-2 delivery for elevation of the maxillary sinus floor[J]. Biomaterials, 2011, 32(35):9415-9424.
TranscriptionalprofilingofboneformationafterBio-Ossimplantationinmaxillarysinusfloorelevationbylateralwindowapproach
RONG Qiong1, ZHU Shuang-xi1, CHEN Song-ling1, LI Xiang1, HUANG Dai-ying1, ZHANG Xing2
(1DepartmentofStomatology,TheFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China;2DepartmentofStomatology,GuangdongProvincialHospitalofTraditionalChineseMedicine,Guangzhou510120,China.E-mail:chensongling1@gmail.com)
AIM: To explore the characteristics of transcriptome associated with the unique guided bone regeneration (GBR) of maxillary sinus floor elevation by the lateral window approach.METHODSOne side of the upper jaw was randomly selected for maxillary sinus floor elevation with Bio-Oss by the lateral window approach in 3 Beagle dogs. The other side of maxillary sinus was elevated by the same approach 2 weeks later. Both Bio-Oss particles and ingrown tissues were harvested 2 weeks after the second operation. Total RNA was extracted and microarray analysis was carried out to identify the differences of the transcriptome at the 2nd and 4th weeks. Functional classification by gene ontology (GO) and signaling pathway analysis by Kyoto Encyclopedia of Genes and Genomes (KEGG) were applied to determine the differentially expressed genes.RESULTSThe genes up-regulated at the 2nd week were associated with stimulus response, immuno-inflammatory response and cell proliferation. Moreover, the genes related to neuron differentiation, osteoclast differentiation and early vascularization process were also up-regulated at this time point. At the 4th week, up-regulated genes were associated with cellular metabolism and development,importantly including angiogenesis and skeletal development. The genes associated with skeletal development were growth and differentiation factors [transforming growth factor beta 1 (TGFB1) and bone morphogenetic protein 4 (BMP4)], extracellular matrix proteins [chondroadherin (CHAD), collagen type I, alpha 1 chain (COL1A1), collagen type I, alpha 2 chain (COL1A2), collagen type Ⅴ, alpha 2 chain (COL5A2), decorin (DCN), osteonectin (SPARC) and osteocalcin (BGLAP)] and so on. Furthermore, it was found that some of the up-regulated genes at the 4th week were associated with the signaling of transforming growth factor beta/bone morphogenetic protein (TGF-β/BMP) shown by KEGG analysis. The upstream genes of wingless-type MMTV integration site family (WNT) signaling, WNT5A and frizzled receptor 9 (FZD9), were up-regulated at the 2nd week, while the important downstream gene catenin beta 1 (CTNNB1) was up-regulated at the 4th week.CONCLUSIONAfter 2 weeks of maxillary sinus floor elevation by the lateral window approach, the transcriptome is characterized by down-regulation of the genes associated with immuno-inflammatory response and bone resorption, and up-regulation of the genes associated with osteogenesis. Neurogenesis and angiogenesis are closely related to bone regeneration. The TGF-β/BMP and WNT signaling pathways play an important role in the bone regeneration process. The effect of WNT signaling is complicated.
Maxillary sinus floor elevation; Guided bone regeneration; Osteogenesis; Transcriptome; TGF-β/BMP signaling pathway
R782.1
A
10.3969/j.issn.1000- 4718.2013.06.025
1000- 4718(2013)06- 1102- 12
2013- 01- 24
2013- 03- 27
广东省科技厅基金资助项目(No. 2009B050700025;No. 2010B060900070;No. 2011B010200008);广东省自然科学基金博士科研启动基金资助项目(No. S201140002559)
△通讯作者 Tel: 020-87332200-8721; E-mail: chensongling1@gmail.com
