沉默Notch1基因促进人乳腺癌MCF-7细胞JNK1和p53磷酸化*
2013-10-24陈旭东范文娟杨旭光王建国
袁 磊, 陈旭东, 范文娟, 杨旭光, 王建国
(漯河医学高等专科学校,河南 漯河 462002)
沉默Notch1基因促进人乳腺癌MCF-7细胞JNK1和p53磷酸化*
袁 磊, 陈旭东, 范文娟, 杨旭光, 王建国△
(漯河医学高等专科学校,河南 漯河 462002)
目的探究沉默Notch1基因对人乳腺癌MCF-7细胞JNK1和p53磷酸化的影响。方法选取人乳腺癌MCF-7细胞作为研究对象,构建shRNA-Notch1真核表达质粒用于转染MCF-7细胞使Notch1基因沉默。采用Western blotting方法检测MCF-7细胞Notch1、Hes-1、PUMA和NOXA蛋白的表达,JNK1和p53蛋白磷酸化水平以及caspase-3活化水平的改变。应用流式细胞术检测细胞凋亡和线粒体膜电位的变化。结果人乳腺癌MCF-7细胞Notch1基因被沉默后,Notch1和Hes-1蛋白表达量明显减少(P<0.01),细胞凋亡率显著升高(P<0.01),JNK1和p53的磷酸化水平明显高于对照组(P<0.01),PUMA和NOXA表达量显著升高(P<0.05),cleaved caspase-3蛋白明显多于对照组(P<0.01),线粒体膜电位明显下降(P<0.05)。结论沉默Notch1基因可能通过激活JNK1信号通路活化p53,促进PUMA和NOXA蛋白表达,进而通过线粒体途径导致人乳腺癌MCF-7细胞凋亡。
Notch1蛋白; 短发夹RNA; JNK1蛋白; p53蛋白; MCF-7细胞
近年来,在果蝇发育的研究中,发现了一条在细胞间传导相互作用的信号途径,称为Notch信号途径。随后证实该信号途径广泛存在于无脊椎动物和脊椎动物体内,并且在进化过程中高度保守。Notch信号途径的激活始于Notch受体胞外区与相邻细胞表面的Notch配体胞外区的结合。脊椎动物Notch配体分为Delta和Jagged 2个家族,人的Notch配体有Delta-1、-3、-4和Jagged-1、-2,人的Notch受体家族有4个成员(Notch1~4)。Notch信号途径不仅影响着胚胎发育、血管发生、程序性细胞死亡和细胞增殖等多种生理过程[1-5],在肿瘤的侵袭、转移、凋亡、增殖和血管生成等病理过程中也发挥着关键作用[6-7]。本研究通过构建shRNA-Notch1真核表达质粒以探究沉默Notch1基因对人乳腺癌MCF-7细胞凋亡的影响及其分子机制。
材 料 和 方 法
1材料
MCF-7细胞购自中国科学院细胞库,大肠杆菌菌株DH5α由本校分子医学实验中心提供。胎牛血清和RPMI-1640培养基购自Gibco;pRS质粒载体购自Origene;质粒提取试剂盒、琼脂糖凝胶DNA回收试剂盒购自北京天根公司;限制性核酸内切酶BamH I、Hind III、XhoI和T4 DNA连接酶购自TaKaRa;脂质体Lipofectamine 2000和Annexin V/PI检测凋亡试剂盒购自Invitrogen; Notch1、Hes-1、p-JNK(Thr183/Tyr185)、p-p53(Ser15)、PUMA(p53-upregulated modulator of apoptosis)、NOXA、cleaved caspase-3和β-actin抗体购自Santa Cruz;Rhodamine123购自Sigma;Notch1特异性DNA干扰序列由大连宝生物公司合成。
2方法
2.1设计shRNA靶序列 利用NCBI数据库检索人Notch1 mRNA序列(GenBank Accession:NM_017617),根据shRNA设计原则,使用Invitrogen公司在线设计软件针对Notch1编码区(2 015~2 035)设计特异性靶序列,另设计一条由Notch1特异性靶序列随机重排而成的序列作为阴性对照,经BLAST比对分析与人类基因编码序列无同源性。shRNA设计模板采用BamH I+Sense+Loop+Antisense+终止序列+XhoI+HindIII(其中Loop: 5’-TTCAAGAGA-3’, 终止序列: TTTTTT),具体序列见表1,下划线部分为靶序列,由大连宝生物公司合成。

表1 shRNA干扰序列
2.2构建pRS-shRNA表达质粒 将pRS空质粒于37 ℃用限制性核酸内切酶BamH I和HindIII酶切过夜,经1%琼脂糖凝胶电泳后,采用琼脂糖凝胶DNA回收试剂盒回收。将合成的shRNA模板单链进行退火处理形成双链,然后与双酶切后的线性化载体于16 ℃连接过夜。将连接产物转化大肠杆菌DH5α感受态细胞,涂布于含ampicillin抗性的LB平板上,37 ℃培养过夜,挑取单克隆菌落,置于含有ampicillin抗性的LB培养基中,37 ℃、200 r/min过夜。收集菌液,采用质粒提取试剂盒提取质粒。
2.3重组质粒的鉴定 提取的质粒用XhoI做酶切鉴定。空质粒pRS的DNA序列中不存在XhoI的酶切位点,而在插入的shRNA片段中,我们加入了1个XhoI的酶切位点。若重组质粒构建成功,就能被XhoI酶切。对酶切鉴定正确的质粒送大连宝生物公司测序。鉴定正确的质粒分别命名为pRS-Notch1和pRS-non。
2.4细胞培养和转染 用含10%胎牛血清的RPMI-1640培养基,于37 ℃、5% CO2培养箱中培养MCF-7细胞,每隔48 h更换1次细胞培养液。当细胞汇合度达80%以上时换为不含胎牛血清的RPMI-1640培养基培养过夜。将重组质粒pRS-Notch1和pRS-non分别转染MCF-7细胞,转染方法参照Lipofectamine 2000操作说明书进行,置于37 ℃、5% CO2培养箱中培养6 h后用PBS洗去转染试剂,加入新鲜的培养基继续培养24 h。MCF-7细胞转染分组:(1)shControl组:转染重组质粒pRS-non;(2)shNotch1组:转染重组质粒pRS-Notch1。
2.5流式细胞术检测细胞凋亡 制备各实验组细胞悬液,用PBS洗涤细胞2次,加入结合缓冲液悬浮细胞,加入Annexin V-FITC轻轻混匀后于4 ℃避光孵育10 min。800 r/min离心5 min,弃上清,重悬细胞于结合缓冲液中,加入PI染色液轻轻混匀后于4 ℃避光孵育5 min,送流式细胞仪检测。
2.6Western blotting检测蛋白水平 裂解各组细胞提取总蛋白,用BCA法定量后,进行SDS-PAGE电泳并转移至PVDF膜。封闭液(5%BSA/TBST)封闭1 h,加入Ⅰ抗(1∶1 000稀释),4 ℃孵育过夜,TBST洗膜3次,加入Ⅱ抗(1∶1 000稀释)室温下孵育1 h,TBST洗膜3次,加入ECL进行发光反应,压片、显影、定影,观察蛋白印记,运用ImageJ软件测定各蛋白条带灰度值。
2.7流式细胞术检测线粒体膜电位 罗丹明123(rhodamine 123, Rh123)是一种可以通过细胞膜的选择性染色活细胞线粒体的荧光染料,细胞内Rh123的平均荧光强度(mean fluorescence intensity, MFI)与线粒体跨膜电位呈正相关。制备各实验组细胞悬液,用PBS洗涤细胞2次,重悬细胞于培养基中,加入Rh123(终浓度为5 mg/L),37 ℃孵育箱中放置30 min,再用细胞培养基洗涤细胞2次,送流式细胞仪检测。
3统计学处理
用SPSS 16.0统计软件进行分析。数据用均数±标准差(mean±SD)表示,两组间均数比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1pRS-shRNA重组质粒的鉴定
将重组质粒和空质粒分别用XhoI进行单酶切鉴定。空质粒pRS因其序列中无XhoI的酶切位点而不能被XhoI酶切;但在重组质粒pRS-Notch1和pRS-non的序列中插入了XhoI的酶切位点,可被XhoI酶切,酶切产生的线状DNA因空间位阻较环状质粒大导致电泳速度慢于环状质粒。对酶切鉴定正确的质粒测序, 经过比对,2个重组质粒中含有目的shRNA片段,表明重组质粒构建成功,见图1。
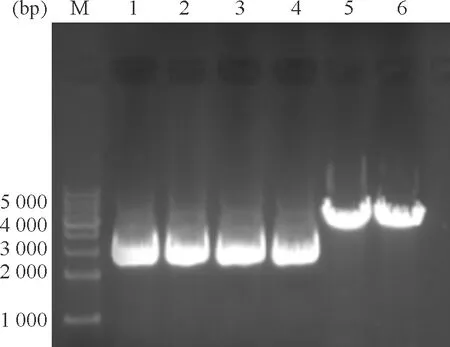
Figure 1. Single restriction endonuclease digestion of pRS-Notch1 and pRS-non. M: 1 kb DNA marker; 1~3: pRS, pRS-Notch1 and pRS-non without digestion,respectively; 4~6: pRS, pRS-Notch1 and pRS-non digested byXhoI,respectively.
图1重组质粒pRS-Notch1和pRS-non的单酶切鉴定
2shRNA干扰对Notch1和Hes-1蛋白表达的影响
Western blotting结果显示,shNotch1组Notch1/β-actin灰度比显著低于shControl组(P<0.01)。Hes-1基因是Notch1的主要下游基因之一,当shNotch1组Notch1蛋白表达被抑制后,该组Hes-1蛋白表达较shControl组明显下降(P<0.01),这表明Notch1信号途径受到明显抑制,见图2。

Figure 2. Expression of Notch1 and Hes-1 proteins in human breast cancer MCF-7 cells after pRS-non/pRS-Notch1 transfection. Mean±SD.n=3.**P<0.01vsshControl group.
图2pRS-non/pRS-Notch1转染MCF-7细胞后Notch1和Hes-1蛋白的表达
3沉默Notch1基因对细胞凋亡的影响
流式细胞术结果显示,shNotch1组MCF-7细胞凋亡率为23.8%±1.7%,较shControl组(2.1%±0.5%)显著升高(P<0.01),见图3。
4沉默Notch1基因对JNK1和p53磷酸化的影响
shNotch1组p-JNK1/β-actin和p-p53/β-actin的灰度比分别为1.050 3±0.071 2和0.830 2±0.063 5,均显著高于shControl组(P<0.05),见图4。
5沉默Notch1基因对PUMA、NOXA和cleavedcaspase-3蛋白表达的影响
shNotch1组PUMA/β-actin、NOXA/β-actin和cleaved caspase-3/β-actin的灰度比分别为0.827 1±0.070 8、1.737 6±0.096 3和1.234 1±0.078 2,均显著高于shControl组,(P<0.05),见图5。

Figure 3. Effect ofNotch1 silencing on apoptosis of MCF-7 cells detected by flow cytometry. Mean±SD.n=3.**P<0.01vsshControl group.
图3流式细胞术检测沉默Notch1对MCF-7细胞凋亡的影响

Figure 4. Effect ofNotch1 silencing on phosphorylations of JNK1 and p53 in MCF-7 cells. Mean±SD.n=3.**P<0.01vsshControl group.
图4沉默Notch1对MCF-7细胞JNK1和p53磷酸化的影响

Figure 5. Effect ofNotch1 silencing on the protein levels of PUMA,NOXA and cleaved caspase-3 in MCF-7 cells. Mean±SD.n=3.*P<0.05,**P<0.01vsshControl group.
图5沉默Notch1对MCF-7细胞PUMA、NOXA和cleavedcaspase-3蛋白水平的影响
6沉默Notch1基因对线粒体膜电位的影响
流式细胞术结果显示,shControl组的FI为5 576±410,以此为对照,沉默Notch1基因后MCF-7细胞的FI降为4 332±338 (P<0.05),表明抑制Notch1蛋白表达可引起MCF-7细胞线粒体膜电位下降,见图6。

Figure 6. Effect ofNotch1 silencing on mitochondrial membrane potential of MCF-7 cells detected by flow cytometry. Mean±SD.n=3.*P<0.05vsshControl group.
图6流式细胞术检测沉默Notch1基因对MCF-7细胞线粒体膜电位的影响
讨 论
Notch1单链前体(300 kD)首先在内质网合成,运输至高尔基体后被Furin 样转化酶切割成含胞外区的N端片段(180 kD)与含跨膜区和胞内区的C端片段(120 kD),两者通过非共价键结合为异源二聚体后被转运到细胞膜。当Notch与相邻细胞表面的配体结合后,Notch1相继发生2次蛋白水解。先由ADAM10/Kuz或ADAM17/TACE酶切其C端片段的胞外部分产生Notch1胞外截短体(Notch extracellular truncation, NEXT),再由γ-促分泌酶复合体酶切NEXT释放Notch1胞内段 (Notch intracellular domain,NICD),NICD进入细胞核与CSL [CBF1/Su(H)/LAG1]结合[8]。CSL蛋白是一种转录抑制因子,在哺乳动物中又被称为C-启动子结合因子1 (C-promoter binding factor 1, CBF1)或转录因子重组信号结合蛋白 Jκ (recombination signal binding protein-Jκ, RBP-Jκ)。没有NICD存在时,CSL与Notch1靶基因启动子结合并抑制其转录,当NICD与CSL结合并募集Mastermind组成转录激活复合体后,CSL由转录抑制因子转变为转录激活因子,激活Notch1靶基因的转录,如Hes-1、Hey-1、CDK8和CCND1等[9]。
本研究针对Notch1的开放读码框设计了特异性的shRNA干扰序列,以此构建的重组质粒pRS-Notch1在转染人乳腺癌MCF-7细胞后有效抑制了Notch1基因的表达。为进一步明确Notch1信号通路是否被有效抑制,我们检测了Notch1信号通路的特异性靶基因Hes-1的表达水平,结果显示,随着Notch1蛋白表达的抑制,Hes-1蛋白的表达显著降低,这表明重组质粒pRS-Notch1能够有效沉默Notch1基因和抑制Notch1信号通路。
抑制Notch1信号通路可促进多种细胞发生凋亡,然而在不同的细胞环境中,分子机制不尽相同。运用γ-分泌酶抑制剂(γ-secretase inhibitor,GSI)阻断Notch信号通路可下调骨髓瘤细胞Akt、Bcl-2和Bcl-xL蛋白的表达[10];通过siRNA沉默前列腺癌细胞Notch1基因可抑制Akt和转录因子FoxM1的表达[11],下调Bcl-2蛋白和上调Bax蛋白的表达[12]。在转移性前列腺癌细胞中通过下调Notch1或Jagged1蛋白的表达抑制Notch1信号通路后,Akt和mTOR蛋白的表达均受到抑制,同时NF-κB信号通路及其下游蛋白MMP-9、VEGF和uPA的表达也均受到抑制[7]。
本研究发现,沉默乳腺癌MCF-7细胞Notch1基因可促进JNK1和p53的磷酸化。这可能是由于Notch1信号通路活化产生的NICD可与JNK1竞争结合JNK相互作用蛋白1(JNK-interacting protein 1, JIP1),从而干扰了JIP1-JNK1信号通路的活化[13],沉默Notch1基因后,解除了NICD对JIP1-JNK1信号通路的抑制,促进了JNK1的磷酸化。JNK1激活后可磷酸化p53使之活性增强[14]。在人肝癌HepG2细胞中,DNA损伤可引起p53蛋白磷酸化(Ser15), PUMA、NOXA、Bax和Bcl-2蛋白表达增多,继而促使细胞色素C和Smac/DIABLO蛋白从线粒体膜间腔释放至胞浆,激活caspase-9和caspase-3导致细胞凋亡[15]。
BH3-only蛋白PUMA和NOXA为p53的下游蛋白,可与Bcl-2蛋白家族中抗凋亡蛋白结合,促进Bax的活化,活化的Bax可插入线粒体外膜并寡聚成孔道,也可与线粒体外膜中的电压依赖性阴离子通道 (voltage-dependent anion channel, VDAC)结合引起线粒体通透性转变孔 (mitochondrial permeability transition pore, MPTP)的持续开放,进而引起线粒体外膜通透化 (mitochondrial outer membrane permeabilization, MOMP)和线粒体膜电位消散,释放线粒体膜间腔中的促凋亡蛋白,激活半胱天冬酶(caspase),最终导致细胞凋亡[16-17]。本研究发现,在沉默乳腺癌MCF-7细胞Notch1基因后,随着p53蛋白磷酸化水平的升高,PUMA和NOXA蛋白的表达明显增强,进而导致线粒体膜电位降低和caspase-3活化。
[1] Fernandez-Valdivia R, Takeuchi H, Samarghandi A,et al. Regulation of mammalian Notch signaling and embryonic development by the proteinO-glucosyltransferase Rumi[J]. Development, 2011, 138(10):1925-1934.
[2] Gianni-Barrera R, Trani M, Reginato S,et al. To sprout or to split? VEGF, Notch and vascular morphogenesis[J]. Biochem Soc Trans, 2011, 39(6):1644-1648.
[3] Yalcin-Ozuysal Ö, Fiche M, Guitierrez M,et al. Antagonistic roles of Notch and p63 in controlling mammary epithelial cell fates[J]. Cell Death Differ, 2010, 17(10):1600-1612.
[4] Monahan P, Rybak S, Raetzman LT. The Notch target geneHes1 regulates cell cycle inhibitor expression in the developing pituitary[J]. Endocrinology, 2009, 150(9):4386-4394.
[5] 郭 亚, 赵能江, 林 玲,等.Notch1基因对人胶质瘤U251细胞增殖和周期的影响[J].中国病理生理杂志, 2010, 26(6):1115-1119.
[6] Garcia A, Kandel JJ. Notch: a key regulator of tumor angiogenesis and metastasis[J]. Histol Histopathol, 2012, 27(2):151-156.
[7] Wang Z, Li Y, Banerjee S,et al. Down-regulation of Notch-1 and Jagged-1 inhibits prostate cancer cell growth, migration and invasion, and induces apoptosis via inactivation of Akt, mTOR, and NF-κB signaling pathways[J]. J Cell Biochem, 2010, 109(4):726-736.
[8] Fortini ME. Notch signaling: the core pathway and its posttranslational regulation[J]. Dev Cell, 2009, 16(5): 633-647.
[9] Ranganathan P, Weaver KL, Capobianco AJ,et al. Notch signalling in solid tumours: a little bit of everything but not all the time[J]. Nat Rev Cancer, 2011, 11(5):338-351.
[10] Nefedova Y, Sullivan DM, Bolick SC,et al. Inhibition of Notch signaling induces apoptosis of myeloma cells and enhances sensitivity to chemotherapy[J]. Blood, 2008, 111(4):2220-2229.
[11] Wang Z, Li Y, Ahmad A,et al. Down-regulation of Notch-1 is associated with Akt and FoxM1 in inducing cell growth inhibition and apoptosis in prostate cancer cells[J]. J Cell Biochem, 2011, 112(1):78-88.
[12] Ye QF, Zhang YC, Peng XQ,et al. Silencing Notch-1 induces apoptosis and increases the chemosensitivity of prostate cancer cells to docetaxel through Bcl-2 and Bax[J]. Oncol Lett, 2012, 3(4): 879-884.
[13] Kim MY, Ann EJ, Mo JS,et al. JIP1 binding to RBP-Jκ mediates cross-talk between the Notch1 and JIP1-JNK signaling pathway[J]. Cell Death Differ, 2010, 17(11):1728-1738.
[14] Fan S, Qi M, Yu Y,et al. P53 activation plays a crucial role in silibinin induced ROS generation via PUMA and JNK[J]. Free Radic Res, 2012, 46(3):310-319.
[15] Yang G, Zhou X, Wang J,et al. MEHP-induced oxidative DNA damage and apoptosis in HepG2 cells correlates with p53-mediated mitochondria-dependent signaling pathway[J]. Food Chem Toxicol, 2012, 50(7):2424-2431.
[16] Chipuk JE, Moldoveanu T, Llambi F,et al. The BCL-2 family reunion[J]. Mol Cell, 2010, 37(3): 299-310.
[17] Whelan RS, Konstantinidis K, Wei AC,et al. Bax regulates primary necrosis through mitochondrial dynamics[J]. Proc Natl Acad Sci U S A, 2012, 109(17):6566-6571.
Notch-1genesilencingpromotesphosphorylationsofJNK1andp53inhumanbreastcancerMCF-7cells
YUAN Lei, CHEN Xu-dong, FAN Wen-juan, YANG Xu-guang, WANG Jian-guo
(LuoheMedicalCollege,Luohe462002,China.E-mail:wr0395@sina.com)
AIM: To investigate the effect ofNotch1 gene silencing on phosphorylations of JNK1 and p53 in human breast cancer MCF-7 cells.METHODSshRNA-Notch1 eukaryotic expression plasmid was constructed and transfected into MCF-7 cells. The expression of Notch1 and Hes-1 was observed by Western blotting after transfction. Apoptosis and mitochondrial membrane potential were detected by flow cytometry. Western blotting was also used to determine the protein levels of p-JNK1, p-p53, PUMA, NOXA and cleaved caspase-3 afterNotch1 silencing was performed in MCF-7 cells.RESULTSSilencing ofNotch1 significantly reduced the expression of Notch1 and Hes-1 in MCF-7 cells (P<0.01). In shNotch1 group, the number of apoptotic cells was much higher (P<0.01) and mitochondrial membrane potential was much lower (P<0.05) than those in shControl group. The protein levels of p-JNK1, p-p53, PUMA, NOXA and cleaved caspase-3 increased obviously after silencing ofNotch1 was performed in MCF-7 cells (P<0.05).CONCLUSIONNotch1 silencing induces apoptosis of human breast cancer MCF-7 cells through promoting phosphorylations of JNK1 and p53, and increasing the production of PUMA, NOXA and cleaved caspase-3.
Notch1 protein; Short hairpin RNA; JNK1 protein; p53 protein; MCF-7 cells
R737.9
A
10.3969/j.issn.1000- 4718.2013.06.010
1000- 4718(2013)06- 1014- 06
2012- 12- 31
2013- 04- 02
河南省基础与前沿技术研究计划项目(No.122300410277);漯河医学高等专科学校科研基金资助项目(No.2010-S10)
△通讯作者 Tel: 0395-2112681; E-mail: wr0395@sina.com
