骨钙素调节糖代谢的研究进展*
2013-10-24戴小宇滕华建徐兴全葛启婷
戴小宇, 滕华建, 徐兴全, 姚 尧, 葛启婷, 蒋 青△
(南京大学医学院附属鼓楼医院 1关节疾病诊治中心, 2关节疾病实验室,江苏 南京 210008)
·综述·
骨钙素调节糖代谢的研究进展*
戴小宇1,2, 滕华建2, 徐兴全1,2, 姚 尧1, 葛启婷2, 蒋 青1,2△
(南京大学医学院附属鼓楼医院1关节疾病诊治中心,2关节疾病实验室,江苏 南京 210008)
骨钙素(osteocalcin, OCN)作为骨细胞外基质的重要成分,现已被广泛视为一种能反映骨转换过程的特异性标志物[1]。经γ-谷酰基羧化酶介导,OCN可通过依赖于维生素K和二氧化碳的γ-羧化对其所含的3个谷氨酸残基行翻译后修饰,从而增加其与游离钙离子及羟基磷灰石的亲附性并大量聚集在骨基质中,少量OCN则进入血液循环中,因此OCN也被称为骨γ-羧基谷氨酸蛋白(bone γ-car-boxyglutamic acid protein,BGP)[2-3]。实验表明,未羧化OCN(uncarboxylated osteocalcin,OCuc)及羧化不全OCN(undercarboxylated osteocalcin,ucOC)具有一定的生物活性,两者存在于血液循环中可参与调节血糖代谢,且整体呈现为正性调控的作用,完全羧化OCN(carboxylated osteocalcin,cOC)则处于失活状态并影响着骨质形成、吸收及矿化[4-5]。OCN主要通过诱导胰腺β细胞的增殖、促进胰岛素的合成与分泌,增加外周组织的胰岛素敏感性等,对血糖平衡进行调节[4-5]。而肠球菌表面蛋白(enterococcal surface protein,ESP)基因作为一种仅表达在胚胎干细胞、睾丸支持细胞及成骨细胞中的特异性基因[6],其编码产物骨-睾丸蛋白酪氨酸磷酸酶(osteotesticular protein tyrosine phosphatase,OST-PTP)可作用于OCN的上游通路,抑制其羧化进而阻断OCN对血糖水平的正性调节[4]。最近研究证实,胰岛素信号、脂联素等在OCN对血糖代谢的整体调控机制中也发挥着重要的作用。现从分子水平就这些已有结果并结合临床中人血清OCN含量与血糖代谢的相关性研究进行较为全面的论述。
1 胰岛素信号介导ESP基因对OCN活性的调节
研究表明,胰岛素受体(insulin receptor,InsR)在成骨细胞中表达并能调节胰岛素的产生[4],此进一步提示了胰岛素信号在OCN调节糖代谢过程中的潜在作用。Ferron等[7]研究发现小鼠成骨细胞中的OST-PTP可以InsR为底物使其去磷酸化,抑制其与胰岛素的结合,从而实现ESP基因对胰岛素信号的调控。同时,在成骨细胞中敲除InsR基因后,InsRfosb-/-小鼠表现出明显的高血糖,而β细胞增殖水平、血清胰岛素浓度及机体葡萄糖耐量均出现下降。这与成骨细胞中OCN表达缺失的OCN-/-小鼠表型近乎相同,而尽管InsRosb-/-小鼠中OCN的表达及血清中含量并未改变,ucOC水平却出现下降。后续双敲除OCN基因与InsR基因的OCN+/-InsRosb+/-小鼠可表现出糖代谢平衡受损及低ucOC含量,表明InsR与OCN可能作用于相同的通路,且InsR的缺失直接导致了ucOC浓度的降低。此外,成骨细胞中缺失ESP基因的ESP-/-小鼠出现胰岛素信号表达上调,InsR磷酸化作用增强,在特异性去除InsR的一个等位基因后也可纠正其高胰岛素分泌量及低血糖表现[7]。由此证实,胰岛素信号作用于OCN上游进而增强OCN活性,其与ESP基因及OCN作用于相同的分子通路并介于两者之间,参与对OCN生物活性的调节。
2 胰岛素信号:通过促进骨质吸收增加OCN活性
I型胶原交联末端肽(C-terminal cross-linking telopeptide of type I collagen, CTx)作为一种反映骨质吸收的特异性标志物,临床中常被用作评价骨质疏松疗效的指标[8]。但InsRosb-/-小鼠表现为低骨量且血清中CTx浓度降低,而在ESP-/-小鼠中CTx却表达上调,此进一步指出了胰岛素信号可能存在的促骨质吸收作用[7]。人叉头框蛋白O1(forkhead box O1,FoxO1)是一种常作用于InsR下游的转录因子,其能抑制胰岛素在胰腺、脂肪、肌肉等不同组织中发挥各自的生物学效应[9-10]。深入研究表明,胰岛素与InsR结合可以抑制FoxO1的磷酸化,进而减少骨保护素的产生,使得核因子κB受体活化因子配体生成增多并最终导致骨质吸收的增加[7]。同时,破骨细胞中的2个特异性蛋白T细胞免疫调节因子1(T-cell immune regulator 1,Tcirg1)和组织蛋白酶K在InsRosb-/-小鼠中表达下降,而在ESP-/-小鼠中却出现上调,也更为有力地支持了上述观点[11]。
Tcirg1基因编码产生的空泡质子泵可对骨细胞外基质(extracellular matrix, ECM)进行酸化进而诱发骨质吸收,而Tcigr1表达缺失的oc/oc小鼠可导致骨硬化症,且伴有明显的血清低胰岛素含量等糖代谢受损表现。后续研究证实,破骨细胞性骨吸收陷窝自身的酸性环境(pH约为4.5)可促进ECM的酸化,从而引起骨基质中的OCN脱羧化形成ucOC及OCuc并最终释放入血。而将oc/oc小鼠的骨髓造血干细胞注入野生型小鼠后,骨质硬化、糖耐量受损、血中ucOC浓度持续性下降等相关表型的出现,则证实了Tcirg1缺失所引起的ECM酸化可以下调OCN的活性[12]。综合来看,OCN作为一种促胰岛素分泌剂,其诱发生成的大量胰岛素反过来可通过与InsR结合促进骨质吸收,进而使得脱羧化的OCN进入血液并对血糖代谢发挥其正性作用。
3 胰岛素信号上调成骨细胞中OCN基因的表达
InsRosb-/-小鼠表现出低骨量,且成骨细胞伴有一定程度的分化缺陷,表明胰岛素信号的介导可能会影响成骨细胞的分化进程及功能等[13]。Runt相关转录因子2(Runt-related transcription factor 2,Runx2)作为一种调节成骨细胞分化的转录因子,可诱使骨髓间充质干细胞向成骨细胞分化[14]。Fulzele等[13]研究发现无InsR的成骨细胞在分化时Runx2表达下调,其与OCN基因启动子的结合率也下降,而经胰岛素处理后两者均显著增强。同时,成骨细胞中OCN mRNA的表达在胰岛素作用时增加6倍,Runx2却不受影响,这进一步提示胰岛素信号介导OCN基因的表达可能是部分通过上调Runx2的活性实现的,但并非直接作用于Runx2。后续实验显示,胰岛素作用后的成骨细胞中Twist2 mRNA表达下调,且缺失InsR后Runx2与Twist2的结合增多并伴有Runx2活性降低,鉴于Twist2 作为一种Runx2活性抑制剂[15],可进一步证实胰岛素信号通过抑制Twist2的表达进而增加Runx2的活性,最终促进成骨细胞自身的增殖分化[13]。然而,最近Okazaki等[14]提出Runx2可抑制成骨细胞分化而使其停留在骨细胞这一不成熟阶段。Freude等[16]在也发现,葡萄糖及胰岛素同时存在时,OCN及Runx2表达的降低可使人成骨细胞活性下降,但转化生长因子β(transforming growth factor-β,TGF-β)却生成增加,而阻断TGF-β信号即可恢复成骨细胞原有活性,此表明了TGF-β可能存在的对Runx2的负性调节。因此,关于Runx2是否能作为连接胰岛素信号与成骨细胞的分化成熟之间的枢纽仍有待深入研究,而TGF-β在其中的作用也为后续研究提供了新的思路。
临床中,糖尿病人群常因成骨细胞活性降低而引发骨质疏松,而骨质的丢失易引起OCN含量的下降,由此可能产生的对血糖代谢的影响也是不容忽视的[17]。Fulzele等[13]发现胰岛素信号的表达对于小鼠出生后骨质的形成是不可或缺的,3周龄的InsRosb-/-小鼠易因成骨细胞数量明显减少而导致松质骨量及厚度降低,但破骨细胞数量却不受影响,这在一定程度上证实InsR的缺失对于成骨细胞的调节从小鼠出生后就存在并且较为显著。同时,在6周龄时成骨细胞数量的轻度增加[13],再次指出了胰岛素信号在对骨代谢的调控过程中可能存在的变化。Irwin等[18]在对全身性InsR表达缺失的小鼠研究时发现,6月龄小鼠皮质骨区出现增大但不影响其整体骨量,且InsR的表达下调并非是导致1型糖尿病(type 1 diabetes,T1D)骨质流失的主要原因。最近,Coe等[19]研究胰岛素2(insulin-2,Ins2)基因突变的Ins2+/-小鼠时也指出,其在出生后近5周即可自发形成T1D,并在10周龄时因T1D所致的成骨细胞活性降低而引起股骨及胫骨松质骨量减少,但皮质骨量无任何变化。目前关于糖尿病所引起的骨质流失的具体机制尚未明确,同时,尽管上述不同研究对小鼠骨量测定的时间不统一,功能缺失的基因也并非一致,但基于InsR及Ins2均存在于胰岛素信号系统中,深入探讨该信号在不同阶段对成骨细胞自身功能、活性等的调控,并结合其可能通过影响OCN水平进而发挥对血糖代谢的调节,将为糖尿病性骨质流失及糖尿病患者自身血糖控制的后续研究提供新的理论依据。
4 脂联素增加外周组织对胰岛素的敏感性
脂联素作为一种特异性脂肪因子,可抑制肝糖原合成,促进脂肪酸在肝脏及骨骼肌中的氧化,并增加骨骼肌的葡萄糖摄人量,从而提高外周组织对胰岛素的敏感性,临床中常用的噻唑烷二酮类降糖药物也可部分通过增加脂联素的生成以发挥其效应[20]。通常胰岛素分泌过多会因InsR表达下调而引起其外周敏感性降低,但在ESP-/-小鼠的肌肉、肝脏及脂肪中却表现出敏感性增加[21]。深入研究显示ESP-/-小鼠脂肪组织中脂联素基因的表达明显上调,血清中脂联素含量也增加至正常时的2倍,但在OCN-/-小鼠中却出现下降并伴有胰岛素敏感性的降低。后续在对野生型小鼠持续输注重组OCN时发现,输注速率为0.3 ng/h和3.0 ng/h时胰岛素敏感性显著上升且在该浓度范围内脂联素的表达呈剂量依赖性上调[5],此进一步证实外周组织中OCN对胰岛素的增敏作用至少部分是通过脂联素的生成增加实现的。临床中,一些研究已证实人血清OCN含量与脂联素水平及高胰岛素敏感性之间存在正相关性,而脂联素的增加能改善胰岛素敏感性也已得到验证[22-23]。然而,现阶段用于评价OCN与胰岛素敏感性相关性仍主要根据稳态模式评估-胰岛素抵抗指数,而限于该方法对胰岛素分泌时的动态变化及β细胞严重受损情况下的评估缺乏一定的准确性,使得其与另一常用的高胰岛素正葡萄糖钳夹试验法所得结果往往不一致[24]。尽管最近Hwang等[24]采用了口服葡萄糖耐量实验在不同时段对胰岛素敏感性进行动态检测,其特异性也仍需深入研究,而本实验也第一次指出虽然血清中脂联素浓度与OCN含量呈正相关,且胰岛素敏感性也出现上调,但该效应并不依赖于脂联素表达的增加。此外,Schwetz等[1]指出ESP-/-小鼠因耗能增加也可促进胰岛素敏感性的增加,考虑到OCN先前被认为是运动可以改善胰岛素敏感性的主要原因,由此可见,脂联素是否与人体外周组织胰岛素敏感性的增加相关,且OCN表达上调诱发的耗能增加是否也通过脂联素参与对血糖的调节也仍将会是后续研究亟待解决的问题。
5 脂联素是一种潜在的促胰岛素分泌剂
脂联素受体1、2可在人胰岛β细胞中表达,但Staiger等[25]研究发现,人血清中脂联素在正常及葡萄糖刺激的情况下与胰岛素的分泌量无明显相关性,这提示我们脂联素对胰岛素分泌的影响可能是不存在的。而Gu等[26]在对大鼠胰岛进行体外培养时指出,葡萄糖浓度达16.7 mmol/L时,脂联素可促进腺苷酸活化蛋白激酶 (adenosine monophosphate-activated protein kinase,AMPK) 的磷酸化进而增加胰岛素的分泌。后续研究中,Okamoto等[27]发现在葡萄糖浓度为5.6 mmol/L时,脂联素能使小鼠β细胞分泌的胰岛素分泌量增至原有2~3倍,但其不影响AMPK的活性,同时对C57BL/6小鼠行静脉内注射脂联素后可使其胰岛素产生量增加至正常时的1.6倍,这些结果表明脂联素促进胰岛素分泌是在葡萄糖浓度相对较低时实现的,而并非通过增加AMPK活性所致,这也与Gu等的研究结果相悖。最进,国内研究[28]指出lipin 1 (LPIN1) 作为一种新的脂肪因子,AMPK的磷酸化可增强其表达进而影响糖脂代谢,降低胰岛素抵抗。王梅等[29]更是首次证实了在葡萄糖和胰岛素浓度分别低于30 mmol/L及1×10-7mmo/L时,较高浓度的葡萄糖和胰岛素均能抑制心肌细胞中脂联素的表达。目前关于脂联素能否作为一种促胰岛素分泌剂仍存在争议,体内外实验中所采用的评估方法各异可能也是导致结果不一的原因。但考虑到OCN能促进脂联素基因的表达,深入探讨脂联素在不同部位及不同血糖浓度情况下与胰岛素分泌量的相关性,并且结合AMPK及其下游分子通路在此过程中的潜在作用,将为OCN促进胰岛素分泌这一生物学效应的研究指明新的方向,也为后续阐明OCN对糖代谢的调控机制提供了新的可能。
6 OCN与糖代谢在临床中的相关性
人体血液中OCN的含量变化受多种因素的影响,如年龄、性别、种族、吸烟史、体脂水平、季节、气候等,目前的一些临床研究显示人血清中OCN含量与空腹血糖水平、空腹胰岛素水平、糖化血红蛋白(glycated hemoglobin,HbA1c)浓度及外周胰岛素抵抗呈负相关,而在2型糖尿病(type 2 diabetes,T2D)患者中OCN浓度明显降低,这在很大程度上与动物实验所得结果保持一致,整体上也仍能反映出OCN对人体血糖代谢的正性调节作用[30-31]。然而,Thrailkill等[2]发现T1D患者血清中ucOC浓度与高表达的CTx及低浓度HbA1c存在相关性,但与同年龄层的正常人群相比,ucOC及cOC水平在2组人群中均无差异。同时,Shea等[22]在对无糖尿病的老年人群随访3年后指出,OCuc与外周胰岛素抵抗无明显相关性。因此,在更大范围和不同年龄层次的人群中就OCN在T1D和T2D患者中可能存在的浓度差异以及其对血糖的调节仍有待探讨。现阶段研究大多集中于血清中总OCN水平的变化,而OCuc、ucOC、cOC或是总OCN对人体血糖的调节作用抑或是其中的一些共同参与所产生的效应仍属未知, 结合先前研究所提出的ucOC与总OCN与胰岛素敏感性的增加相关,且OCuc与胰岛素分泌相关,不同形式的OCN与特异性反映血糖代谢的不同指标之间可能存在的联系则显得尤为重要[1,20,22,24,32]。考虑到Ferron等[5]证实重组OCuc在低浓度(0.3 μg/L)时可促进β细胞增殖及胰岛素的生成,而在浓度为10或30 μg/L时又可增加胰岛素敏感性,人血清中OCN发挥正性调节糖代谢效应时的最适浓度也将是后续研究的重点。
OCN含量的变化可能是一种相对短暂、对人体血糖失衡时的代偿性、适应性变化,一定程度上可以起到积极的作用,而其来源于骨,进一步表明机体各系统、器官可能扮演的其它角色[3]。通过对患有妊娠期糖尿病的女性患者的研究,Winhofer等[33]发现患者血清OCN浓度更高但在产后12周后又恢复至正常水平,而短暂增加的OCN也被认为是对糖耐量受损的一种适应性的变化。OCN活性的上调有赖于骨质吸收的增加,而服用抗骨质疏松药物可引起血清ucOC含量下降,但最近Fernández-Real等指出女性患者服用双膦酸盐类药物等时血糖水平未出现明显变化,因此就该类药物是否因影响ucOC浓度进而对血糖平衡产生调控效应仍有待进一步的证实[3,32]。
7 结语与展望
OCN在成骨细胞中特异性表达,具有生物活性的ucOC及OCuc在进入血液后可促进β细胞增殖,增加胰岛素分泌,并通过上调脂联素的表达进而改善外周组织对胰岛素的敏感性。研究证实生成增多的胰岛素反过来能与成骨细胞中的InsR结合,经胰岛素信号的介导上调OCN基因的表达,并促进ucOC和OCuc再次释放入血,同时,InsR的活性受ESP基因的负性调控,而脂联素自身可能也能作为一种潜在的促胰岛素分泌剂参与OCN对机体血糖代谢的调节,见图1。尽管目前就OCN对糖代谢的具体调控效应仍存有质疑,但现有的大部分临床研究仍支持OCN对血糖平衡的正性调控效应。成骨细胞调节血糖代谢可能只是部分通过OCN实现的,其分泌产生的其它分子也可能参与其中,而体外研究中也已证实脂肪组织同样能表达cOC及ucOC[1]。因此,结合潜在的OCN受体[31],深入研究成骨细胞对血糖水平的调节及可能产生OCN的不同器官、组织在其中发挥的作用,将进一步完善OCN对机体血糖糖代谢的调节机制,也可为未来临床治疗糖尿病及其相关并发症如骨质疏松等提供新的治疗策略。
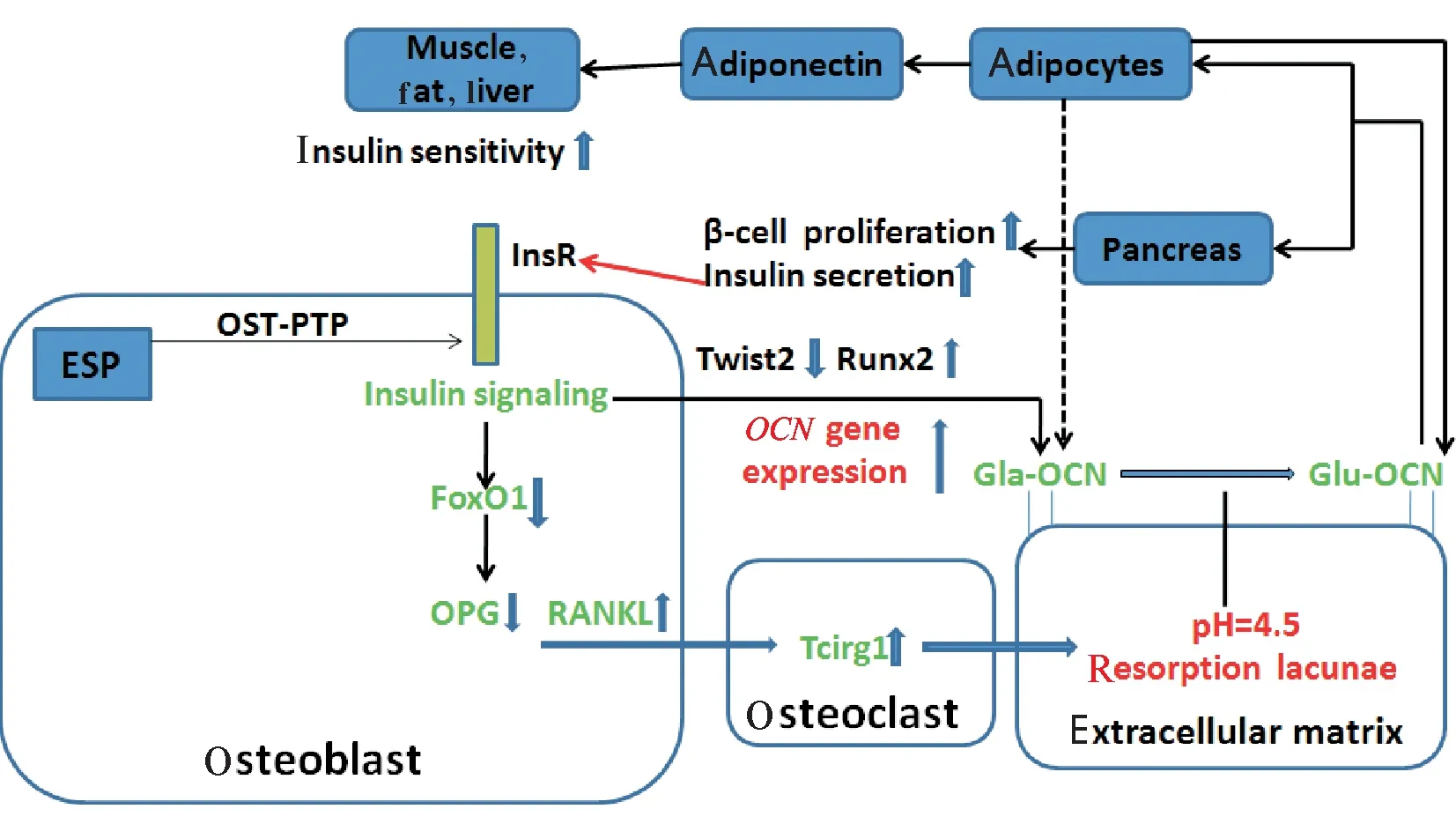
Figure 1. Specific mechanism in osteocalcin for regulation of glucose metabolism.
图1OCN调节糖代谢过程的具体机制
[1] Schwetz V, Pieber T, Obermayer-Pietsch B. The endocrine role of the skeleton: background and clinical evidence[J]. Eur J Endocrinol, 2012, 166(6):959-967.
[2] Thrailkill KM, Jo CH, Cockrell GE, et al. Determinants of undercarboxylated and carboxylated osteocalcin concentrations in type 1 diabetes[J]. Osteoporos Int, 2012, 23(6): 1799-1806.
[3] Ducy P. The role of osteocalcin in the endocrine cross-talk between bone remodelling and energy metabolism[J]. Diabetologia, 2011, 54(6):1291-1297.
[4] Lee NK, Sowa H, Hinoi E, et al. Endocrine regulation of energy metabolism by the skeleton[J]. Cell, 2007, 130(3):456-469.
[5] Ferron M, Hinoi E, Karsenty G, et al. Osteocalcin differentially regulates β cell and adipocyte gene expression and affects the development of metabolic diseases in wild-type mice[J]. Proc Natl Acad Sci U S A, 2008, 105(13):5266-5270.
[6] Confavreux CB. Bone: from a reservoir of minerals to a regulator of energy metabolism[J]. Kidney Int Suppl, 2011, 79(Suppl 121):S14-S19.
[7] Ferron M, Wei J, Yoshizawa T, et al. Insulin signaling in osteoblasts integrates bone remodeling and energy metabolism[J]. Cell, 2010, 142(2):296-308.
[8] Winhofer Y, Kiefer FW, Handisurya A, et al. CTX (crosslaps) rather than osteopontin is associated with disturbed glucose metabolism in gestational diabetes[J]. PLoS One, 2012, 7(7):e40947.
[9] Accili D, Arden KC. FoxOs at the crossroads of cellular metabolism, differentiation, and transformation[J]. Cell, 2004, 117(4):421-426.
[10] Nakae J, Kitamura T, Kitamura Y, et al. The forkhead transcription factor Foxo1 regulates adipocyte differentiation[J]. Dev Cell, 2003, 4(1):119-129.
[11] Clemens TL, Karsenty G. The osteoblast: an insulin target cell controlling glucose homeostasis[J]. J Bone Miner Res, 2011, 26(4):677-680.
[12] Ferron M, Wei J, Yoshizawa T, et al. An ELISA-based method to quantify osteocalcin carboxylation in mice[J]. Biochem Biophys Res Commun, 2010, 397(4): 691-696.
[13] Fulzele K, Riddle RC, DiGirolamo DJ, et al. Insulin receptor signaling in osteoblasts regulates postnatal bone acquisition and body composition[J]. Cell, 2010, 142(2):309-319.
[14] Okazaki K, Yamaquchi T, Tanaka K, et al. Advanced glycation end products (AGEs), but not high glucose, inhibit the osteoblastic differentiation of mouse stromal ST2 cells through the suppression of osterix expression, and inhibit cell growth and increasing cell apoptosis[J]. Calcif Tissue Int, 2012, 91(4):286-296.
[15] Bialek P, Kern B, Yang X, et al. A twist code determines the onset of osteoblast differentiation[J]. Dev Cel, 2004, 6(3):423-435.
[16] Freude T, Braun KF, Haug A, et al. Hyperinsulinemia reduces osteoblast activityinvitrovia upregulation of TGF-beta[J]. J Mol Med (Berl), 2012, 90(11):1257-1266.
[17] Rasul S, Ilhan A, Wagner L, et al. Diabetic polyneuropathy relates to bone metabolism and markers of bone turnover in elderly patients with type 2 diabetes: greater effects in male patients[J]. Gend Med, 2012, 9(3):187-196.
[18] Irwin R, Lin HV, Motyl KJ, et al. Normal bone density obtained in the absence of insulin receptor expression in bone[J]. Endocrinology, 2006, 147(12):5760-5767.
[19] Coe LM, Zhang J, McCabe LR. Both spontaneousIns2+/-and streptozotocin-induced type I diabetes cause bone loss in young mice[J]. J Cell Physiol, 2013,228(4):689-695.
[20] Gravenstein KS, Napora JK, Short RG, et al. Cross-sectional evidence of a signaling pathway from bone homeostasis to glucose metabolism[J]. J Clin Endocrinol Metab, 2011, 96(6):E884-E890.
[21] Lee NK, Karsenty G. Reciprocal regulation of bone and energy metabolism[J]. Trends Endocrinol Metab, 2008, 19(5):161-166.
[22] Shea MK, Gundberq CM, Meiqs JB, et al. Gamma-carboxylation of osteocalcin and insulin resistance in older men and women[J]. Am J Clin Nutr, 2009, 90(5):1230-1235.
[23] Hivert MF, Sullivan LM, Fox CS, et al. Associations of adiponectin, resistin, and tumor necrosis factor-α with insulin resistance[J]. J Clin Endocrinol Metab, 2008, 93(8):3165-3172.
[24] Hwang YC, Jeong IK, Ahn KJ, et al. Circulating osteocalcin level is associated with improved glucose tolerance, insulin secretion and sensitivity independent of the plasma adiponectin level[J]. Osteoporos Int, 2012, 23(4):1337-1342.
[25] Staiger K, Stefan N, Staiger H, et al. Adiponectin is functionally active in human islets but does not affect insulin secretory function or β-cell lipoapoptosis[J]. J Clin Endocrinol Metab, 2005, 90(12):6707-6713.
[26] Gu W, Li X, Liu C, et al. Globular adiponectin augments insulin secretion from pancreatic islet β cells at high glucose concentrations[J]. Endocrine, 2006, 30(2):217-221.
[27] Okamoto M, Ohara-Imaizumi M, Kubota N, et al. Adiponectin induces insulin secretioninvitroandinvivoat a low glucose concentration[J]. Diabetologia, 2008, 51(5):827-835.
[28] 庄向华, 刘元涛, 倪一红, 等. 二甲双胍对高脂饮食诱导的胰岛素抵抗大鼠LPIN1表达及AMPK通路的作用[J]. 中国病理生理杂志, 2011,27(12):2276-2280.
[29] 王 梅, 杨 蓉, 王亚玲, 等. 不同浓度葡萄糖、胰岛素对新生大鼠心肌细胞脂联素表达的影响[J]. 中国病理生理杂志, 2011,27(2):371-374.
[30] Kim YS, Paik IY, Rhie YJ, et al. Integrative physiology: defined novel metabolic roles of osteocalcin[J]. J Korean Med Sci, 2010, 25(7):985-991.
[33] Winhofer Y, Handisurya A, Tura A, et al. Osteocalcin is related to enhanced insulin secretion in gestational diabetes mellitus[J]. Diabetes Care, 2010, 33(1):139-143.
Researchprogressinregulationofglucosemetabolismbyosteocalcin
DAI Xiao-yu1,2, TENG Hua-jian2, XU Xing-quan1,2, YAO Yao1, GE Qi-ting2, JIANG Qing1,2
(1BoneandJointDiseaseCenter,2LaboratoryforBoneandJointDiseases,DrumTowerHospitalAffiliatedtoMedicalSchoolofNanjingUniversity,Nanjing210008,China.E-mail:jiangqing112@hotmail.com)
Osteocalcin (OCN) is a non-collagenous protein, which is synthesized and secreted by osteoblasts and closely associated with bone metabolism. Previously, blood circulation-derived OCN has been confirmed to promote β-cell proliferation, enhance insulin secretion, and improve insulin sensitivity by increasing the expression of adiponectin. Recent studies indicate that insulin signaling in the regulation of OCN activity mediated by osteoblasts is through the enterococcal surface protein (ESP) gene to increase the expression ofOCNgene and enhance OCN activity by favoring bone resorption. Meanwhile, adiponectin may also behave as a kind of insulin secretagogue potentially. Intense researches on the specific mechanism concerning the effects of insulin signaling and adiponectin during the process of glucose homeostasis by OCN may provide new therapeutic targets for treating diabetes and its related complications.
骨钙素; 葡萄糖代谢; 胰岛素信号; 脂联素
Osteocalcin; Glucose metabolism; Insulin signaling; Adiponectin
R363
A
10.3969/j.issn.1000- 4718.2013.05.033
1000- 4718(2013)05- 0952- 06
2012- 12- 11
2013- 03- 26
国家杰出青年科学基金资助项目(No. 81125013)
△通讯作者 Tel: 025-83317016; E-mail: jiangqing112@hotmail.com
