组蛋白的制备及其对巨噬细胞的影响*
2013-10-24付晓霞钟玙沄陈小欢蔡军伟刘靖华
付晓霞, 叶 萍, 李 雪, 钟玙沄, 崔 航, 陈小欢, 蔡军伟, 姜 勇, 刘靖华
(南方医科大学基础医学院病理生理学教研室,广东省功能蛋白质组学重点实验室,广东 广州 510515)
组蛋白的制备及其对巨噬细胞的影响*
付晓霞, 叶 萍, 李 雪, 钟玙沄, 崔 航, 陈小欢, 蔡军伟, 姜 勇△, 刘靖华△
(南方医科大学基础医学院病理生理学教研室,广东省功能蛋白质组学重点实验室,广东 广州 510515)
目的用不同方法制备组蛋白并观察组蛋白在体外对巨噬细胞活力及细胞因子释放的影响。方法用基因克隆的方法构建组蛋白H3和H4的原核表达质粒,分别表达和纯化带谷胱甘肽S-转移酶(GST)和组氨酸(His)标签的组蛋白(GST-H3、GST-H4、His-H3和His-H4);用高盐法提取真核细胞(RAW264.7和293F细胞)组蛋白;用上述不同来源组蛋白(7.5~50 mg/L)刺激巨噬细胞4 h,利用MTT和流式细胞术检测巨噬细胞活力;用液相芯片方法检测不同来源组蛋白对巨噬细胞释放在培养上清中的细胞因子白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)的浓度。结果His-H3/H4和真核细胞来源的组蛋白明显降低细胞活性,诱导RAW264.7细胞发生晚期凋亡和坏死;不同来源组蛋白对RAW264.7细胞释放IL-6和TNF-α均有不同程度的促进作用。结论原核表达His-H3、His-H4及真核细胞提取的组蛋白均可抑制巨噬细胞活力,诱导巨噬细胞发生晚期凋亡和坏死。组蛋白可能通过促进炎症细胞因子的释放参与了炎症反应过程。
原核蛋白表达; 组蛋白类; 巨噬细胞
组蛋白(histone,H)是真核生物染色体的基本结构蛋白。组蛋白分子量较小(约10~20 kD),富含带正电荷的碱性氨基酸,能与DNA中带负电荷的磷酸基团相互作用,共同组成染色体的基本单位。因氨基酸的成分和分子量不同,组蛋白主要分为H1、H2A、H2B、H3和H4五种,其中,H2A、H2B、H3和H4各2个分子组成组蛋白八聚体,由H1连接。DNA紧密缠绕在八聚体周围形成染色质,限制DNA与其它活性物质的接触。某些蛋白质能对组蛋白进行翻译后修饰,从而调整核小体的结构,使DNA的易接触性发生改变,通过这种方式来调节DNA的转录和复制。越来越多的研究结果表明,组蛋白的翻译后修饰对基因的转录和表达发挥至关重要的作用[1-4]。
近来有研究发现,当细胞核中的组蛋白由于某种原因进入血液循环或者被释放到细胞外时,可产生细胞毒性作用进而引起机体的反应。例如,有研究发现脓毒症患者血液中组蛋白的浓度较高,H3达到15 mg/L,组蛋白很可能作为一种核内容物对机体造成损伤[5]。目前对其机制尚不清楚。本研究拟通过基因工程和提纯的方法大量获得组蛋白,为进一步研究组蛋白提供材料;利用获取的组蛋白刺激巨噬细胞,通过观察组蛋白对巨噬细胞活力及细胞因子释放的影响,初步探讨组蛋白对巨噬细胞的影响。
材 料 和 方 法
1主要实验材料和仪器
DMEM培养基和PBS(Gibco),胎牛血清(FBS)(Hyclone),SFM培养基(Invitrogen),细胞裂解液(CST),LB培养基(Invitrogen),MTT(Sigma),多粘菌素B(Calbiochem);琼脂糖亲和层析柱、谷胱甘肽S-转移酶(glutathioneS-transferase,GST)和组氨酸(histidine,His)标签纯化树脂(Novagen),切胶回收试剂盒、质粒提取试剂盒(康为公司),逆转录试剂盒(Toyobo),细胞因子检测试剂盒(Millipore),引物合成由华大基因公司完成,CO2培养箱(Heraeus),多光谱微孔板阅读器M5(GE),流式细胞仪(BD),液相芯片工作站(Qiagen)。RAW264.7细胞株由本实验室冻存。
2方法
2.1组蛋白原核表达质粒的构建
2.1.2原核表达质粒的构建 将表达载体pGEX-4T-1、pET-14b与PCR获得的H3、H4片段双酶切后回收并连接,连接反应体系是10 μL,反应条件为16 ℃,1 h。连接后将其转化感受态大肠杆菌DH5α,铺板,挑克隆,用PCR及双酶切鉴定构建成功后送测序,确保质粒中H3和H4编码序列正确。
2.2原核表达质粒的转化、目的蛋白的表达及纯化 质粒构建成功后,将其转化感受态的大肠杆菌DE3(BL21),铺板,挑菌,扩增,加入异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)(0.1 mmol/L),25 ℃诱导表达18 h,收集细菌。带GST标签的组蛋白纯化方法如下:收集细菌后,加GST缓冲液超声裂解,4 ℃、12 000 r/min离心20 min,留取上清,加入GST琼脂糖珠,4 ℃孵育2 h,上清与纯化树脂充分结合后,将其置于亲和层析柱中,用GST缓冲液清洗3次,洗脱蛋白。洗脱的蛋白用 PBS 透析3 次(每次8 h),以去除谷胱甘肽,透析后的蛋白定量分装。带His标签的组蛋白主要存在于包涵体中,故用尿素变性并按纯化包涵体法进行纯化。方法如下:收集细菌后,加His缓冲液超声裂解,4 ℃、12 000 r/min离心20 min,弃上清,用变性溶解缓冲液重悬沉淀后超声裂解,离心后留取上清,加入His琼脂糖珠,4 ℃孵育2 h,上清与纯化树脂充分结合后,将其置于亲和层析柱中,用变性溶解缓冲液清洗3次,加适量变性洗脱缓冲液,用前加二硫苏糖醇(dithiothreitol,DTT),使其终浓度为5 mmol/L,洗脱蛋白。然后依次用含8 mol/L、7 mol/L、6 mol/L、5 mol/L、4 mol/L、3 mol/L、2 mol/L、1 mol/L和0 mol/L尿素的PBS缓冲液透析洗脱后的蛋白,每个浓度梯度透析6 h。透析结束后,离心并收集上清。将获得的蛋白行15%SDS-PAGE电泳、考马斯亮蓝染色后分析纯度。
2.3真核细胞组蛋白提取 真核细胞组蛋白的提取主要利用盐提取法[6]。方法如下:培养RAW264.7细胞(同上)及293F细胞(SFM培养基,28 ℃,悬浮培养),各收取1×107个细胞,冰PBS洗2次,加入1 mL含0.2% NP40的萃取液[10 mmol/L HEPES(pH 7.9),10 mmol/L KCl,1.5 mmol/L MgCl2,0.34 mol/L 蔗糖,10% 甘油],混匀细胞,冰上孵育10 min,离心5 min,弃除上清。用500 μL无NP40萃取液清洗3次沉淀,加入1 mL无盐缓冲液(3 mmol/L EDTA,0.2 mmol/L EGTA),漩涡振荡1 min,置于4 ℃摇床30 min,取出后于4 ℃、6 500×g离心5 min,保留沉淀,加200 μL高盐缓冲液[50 mmol/L Tris-HCl(pH 8.0),2.5 mol/L NaCl,0.05% NP40],振荡2 min,至沉淀充分混匀,呈玻璃样混浊,再次置于4 ℃摇床摇30 min,取出后4 ℃、16 000×g离心10 min,留取上清,将上清置于透析袋透析(pH 8.0的Tris-HCl溶液),透析3次,每次1 h。透析结束后,4 ℃、16 000×g离心10 min,得到上清即为组蛋白。将获得的蛋白行15%SDS-PAGE电泳及考马斯亮蓝染色后分析纯度。
2.4MTT实验 MTT实验测定组蛋白对细胞活力的影响。取对数生长期的RAW264.7细胞,细胞计数后,接种于96孔培养皿中,调整细胞密度为1×104cells/well,设空白对照孔。培养24 h后,分别加入不同浓度的组蛋白刺激RAW264.7细胞(4h),每组设5个复孔。孵育结束后,按10 μL/well加MTT溶液(终浓度5 g/L),37 ℃孵育4 h,弃细胞培养液。加入二甲基亚砜100 μL/well,摇床上孵育10 min,于562 nm波长处测定吸光度(A)。细胞存活率(%)=(实验组A值-空白组A值)/(对照组A值-空白组A值)。
2.5流式细胞术检测 取对数生长期的细胞,接种于6孔板中,调整细胞密度为5×105cells/well。培养24 h后,分别用浓度为12.5、25和50 mg/L的His-H3刺激RAW 264.7细胞(4 h)。孵育结束后,用Annexin V-FITC细胞凋亡检测试剂盒和流式细胞术检测细胞凋亡情况。每组收取(1~5)×105个细胞,用PBS洗2遍,加入500 μL结合缓冲液重悬细胞,然后加入5 μL Annexin V-FITC混匀后,再加入5 μL碘化丙啶(propidium iodide,PI)混匀,室温避光5~15 min,用流式细胞仪在激发波长488 nm、发射波长530 nm条件下检测。
2.6细胞因子检测实验 分别用浓度为12.5、25和50 mg/L的组蛋白刺激RAW264.7细胞,同时用50 mg/L的GST处理细胞作为对照。为了排除LPS的影响,培养基中均加入多粘菌素B,浓度为10 mg/L。收集刺激后的培养上清,用液相芯片技术检测上清中的肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和白细胞介素6(interleukin-6,IL-6)的浓度[7]。
3统计学处理
采用SPSS 13.0统计软件进行数据处理分析,数据以均数±标准差(mean±SD)表示,各组数据组间比较采用单因素方差分析,两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1pGEX-H3、pGEX-H4、pET-H3和pET-H4质粒的构建
ERCP模块接收到自动制动手柄指令,给均衡风缸减压到目标值;BPCP模块响应均衡风缸压力变化,制动管被减压到均衡风缸目标压力;16CP/DBTV模块响应列车管减压变化,给作用管充风;BCCP模块响应作用管压力增加,机车制动缸充风制动;同时车辆副风缸给车辆制动缸充风,车辆制动机制动。
PCR、酶切和测序结果表明pGEX-H3、pGEX-H4、pET-H3和pET-H4质粒构建成功。pGEX-H3和pGEX-H4的PCR和酶切鉴定结果见图1。

Figure 1. Identification of pGEX-H3 and pGEX-H4 plasmids. M:DNA marker;1: H3 PCR product; 2: pGEX-4T-1 plasmid; 3: pGEX-H3 plasmid; 4: pGEX-H3BamH I/XhoI digestion product; 5: H4 PCR product; 6: pGEX-4T-1 plasmid; 7: pGEX-H4 plasmid; 8: pGEX-H4BamH I/XhoI digestion product.
图1pGEX-H3和pGEX-H4重组质粒的PCR和酶切鉴定
2重组组蛋白及真核细胞中提取的组蛋白的电泳结果
15%SDS-PAGE电泳结果发现,His-H3蛋白大小为17 kD,His-H4蛋白为12 kD,GST-H3蛋白约43 kD,GST-H4蛋白约38 kD,与理论分子量基本一致,见图2A。从真核细胞RAW264.7及293F中提取的组蛋白见图2B,从上向下依次为H1、H3、H2A、H2B和H4。H1分子量约为35 kD,大于其理论分子量21 kD,可能与其在细胞内翻译后修饰如甲基化、糖基化修饰有关[6]。在20 kD至11 kD处的蛋白分别为H3(理论分子量为17 kD)、H2A、H2B(理论分子量为14 kD)和H4(理论分子量为12 kD)。
3不同来源组蛋白致巨噬细胞活力下降
3.1MTT实验结果 His-H3/H4、RAW264.7及293F细胞来源的组蛋白可明显降低巨噬细胞活力(P<0.05),并且刺激浓度越高,对细胞活力影响越大。GST-H3/H4对巨噬细胞活力影响不明显(P>0.05),见图3。

Figure 2. Recombinant histones expressed by prokaryotic plasmids and histones extracted from eukaryotic cells. A: recombinant histones expressed by prokaryotic plasmids.M:protein marker; 1: His-H3; 2: His-H4; 3: GST-H3; 4: GST-H4. B: histones extracted from eukaryote cells: M: protein marker; 1:histones extracted from RAW264.7 cells;2:histones extracted from 293F cells.
图2原核表达的组蛋白和真核细胞提取的组蛋白

Figure 3. Effects of histones on macrophage viability detected by MTT. Mean±SD.n=15.*P<0.05vscontrol group (0 mg/L).
图3MTT实验检测组蛋白对巨噬细胞活力的影响
3.2流式细胞术结果 由图4可见,组蛋白能诱导细胞发生晚期凋亡和坏死,结果与MTT实验结果一致。对照组的细胞即正常细胞绝大多数处于第三象限;随着His-H3刺激浓度的增加,第二象限即晚期凋亡或坏死细胞的数目增加,当His-H3的刺激浓度达到50 mg/L时,该象限细胞的比例达到65.0%(P<0.05)。

Figure 4. Effect of His-H3 on RAW264.7 cell apoptosis and necrosis.
图4His-H3对RAW264.7细胞凋亡和坏死的影响
4组蛋白对RAW264.7细胞释放炎症因子的影响
由图5可见,无论是原核来源的重组组蛋白还是真核细胞来源的组蛋白均能刺激RAW264.7细胞释放炎症因子TNF-α和IL-6。不同来源的组蛋白刺激细胞释放的IL-6程度不同,GST-H3、GST-H4刺激RAW264.7细胞后释放IL-6的水平较高。不同来源的组蛋白均可刺激RAW264.7细胞释放较高水平的TNF-α。由于单独使用GST蛋白对诱导RAW264.7细胞释放TNFα和IL-6的作用不明显,所以GST-H3和GST-H4刺激RAW264.7细胞释放炎症细胞因子的作用主要来源于组蛋白。
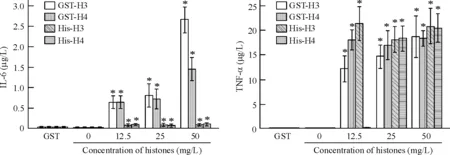
Figure 5. Effects of histones on the releases of IL-6 and TNF-α by RAW264.7 cells. Mean±SD.n=3.*P<0.05vscontrol group (0 mg/L).
图5组蛋白对RAW264.7细胞释放IL-6和TNF-α的影响
讨 论
目前用于蛋白质的表达系统主要分为原核表达和真核表达系统。由于原核表达系统的蛋白表达周期短,表达量高而成为研究者首选的方法。本实验中,我们利用原核表达系统表达了带His和GST标签的H3和H4,获得了GST-H3、GST-H4、His-H3和His-H4融合蛋白。其中,GST-H3和GST-H4的可溶性好,纯度高;His-H3和His-H4主要以包涵体形式出现,应用包涵体蛋白纯化方法进行纯化也获得了成功。
由于原核表达系统是利用大肠杆菌表达蛋白质,大肠杆菌内没有如真核细胞中相应的修饰酶,蛋白质的活性特别是蛋白质的修饰如糖基化、磷酸化和甲基化等可能受到影响。因此,根据研究的目标还需要真核来源的蛋白质。由于组蛋白在真核细胞的含量丰富,因而从真核细胞中提取组蛋白也成为获取组蛋白的方法之一。从真核细胞里提取组蛋白的方法主要有2种,酸性提取法和高盐提取法[6]。酸性提取法的基本原理是基于在强酸环境下,大多数核蛋白和核酸都可以沉淀[8]。自1983年组蛋白酸提取法[9]首次被提出以来,研究者结合其它一些技术方法如Western blotting、质谱等技术研究组蛋白及其修饰。但是也有一些组蛋白修饰具有酸不稳定性,即酸性环境会破坏某些组蛋白修饰[10]。所以后来又发展了高盐提取法。该方法的主要优势有:首先,是在整个提取过程中保持中性pH值,所以可保留有酸不稳定性的组蛋白修饰;其次,盐提取法获取的组蛋白得率比酸提取法高;第三,可差异分离各种组蛋白。本实验采用了盐提取法主要是为了保留组蛋白的修饰,使组蛋白更接近生理状态。
在接下来观察组蛋白对巨噬细胞活力影响的实验中发现,无论是原核还是真核来源的组蛋白对巨噬细胞的活力都有不同程度的影响,MTT实验和流式细胞实验的结果一致。带GST标签的H3和H4对细胞活力影响不明显,可能与GST对细胞有保护作用有关[11],具体机制尚有待进一步实验探索。尽管带GST标签的H3、H4对细胞活力影响不明显,但是后续的实验发现GST-H3/H4刺激巨噬细胞释放炎性细胞因子的作用非常显著,提示组蛋白至少可能通过影响细胞活力和促进细胞因子释放2个环节参与炎症反应过程。据报道,脓毒血症过程中血液中组蛋白浓度急剧升高[5, 12]。尽管目前对这些组蛋白的来源尚无定论[13],显然,血液循环中的组蛋白通过对巨噬细胞的影响参与了脓毒血症过程中放大(失控)的炎症反应过程。
总之,本实验不仅获得了原核表达的组蛋白,而且从真核细胞中成功提取了组蛋白,这为以后大量获取组蛋白提供了经验,并为进一步研究组蛋白的调控机制奠定了基础。本研究结果还表明,细胞外的组蛋白可能通过促进巨噬细胞释放炎症细胞因子参与了放大脓毒症炎症反应过程,是治疗脓毒症潜在的药物靶点。本研究结果为进一步探索组蛋白的作用机制打下了基础。
[1] 李明岳,余小舫,鲍世韵,等.小鼠不同细胞间表观遗传修饰的变化对Pdx-1基因转录表达的影响[J]. 中国病理生理杂志,2010,26(4):786-790.
[2] Huang Y, Min S, Lui Y, et al. Global mapping of H3K4me3 and H3K27me3 reveals chromatin state-based regulation of human monocyte-derived dendritic cells in different environments[J]. Genes Immun, 2012, 13(4):311-320.
[3] Berger SL. The complex language of chromatin regulation during transcription[J]. Nature, 2007, 447(7143):407-412.
[4] Li B, Carey M, Workman JL. The role of chromatin during transcription[J]. Cell, 2007, 128(4):707-719.
[5] Xu J, Zhang X, Pelayo R, et al. Extracellular histones are major mediators of death in sepsis[J]. Nat Med, 2009, 15(11):1318-1321.
[6] Shechter D, Dormann HL, Allis CD, et al. Extraction, purification and analysis of histones[J]. Nat Protoc, 2007, 2(6):1445-1457.
[7] 刘靖华,李志杰,唐 靖,等.高迁移率族蛋白1诱导内皮细胞释放细胞因子的作用及其与脂多糖对白细胞介素6释放的协同效应[J]. 中华医学杂志,2006,86(17):1191-1195.
[8] Murray K. The acid extraction of histones from calf thymus deoxyribonucleoprotein[J]. J Mol Biol, 1966, 15(2):409-419.
[9] Gurley LR, Prentice DA, Valdez JG, et al. High-performance liquid chromatography of chromatin histones[J]. J Chromatogr, 1983, 266:609-627.
[10] Chen CC, Smith DL, Bruegger BB, et al. Occurrence and distribution of acid-labile histone phosphates in regenerating rat liver[J]. Biochemistry, 1974, 13(18):3785-3789.
[11] 赵翠香,张丽娟,龙 云,等. GST对转染APP695基因PC12细胞形态和增殖能力的影响[J]. 神经解剖学杂志,2011,27(4):399-403.
[12] Chaput C, Zychlinsky A. Sepsis: the dark side of histones[J]. Nat Med, 2009, 15(11):1245-1246.
[13] Kaplan MJ, Radic M. Neutrophil extracellular traps: double-edged swords of innate immunity[J]. J Immunol, 2012, 189(6):2689-2695.
讣告
中国病理生理学会第四届理事,第五届、六届、七届常务理事,第五届实验血液学专业委员会主任委员,实验血液学杂志主编,我国著名实验血液学家,原中国军事医学科学院副院长唐佩弦教授,因病于2013年4月12日去世,享年83岁。
唐佩弦教授为我国病理生理学事业的发展和学会的建设,特别是实验血液学专业委员会和《中国实验血液学杂志》的创建和发展做出了重大的贡献。
中国病理生理学会在唐佩弦教授的追悼会上敬献了花圈,以寄托我们的哀思。唐佩弦教授会永远铭刻在我们心中。
中国病理生理学会
2013年4月16日
Preparationofhistonesandtheireffectsonmacrophages
FU Xiao-xia, YE Ping, LI Xue, ZHONG Yu-yun, CUI Hang, CHEN Xiao-huan, CAI Jun-wei, JIANG Yong, LIU Jing-hua
(GuangdongProvincialKeyLaboratoryofFunctionalProteomics,DepartmentofPathophysiology,BasicMedicalCollege,SouthernMedicalUniversity,Guangzhou510515,China.E-mail:liujhua@fimmu.com;jiang48231@163.com)
AIM: To prepare histones with different methods and to observe their effects on cell viability and cytokine release by macrophagesinvitro.METHODSProkaryotic expression plasmids of histone H3 and histone H4 were constructed by cloning methods. The histones containing GST-tag or His-tag (GST-H3, GST-H3, His-H3, His-H4) were expressed and purified. The histones from eukaryotic cells (RAW264.7 and 293F cells) were extracted with the high salt method. RAW264.7 cells were treated with histones (7.5~50 mg/L) for 4 h and the cell vitality was examined by MTT assay and flow cytometry. The concentrations of IL-6 and TNF-α in the culture supernatants of RAW264.7 cells treated with histones were also detected.RESULTSHis-H3/H4 and the histones from eukaryotic cells significantly reduced the viability of RAW264.7 cells and induced apoptosis. The effects of histones from different sources on the releases of IL-6 and TNF-α were different.CONCLUSIONHis-H3/His-H4 expressed by prokaryotic plasmids and the histones extracted from eukaryotic cells affect the vitality of macrophages as well as induce late apoptosis and necrosis. Histone may involve in the inflammatory process by promoting the release of inflammatory cytokines.
Prokaryotic protein expression; Histones; Macrophages
Q256
A
10.3969/j.issn.1000- 4718.2013.05.020
1000- 4718(2013)05- 0883- 06
2013- 03- 15
2013- 04- 02
国家重点基础研究发展计划(973计划)项目(No. 2010CB529704);国家自然科学基金资助项目(No. 81272149;No.81072425)
△通讯作者 刘靖华 Tel: 020-61648172-810; E-mail: liujhua@fimmu.com; 姜勇 Tel: 020-61648231; E-mail: jiang48231@163.com
