重组人血管内皮抑素对人多发性骨髓瘤细胞RPMI 8226 增殖和相关蛋白表达的影响*
2013-12-23张珑涓郭小娟
夏 盈, 郑 冬△, 张珑涓, 李 娟, 郭小娟
(中山大学附属第一医院1血液内科,2外科实验室,广东 广州510080)
多发性骨髓瘤目前尚未有治愈的方法,靶向药 物治疗是近年来研究的热点方向[1]。越来越多的证据证实其血管生成增加并在发病机制中起重要作用[2]。沙利度胺、雷利度胺等血管抑制药物在多发性骨髓瘤临床治疗中的成功应用启发了血管抑制药物作用于血液病肿瘤的新道路。重组人血管内皮抑素(recombined human endostatin)是一种新型有效的血管抑制剂,具体作用机制尚未明朗,国外大部分研究认为其仅作用于血管内皮细胞,通过促进内皮细胞凋亡[3-4]、抑制内皮细胞迁移[5]等抵抗新生血管生成,而对多种肿瘤细胞无明显促凋亡作用[4-5]。但亦有研究报道其可下调肿瘤细胞血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达[6]。恩度(Endostar)作为唯一上市的重组人血管内皮抑素,目前已成功应用于初治或复治的Ⅲ~Ⅳ期非小细胞肺癌患者的临床治疗,而在多发性骨髓瘤方面的研究较少,仅有个别报道其可在体外直接促进人骨髓瘤细胞CZ-1 凋亡[7]。本实验用恩度在体外直接作用于人多发性骨髓瘤细胞RPMI 8226,观察细胞增殖、凋亡、细胞周期及血管细胞黏附因子1(vascular cell adhesion molecule 1,VCAM-1)、白细胞介素6(interleukin 6,IL-6)和VEGF 表达的改变,以进一步研究重组人血管内皮抑素抗多发性骨髓瘤的作用。
材 料 和 方 法
1 细胞与试剂
人RPMI 8226 细胞株为中山大学附属第一医院血液科传代培养,RPMI-1640 空白培养基凯基和胎牛血清(Gibco);CCK8 试剂盒(日本同仁);总RNA 提取试剂RNAiso(TaKaRa);PCR 引物由速聚生物公司合成;SYBR Green qPCR SuperMix 购自Invitrogen;CST 蛋白电泳分子量标记(15 ~130 kD);兔抗人VCAM-1、IL-6 和VEGF 单克隆抗体购自Epitomics;兔抗人GAPDH、Bcl-2 单克隆抗体、兔抗人caspase-3多克隆抗体和山羊抗兔IgG 购自Santa Curz;IL-6 和VEGF 细胞因子ELISA 试剂盒购自凯基公司。恩度购自山东先声麦得津生物制药有限公司。
2 人多发性骨髓瘤细胞RPMI 8226 培养
以含10%胎牛血清、8 ×104U/L 青霉素和0.08 g/L 链霉素的RPMI-1640 培养基培养人RPMI 8226细胞于25 cm2悬浮细胞培养瓶,置37 ℃、5% CO2培养箱中培养,每2 ~3 d 待细胞生长至对数期传代1 次。
3 细胞增殖实验
待细胞生长至对数期,每孔2 ×104个细胞接种于96 孔板,以倍比稀释法加入0 mg/L、50 mg/L、100 mg/L、250 mg/L 和500 mg/L 恩度,于37 ℃、5% CO2培养箱中培养48 h 及72 h,每孔加入10 μL CCK8 试剂,37 ℃孵育4 h 后,用酶标仪于450 nm 波长处检测吸光度,每个浓度设3 个复孔。
4 细胞凋亡及周期实验
4.1 细胞凋亡检测 取对数期细胞以每孔5 ×105个细胞接种于6 孔板,加入0 mg/L、100 mg/L 和250 mg/L 恩度原液,37 ℃、5% CO2培养72 h,收集细胞并以PBS 洗涤2 次,以Annexin V/PI 双染法染色并立即用流式细胞仪检测细胞凋亡率。实验重复3次。
4.2 细胞周期检测 每孔2 ×105个对数期细胞接种于6 孔板,加入0 mg/L、100 mg/L 和250 mg/L 恩度原液,置37 ℃、5% CO2培养箱中培养72 h,收集细胞并以70% 乙醇固定过夜,800 r/min 离心3 min并以预冷PBS 洗涤3 次,以PI 染色法染色,用流式细胞术检测细胞周期变化。实验重复3 次。
5 实时定量PCR 实验
取对数期细胞,每孔1 ×106接种于6 孔板,加入0 mg/L 和100 mg/L 恩度原液,置37 ℃、5% CO2培养箱共同培养72 h,用以测定VCAM-1 mRNA 表达;同样条件细胞接种于6 孔板,每孔加入100 mg/L 恩度,分别于0、12、24、48 和72 h 收集细胞用以测定IL-6 和VEGF mRNA 表达;上述收集细胞以RNAiso提取总RNA,在BioPhotometer Plus 艾本德核酸蛋白测定仪上测定RNA 含量,1%琼脂糖凝胶电泳80V×20 min,凝胶成像系统显示清晰的5S rRNA,18S rRNA 和28S rRNA 条带,将RNA 反转录为cDNA 并进行扩增,VCAM-1、IL-6、VEGF 上下游引物见表1。用β-actin 表达量作为内参照,用ABI PRISM® 7500 Sequence Detection System 定量PCR 仪,实验重复3次。以对照组mRNA 所测表达量作为参照值,采用2-ΔΔCt方法精确各目的基因的相对表达量。
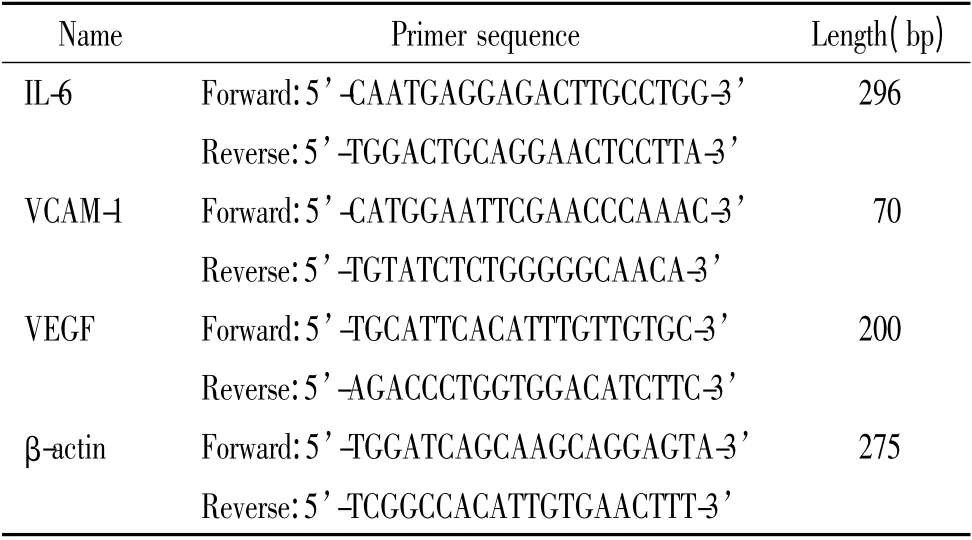
表1 实时定量PCR 目的片段引物Table 1. Primer sequences for real-time PCR
6 Western blotting 实验
以凯基全蛋白提取试剂盒说明书方法提取细胞RPMI 8226 细胞总蛋白,BCA 蛋白定量试剂盒定量后于-20 ℃保存,取含蛋白30 μg 的蛋白提取液上清进行聚丙烯酰胺凝胶电泳(SDS-PAGE,8%或12%分离胶),将分离后的蛋白质电转至PVDF 膜,5%脱脂奶粉封闭1 h,加入抗VCAM-1(1∶1 000)、抗IL-6(1∶800)、抗VEGF(1 ∶800)、抗Bcl-2 (1 ∶500)、抗GAPDH(1∶2 000)单克隆抗体和抗caspase-3(1∶500)多克隆抗体4 ℃孵育过夜,TBST 洗膜后以Ⅱ抗(1∶1 000 ~2 000)孵育1 h,TBST 洗膜后用ECL 法显示抗原-抗体复合物于暗室X 胶片曝光,扫描条带并用Quantity One 软件分析条带积分吸光度值(integrated absorbance,IA),以靶蛋白IA/GAPDH IA 的比值对比细胞内蛋白表达水平。
7 ELISA 实验
取对数期RPMI 8226 细胞以1 ×109/L 接种于6孔板,以恩度0 mg/L 和100 mg/L 分别作用于细胞36、48 和72 h,分别提取上清液以双抗夹心法检测各时点细胞上清液中IL-6 及VEGF 的分泌量。每个样本设3 个复孔。
8 统计学处理
采用SPSS 13.0 软件分析实验数据,数据用均数±标准差(mean ±SD)表示,两组间比较采用两独立样本t 检验,多组间比较采用单因素方差分析(Oneway ANOVA),多组间两两比较采用LSD-t 检验,以P<0.05 为差异有统计学意义。
结 果
1 恩度抑制RPMI 8226 细胞增殖並增加G1 期细胞比例
与空白组比较,50 mg/L、100 mg/L、250 mg/L 和500 mg/L 恩度作用于RPMI 8226 细胞48 h,增殖抑制率分别为(15.8 ±1.6)%、(16.1 ±3.0)%、(20.4±1.8)%和(18.8 ± 1.1)%(P <0.05)。72 h 增殖抑制率分别为(34. 4 ± 8. 4)%、(44. 8 ± 3. 4)%、(59.5 ± 5. 6)% 和(45. 3 ± 4. 7)% (P <0. 05)。0 mg/L、100 mg/L 和250 mg/L 恩度作用于RPMI 8226 细胞72 h 后G1期细胞比例分别为(59.8 ±0.5)%、(63.5 ±0.2)%和(64.4 ±0.2)%(P <0.05),见图1。
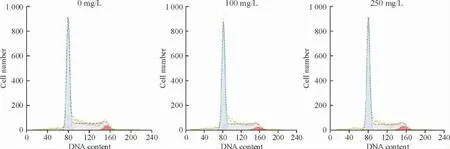
Figure 1. The effect of 0 mg/L,100 mg/L and 250 mg/L endostar on proportion of G1 phase of RPMI 8226 cells after 72 h.图1 恩度对RPMI 8226 细胞细胞周期的影响
2 恩度对RPMI 8226 细胞凋亡无明显影响
如图2 所示,0 mg/L、100 mg/L 和250 mg/L 恩度作用于RPMI 8226 细胞72 h,各组细胞凋亡率分别为(6. 5 ± 1. 2)%、(5. 9 ± 0. 4)% 和(6. 3 ±0.4)%,差异无统计学意义(P >0.05)。
用100 mg/L 恩度作用RPMI 8226 细胞6、12、24、48 和72 h,Bcl-2 及caspase-3 蛋白表达差异无统计学意义(均P >0.05),见图3。
3 恩度抑制RPMI 8226 细胞表达VCAM-1
3.1 VCAM-1 mRNA 表达变化 如图4 所示,100 mg/L 恩度作用于RPMI 8226 细胞72 h 后,VCAM-1 mRNA 较未加药组下降55%(P <0.05)。
3.2 VCAM-1 蛋白表达变化 100 mg/L 恩度作用于RPMI 8226 细胞后0、6、12、24、48 和72 h,VCAM-1 蛋白表达结果见图5,72 h 较0 h 蛋白表达下降50.12%(P <0.05)。
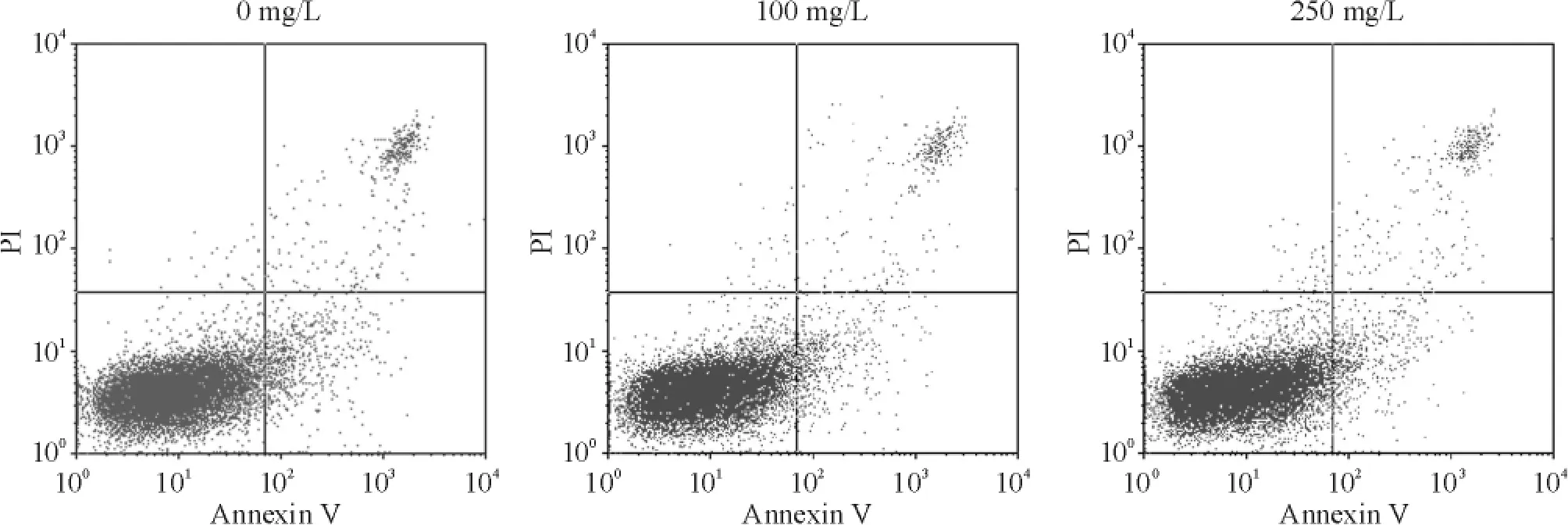
Figure 2. The effect of 0 mg/L,100 mg/L and 250 mg/L Endostar on apoptosis of RPMI 8226 cells after 72 h.图2 恩度对RPMI 8226 细胞凋亡率的影响
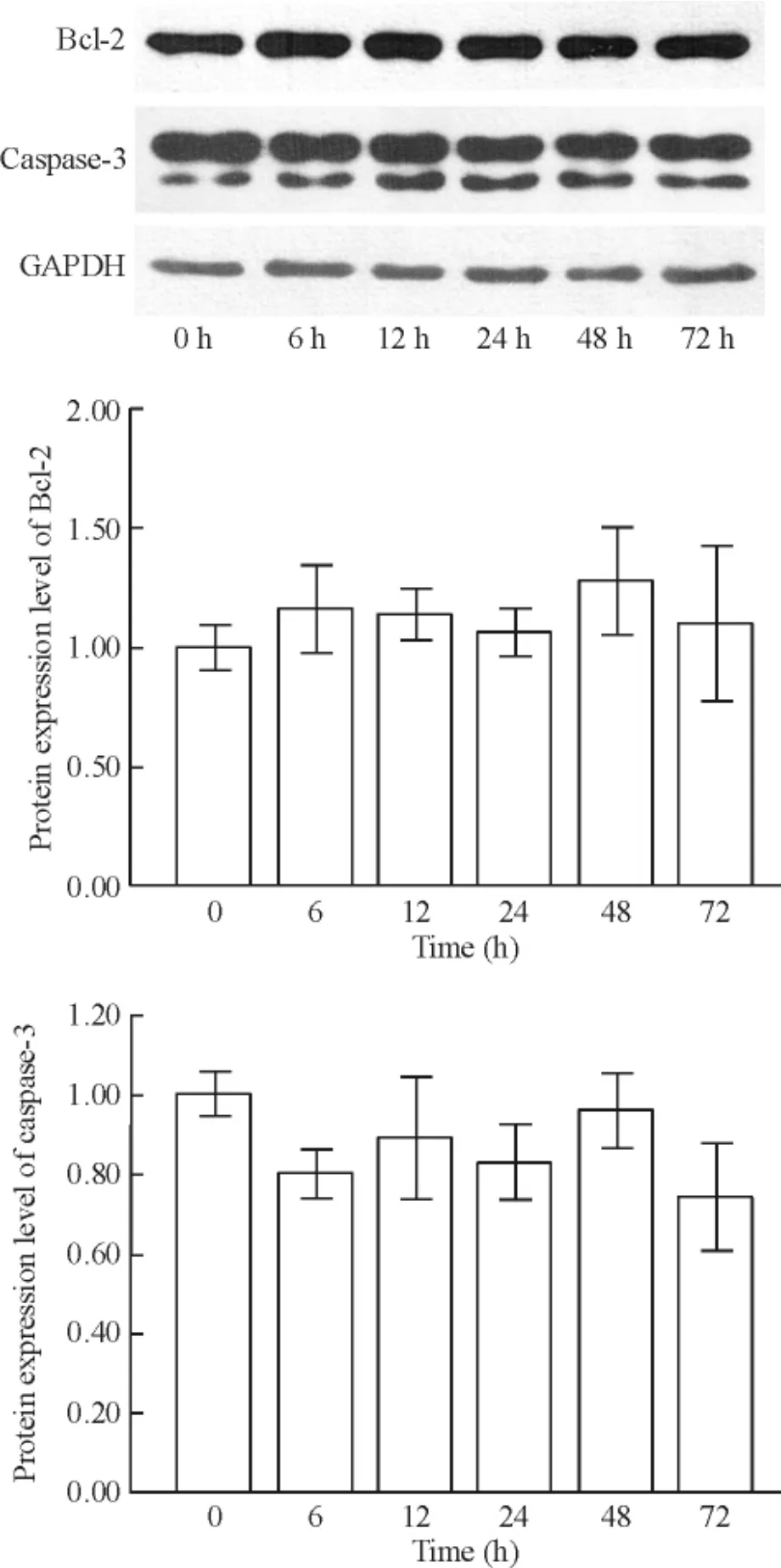
Figure 3. The effect of 100 mg/L Endostar on the protein expression of Bcl-2 and caspase-3. Mean±SD. n=18.图3 恩度对RPMI 8226 细胞Bcl-2 和caspase-3 表达的影响
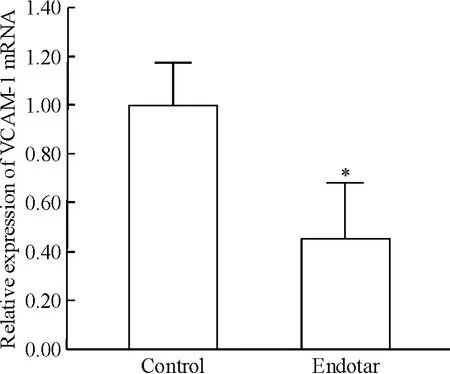
Figure 4. The effect of 100 mg/L Endostar on the mRNA expression of VCAM-1 after 72 h. Mean ±SD. n =6. * P <0.05 vs control.图4 恩度对RPMI 8226 细胞VCAM-1 mRNA 表达的影响

Figure 5. The effect of 100 mg/L Endostar on the protein expression of VCAM-1. Mean±SD. n=18. * P <0.05 vs control.图5 恩度对RPMI 8226 细胞VCAM-1 表达的影响
4 恩度抑制RPMI 8226 细胞IL-6 及VEGF 表达
4.1 IL-6 及VEGF mRNA 表达变化 100 mg/L 恩度作用于RPMI 8226 细胞后IL-6 和VEGF mRNA 变化结果见图6。12、24、48 和72 h IL-6 mRNA 分别下降65%、88%、61%和40%,与对照组比差异有统计学意义(均P <0.05)。作用12 和24 h,VEGF mRNA 分别较对照组下降79%和87%,差异有统计学意义(均P <0.05);作用48 和72 h,VEGF mRNA较对照组无明显下降(均P >0.05)。

Figure 6. The effect of 100 mg/L Endostar on the mRNA expression of IL-6(A)and VEGF(B). Mean ± SD. n =15. * P <0.05 vs control.图6 恩度对RPMI 8226 细胞IL-6 和VEGF mRNA 表达的影响
4.2 IL-6 和VEGF 胞内蛋白表达变化 结果如图7所示,100 mg/L 恩度作用于RPMI 8226 细胞18 h,较未加药组IL-6 蛋白表达显著降低31.90% (P <0.05),100 mg/L 恩度作用于RPMI 8226 细胞48 h,较未加药组VEGF 蛋白表达显著下降31.50%(P <0.05)。

Figure 7. The effect of 100mg/L Endostar on protein expression of IL-6(A)after 18 h and of VEGF(B)after 48 h.Mean±SD. n=6. * P <0.05 vs control.图7 恩度对RPMI 8226 细胞IL-6 和VEGF 蛋白表达的影响
4.3 细胞上清中IL-6 和VEGF 分泌量的变化 如图8 所示,100 mg/L 恩度作用于RPMI 8226 细胞36、48 和72 h,较未加药组IL-6 分泌量分别下降34.42%、43.65%和10.63%(均P <0.05),36 和48 h VEGF 分泌量分别下降18.71%和23.22%(均P <0.05),72 h VEGF 分泌量较对照组无明显差异(P >0.05)。
讨 论
本实验发现,恩度在体外对人多发性骨髓瘤细胞RPMI 8226 的增殖有直接抑制作用,250 mg/L以内增殖抑制率呈时间依赖性和浓度依赖性,250 mg/L恩度作用于RPMI 8226 72 h 达最高抑制率(59.5 ±5.6)%(P <0.05),提示其在体外有抗多发性骨髓瘤增殖的作用,直接作用于肿瘤细胞为其作用机制之一。本实验以0 mg/L、100 mg/L 和250 mg/L 恩度刺激RPMI 8226 细胞72 h,凋亡率差异无统计学意义。Western blotting 验证100 mg/L 恩度作用于RPMI 8226 细胞6、12、24、48 和72 h 后,凋亡抑制蛋白Bcl-2 和促凋亡蛋白caspase-3 在各时点表达无明显改变,即本实验在细胞功能实验及蛋白水平均未检测到凋亡相关变化,提示恩度对RPMI8226细胞凋亡无明显影响。国内有文献报道恩度可以促使骨髓瘤细胞株CZ-1 凋亡[7],CZ-1 是2002 年由国内学者建立的分泌单克隆λ 轻链的人骨髓瘤细胞株,RPMI 8226 细胞于1966 年由Matswoka 建立,2 株骨髓瘤细胞的生物学特性、免疫表型不尽相同[8],可能导致了它们对同一种药物的促凋亡作用产生不同的敏感性。实验同时发现恩度有阻滞细胞于G1期的趋势,0 mg/L、100 mg/L、250 mg/L 恩度作用细胞72 h,检测G1期比例分别为(59.8 ±0.5)%、(63.5±0.2)%和(64.4 ±0.2)%(P <0.05),因观察到的阻滞作用较小,推论其抑制RPMI 8226 细胞增殖可能与改变细胞周期、阻滞细胞于G1期相关,但阻滞作用有限。

Figure 8. The effect of 100 mg/L Endostar on the secretion of IL-6(A)and VEGF(B). Mean±SD. n=18. * P <0.05 vs control.图8 恩度对RPMI 8226 细胞IL-6 和VEGF 分泌的影响
IL-6 也被称为B 细胞分化因子或浆细胞瘤生长因子,其可刺激活化B 细胞向浆细胞的分化及免疫球蛋白的分泌[9],又能促进骨髓瘤细胞增殖[10],被认为在骨髓瘤发病机制中起着至关重要的作用。VEGF 与IL-6 在多发性骨髓瘤发病机制中相辅相成,IL-6 可刺激浆细胞分泌VEGF[13],而VEGF 一方面促进骨髓微环境血管生成[11],另一方面又直接促进骨髓瘤细胞增殖和迁移[12]。现已证实IL-6 和VEGF 不仅可以由骨髓基质细胞旁分泌产生而作用于骨髓瘤细胞,亦可由骨髓瘤细胞自分泌产生,自分泌细胞因子为多发性骨髓瘤疾病发生机制的一个重要环节,其可诱导骨髓瘤细胞和骨髓基质细胞相互刺激进一步导致肿瘤相关细胞因子的循环分泌[13]。本实验证实RPMI 8226 细胞可以分泌IL-6 及VEGF。实验结果表明,恩度可以抑制RPMI 8226 细胞分泌IL-6 及VEGF,100 mg/L 恩度作用于RPMI 8226 细胞24 h 后,IL-6 和VEGF mRNA 水平下降均达到最大值,分别为88%和87%(均P <0.05)。以未加药组培养相同时间做对照,从作用18 h 开始可以观察到细胞内IL-6 蛋白表达较对照组减低,达31.90%(P <0.05),48 h 后观察到VEGF 蛋白表达较未加药组减低31.50%(P <0.05)。2 种细胞因子均在36 h后较未加药组减低(P <0.05)。其中恩度对VEGF mRNA 水平抑制作用时间短暂,24 h 后表达水平迅速回升,而胞内蛋白表达及细胞外分泌在48 h 时仍观察到表达抑制现象,但抑制作用较弱,考虑一方面VEGF 蛋白水平表达可能较mRNA 水平延迟,另一方面mRNA 表达迅速回升可能是限制恩度作用于细胞蛋白水平的原因。
VCAM-1 在多发性骨髓瘤患者血清中表达升高[14],是骨髓微环境中起重要作用的黏附分子,多项研究证实其可促进骨髓瘤细胞与骨髓基质细胞的紧密结合[15-17],并进一步刺激骨髓基质细胞分泌IL-6[16-17]。本实验发现恩度亦能在mRNA 及蛋白水平下调RPMI 8226 细胞VCAM-1 的表达,100 mg/L 恩度作用于细胞72 h VCAM-1 mRNA 较对照组下降55%(P <0.05),72 h 胞内蛋白表达量较0h 下降50.12%(P <0.05)。提示抑制细胞黏附因子表达亦为恩度直接作用于多发性骨髓瘤细胞产生抗骨髓瘤作用机制中的重要环节之一。
上述结果表明恩度在体外可直接作用于人多发性骨髓瘤细胞RPMI 8226,对其产生增殖抑制、周期改变和下调VCAM-1 及IL-6、VEGF 表达的作用,由此推断其可影响多发性骨髓瘤细胞与骨髓基质细胞相互作用,具有抗多发性骨髓瘤的潜力。恩度作为以针对血管内皮细胞作用为主的血管生成抑制剂,其抗多发性骨髓瘤作用尚需在骨髓微环境及与骨髓瘤细胞的相互作用中得到进一步阐述。恩度对多发性骨髓瘤骨髓微环境的作用尚缺乏相关文献报道,其潜在抗多发性骨髓瘤作用及其机制有待于深入研究。
[1] 郑 冬,袁 梅,李 娟,等. 硼替佐米对多发性骨髓瘤细胞乙酰肝素酶表达及迁移能力的影响[J]. 中国病理生理杂志,2011,27(5):865-868.
[2] Jakob C,Sterz J,Zavrski I,et al. Angiogenesis in multiple myeloma[J]. Eur J Cancer,2006,42(11):1581-1590.
[3] Dixelius J,Larsson H,Sasaki T,et al. Endostatin-induced tyrosine kinase signaling through the Shb adaptor protein regulates endothelial cell apoptosis[J]. Blood,2000,95(11):3403-3411.
[4] Dhanabal M,Ramchandran R,Waterman MJ,et al. Endostatin induces endothelial cell apoptosis[J]. J Biol Chem,1999,274(17):11721-11726.
[5] Yamaguchi N,Anand-Apte B,Lee M,et al. Endostatin inhibits VEGF-induced endothelial cell migration and tumor growth independently of zinc binding[J]. EMBO J,1999,18(16):4414-4423.
[6] Hajitou A,Grignet C,Devy L,et al. The antitumoral effect of endostatin and angiostatin is associated with a down-regulation of vascular endothelial growth factor expression in tumor cells[J]. FASEB J,2002,16(13):1802-1804.
[7] 冯 茹,黄晓军. 重组人血管内皮抑素体外抗多发性骨髓瘤的初步研究[J]. 中国实验血液学杂志,2010,18(3):102-106.
[8] 汤丽苑,徐 钰,陈 瑾,等. 人多发性骨髓瘤RPMI 8226 细胞条件培养液诱导破骨前体细胞的分化成熟[J]. 中国病理生理杂志,2012,28(4):649-654.
[9] Kishimoto T. The biology of interleukin-6[J]. Blood,1989,74(1):1-10.
[10]Hitzler JK,Martinez-Valdez H,Bergsagel DB,et al. Role of interleukin-6 in the proliferation of human multiple myeloma cell lines OCI-My 1 to 7 established from patients with advanced stage of the disease[J]. Blood,1991,78(8):1996-2004.
[11]Vacca A,Ribatti D. Bone marrow angiogenesis in multiple myeloma[J]. Leukemia,2005,20(2):193-199.
[12]Podar K,Tai YT,Davies FE,et al. Vascular endothelial growth factor triggers signaling cascades mediating multiple myeloma cell growth and migration[J]. Blood,2001,98(2):428-435.
[13] Dankbar B,Padro T,Leo R,et al. Vascular endothelial growth factor and interleukin-6 in paracrine tumor-stromal cell interactions in multiple myeloma[J]. Blood,2000,95(8):2630-2636.
[14]刘增艳,陆 化,刘 澎,等. 多发性骨髓瘤患者血管细胞间黏附分子VCAM-1 的表达及其意义[J]. 中国实验血液学杂志,2009,17(2):382-384.
[15]Mori Y,Shimizu N,Dallas M,et al. Anti-α4 integrin antibody suppresses the development of multiple myeloma and associated osteoclastic osteolysis[J]. Blood,2004,104(7):2149-2154.
[16]Hideshima T,Chauhan D,Schlossman R,et al. The role of tumor necrosis factor alpha in the pathophysiology of human multiple myeloma:therapeutic applications[J]. Oncogene,2001,20(33):4519-4527.
[17]Uchiyama H,Barut BA,Mohrbacher AF,et al. Adhesion of human myeloma-derived cell lines to bone marrow stromal cells stimulates interleukin-6 secretion[J]. Blood,1993,82(12):3712-3720.
