宫颈癌组织APOBEC3A蛋白的表达与高危型HPV感染的相关性研究*
2013-10-24秦君璞郑婷婷张帝开
陈 姗, 狄 娜, 秦君璞, 郑婷婷, 李 丹, 周 莉, 张帝开△
(1中山大学附属第六医院妇产科,广东 广州 510655; 2中山大学附属第二医院妇产科,广东 广州 510120 )
宫颈癌组织APOBEC3A蛋白的表达与高危型HPV感染的相关性研究*
陈 姗1, 狄 娜2, 秦君璞1, 郑婷婷1, 李 丹1, 周 莉1, 张帝开1△
(1中山大学附属第六医院妇产科,广东 广州 510655;2中山大学附属第二医院妇产科,广东 广州 510120 )
目的探讨宫颈癌组织中载脂蛋白 B mRNA 编辑酶催化多肽样蛋白3A(APOBEC3A)表达与高危型人乳头瘤病毒(HPV)感染的关系。方法采用免疫组化法检测26例宫颈癌、27例宫颈上皮内瘤变(CIN)I~III和22例正常宫颈组织APOBEC3A蛋白的表达,同时使用凯普分型检测试剂盒对3组样品分别进行高危HPV16/HPV18分型检测。以脂质体法转染APOBEC3A质粒进入HeLa细胞,RT-qPCR与Western blotting验证APOBEC3A对高危型HPV18 E6 mRNA以及蛋白表达的影响。结果宫颈癌组织、CIN组织以及正常宫颈组织中APOBEC3A蛋白表达的阳性率分别为46.2%、92.6%和86.4%,宫颈癌组织中APOBEC3A蛋白表达较正常宫颈组织明显下降(P<0.01)。宫颈癌组织、CIN及正常宫颈组织中HPV16感染阳性率分别为92.3%、77.8%和54.5%; HPV18感染阳性率分别为80.8%、51.8%和68.2%;APOBEC3A蛋白表达与HPV18感染阳性率呈负相关(P<0.05)。增加HeLa细胞中APOBEC3A的表达明显降低了HPV18 E6 mRNA以及蛋白的表达。结论在宫颈癌组织中APOBEC3A高表达可以对抗HPV18感染,并抑制HPV18 E6的转录和表达。
载脂蛋白B mRNA编辑酶催化多肽样蛋白3A; 人乳头状瘤病毒; 宫颈肿瘤
载脂蛋白B mRNA编辑酶催化多肽样蛋白(apolipoprotein B mRNA-editing catalytic polypeptide-like protein,APOBEC)是哺乳动物所特有的胞嘧啶脱氨酶,是一种内源性抗病毒蛋白。至今为止发现人来源的APOBEC家族成员包括APOBEC1、APOBEC2、AID(activation-induced deaminase)、APOBEC3A、APOBEC3B、APOBEC3C、APOBEC3DE、APOBEC3F、APOBEC3H和APOBEC4[1]。APOBEC家族蛋白对多种病毒具有抑制或超突变作用,包括人免疫缺陷病毒(human immunodeficiency virus,HIV)[2]、猿猴免疫缺陷病毒(simian immunodeficiency virus,SIV)[3]、泡沫病毒(foamy virus,FV)[4]、乙型肝炎病毒(hepatitis B virus, HBV)[5]以及腺相关病毒(adeno-associated virus,AAV)[6]等多种病毒。 最近研究还发现APOBEC3A、APOBEC3C和APOBEC3H对人乳头瘤病毒(human papilloma viruse,HPV) DNA具有高突变的编辑作用[7]。而高危型HPV的持续性感染是宫颈癌发生发展的必然因素[8],其中高危型HPV16和HPV18的感染率在宫颈癌病例中占70.1%[9]。高危型HPV E6致癌基因在宫颈癌的发生发展中起着非常重要的作用,它通过与抑癌基因p53作用而抑制细胞凋亡[10],使宫颈上皮细胞永生化最终发展成为恶性肿瘤。本研究在宫颈癌、癌前病变和正常宫颈组织中通过免疫组化法检测APOBEC3A蛋白的表达,高危分型试剂盒检测HPV16和HPV18感染的情况,初步探讨APOBEC3A与HPV16/18感染的关系;再构建APOBEC3A质粒,转染宫颈癌HeLa细胞株,观察APOBEC3A对HPV18 E6表达的影响。
材 料 和 方 法
1病人资料
收集2008年~2012年中山大学附属第六医院住院初治的宫颈癌患者26例(宫颈癌组)、宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)I~III患者27例(CIN组)和正常宫颈患者22例(正常宫颈组),标本予石蜡包埋,均经病理组织学明确诊断。(1)宫颈癌组:患者年龄34~70岁,中位年龄51岁。分期采用国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO) 2009年临床分期标准。入组标准:我院初治,病理确诊为宫颈癌;IA~IIB;在我院接受广泛全子宫切除+盆腔淋巴结清除术;术前未经放疗、化疗或生物免疫治疗;无合并或继发第2癌。(2)CIN组:年龄26~52岁,中位年龄39岁,为同期在我院因CIN行宫颈锥切术的患者。(3)正常宫颈组:年龄29~50岁,中位年龄41岁,为同期因子宫肌瘤在我院行全子宫切除术的患者,术后病理确诊宫颈无病变。
2载体、菌株和细胞株
含有APOBEC3A ORF的质粒(命名为A3A质粒)以及对照空质粒M45由复能基因公司提供。HeLa细胞株购自中国社科院细胞库,大肠杆菌株DH5α购自大连TaKaRa公司。
3主要试剂
抗APOBEC3A多抗Anti-PHO1 antibody (ab38641)购自Abcam,II抗山羊抗兔IgG抗体-辣根过氧化酶多聚体购自北京中杉金桥生物有限公司。HPV基因分型检测试剂盒购自中国凯普生物科技有限公司。 RNA 提取试剂 TRIzol 和细胞培养基DMEM 购自 Gibco, Lipofectamine® LTX and Plus Reagents试剂盒以及逆转录酶 M-MLV购自lnvitrogen, Power SYBR Green PCR Master Mix购自Life Technologies。鼠抗HPV16 E6+HPV18 E6单克隆IgG抗体(sc-460)购自Santa Cruz,兔抗APOBEC3A多克隆IgG抗体(ab38641) 购自Abcam,β-actin抗体购自PTG,羊抗鼠IRDye800 II抗和羊抗兔IRDye680 II抗购自LI-COR,T-PER 蛋白提取试剂购自Thermo。
4主要方法
4.1宫颈组织APOBEC3A蛋白检测 75例患者的存档蜡块切片4 mm采用免疫组化非生物素二步法检测。用微波炉柠檬酸液pH 6.0修复抗原,I抗工作浓度为1∶40,II抗工作浓度为1∶100,DAB显色,苏木精复染,用PBS代替I抗作阴性对照。
4.2免疫组化检测结果判断 所有切片采用盲法由2位病理科医生独立阅片,进行免疫组化半定量分析。 随机观察10个高倍视野,每个视野计数100个细胞,根据其中阳性细胞的比率和染色深度分别进行评估阳性细胞的比率评分:0分为阳性细胞数占总细胞数0~25%,1分为阳性细胞数占总细胞数26%~50%,2分为阳性细胞数占总细胞数51%~75%,3分为阳性细胞数占总细胞数76%~100%。染色深度评分:0 分为无染色,1分为淡黄色,3分为黄色至棕黄色,2分为染色强度介于1~3分之间。总积分=阳性细胞比率评分×染色强度评分。0~1分为阴性(-),2~3分为弱阳性(+),4~5分为中强阳性(++),6分为强阳性(+++)。以2分以上判定该标本为阳性表达,阳性率(%)=阳性表达的标本数/总标本数×100%。
4.3HPV分型检测 每个患者在手术前使用凯普试剂盒进行HPV分型检测, 步骤主要包括:HPV DNA提取、HPV PCR扩增、核酸分子快速导流杂交和显色HPV基因分型。操作和结果判读按试剂盒要求进行,检测宫颈细胞感染HPV16以及HPV18亚型的情况。
4.4细胞培养和转染 HeLa细胞在DMEM培养基 (含10%FBS)、37 ℃、5%CO2、100%相对湿度条件下常规培养。HeLa细胞转染A3A质粒作为实验组,转染M45空质粒作为对照组,使用Lipofectamine® LTX and Plus Reagents试剂盒进行转染HeLa细胞后继续培养,设定平行实验3个复孔。
4.5实时荧光定量PCR检测 转染后48 h,用TRIzol试剂分别提取实验组和对照组HeLa细胞的总RNA, 分光光度法测定计算总RNA含量及浓度,各取500 ng RNA, 按照逆转录酶M-MLV说明书进行逆转录, 再取等体积cDNA 模板,加入HPV18 E6引物或APOBEC3A引物以及SYBR Green荧光染料,在Rotor-Gene Q实时荧光定量PCR仪上进行半定量PCR分析,条件如下: 50 ℃ 2 min,95 ℃ 2 min,60 ℃ 30 s,40 个循环。以β-actin作为内参照。所用引物由上海英骏技术有限公司根据设计合成,见表1。
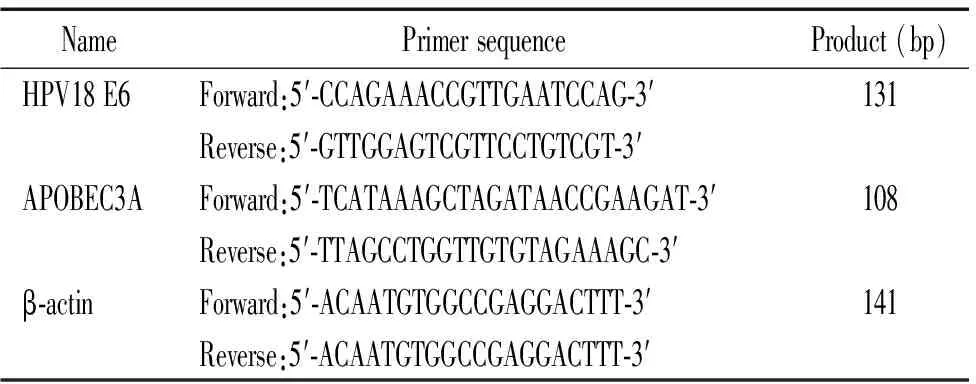
表1 引物序列
4.6蛋白印迹法(Western blotting)检测 在转染48 h后,分别用T-PER 蛋白提取法提取实验组、对照组和未处理组的细胞总蛋白, 测定蛋白浓度后取50 μg 蛋白上样, 用Western blotting 检测细胞中APOBEC3A、 HPV18 E6以及β-actin蛋白的表达量。具体方法如下:蛋白经 SDS-PAGE电泳80 V约 30 min,待溴酚蓝染料到达分离胶与积层胶交界处时,改以 120 V 电泳 40~60 min, 60 V电泳1.5 h转移至硝酸纤维膜(NC膜),3%脱脂奶37 ℃ 封闭1 h,I抗(1∶100) 4 ℃ 过夜, 相应II抗(1∶10 000) 37 ℃ 孵育1 h,NC 膜直接放在 LI-COR Odyssey 红外荧光扫描仪,按说明书进行图像双色分析,用相对灰度值表示蛋白相对含量。同时检测β-actin (1∶10 000)的表达作为内参照。
5统计学处理
结 果
1宫颈癌、CIN及正常宫颈组织中APOBEC3A蛋白的表达
APOBEC3A定位在胞核和部分细胞质。免疫组化法发现宫颈癌组织、CIN组织和正常宫颈组织中APOBEC3A蛋白阳性表达率分别为46.2%(12/26)、92.6%(25/27)和86.4%(19/22),3 组差异有统计学意义(P<0.01),见图1。宫颈癌组APOBEC3A阳性率显著低于其余2组,将3组进行两两比较,正常宫颈组与宫颈癌组比较差异有统计学意义(P<0.01),CIN组与宫颈癌组比较差异有统计学意义(P<0.01),见表2。

Figure 1. Representative images showing APOBEC3A expressions in cervical cancer, CIN and normal cervix (two-step non-biotin method).
图1宫颈癌、CIN及正常宫颈组织中APOBEC3A的表达
2宫颈癌、CIN及正常宫颈组织中HPV16和HPV18感染的情况
宫颈癌、CIN及正常宫颈组织中HPV16感染阳性率分别为92.3%(24/26)、77.8%(21/27)和54.5% (12/22),3 组差异有统计学意义(P<0.01)。HPV18感染阳性率分别为80.8%(21/26)、51.8%(14/27)和68.2% (15/22),各组HPV18感染阳性率差异无统计学意义(P>0.05),见表2。
表2在宫颈癌、CIN和正常宫颈组织中HPV16和HPV18感染情况以及APOBEC3A蛋白的表达
Table 2. The of HPV16 and HPV18 infection and the APOBEC3A expression in cervical cancer, CIN and normal cervix
**P<0.01vsnormal cervix;##P<0.01vsCIN.
3宫颈组织中APOBEC3A蛋白表达与HPV16或HPV18感染的相关性
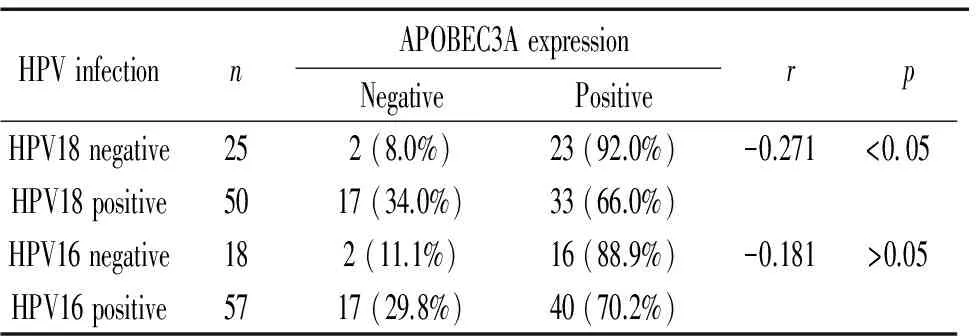
统计分析显示,宫颈癌组、CIN组与正常宫颈组中APOBEC3A蛋白表达与HPV16感染的相关性没有统计学意义(P>0.05);APOBEC3A蛋白表达与HPV18感染呈负相关(r=-0.271,P<0.05),见表3。
表3在宫颈组织中APOBEC3A蛋白表达与HPV16或HPV18感染的关系
Table 3. Relationship of APOBEC3A expression and the infection of HPV16 or HPV18 in cervical tissues
HPVinfectionnAPOBEC3AexpressionrpNegativePositiveHPV18negative252(8.0%)23(92.0%)-0.271<0 05HPV18positive5017(34.0%)33(66.0%)HPV16negative182(11.1%)16(88.9%)-0.181>0.05HPV16positive5717(29.8%)40(70.2%)
4A3A质粒转染HeLa细胞48h后HPV18E6mRNA的表达
用实时荧光定量PCR检测A3A质粒转染HeLa细胞前后HPV18 E6转录水平的变化。结果显示, 不同质量的A3A质粒(1 ng、10 ng、100 ng和1 000 ng)成功转染HeLa细胞后48 h, 实验组(A3A1ng、A3A10ng、A3A100ng和A3A1000ng)较对照组(control) HPV18 E6的mRNA表达均降低,但是并不呈现剂量相关性, A3A1000ng组的HPV18 E6 mRNA的表达较对照组明显减少,差异有统计学意义(P<0.05),见图2。
5A3A质粒转染HeLa细胞48h后HPV18E6蛋白的表达
Western blotting检测A3A质粒转染HeLa细胞48 h后HPV18 E6致癌蛋白和APOBEC3A蛋白表达的变化。实验组(A3A)转染A3A质粒1 μg,成功表达APOBEC3A蛋白,HPV18 E6致癌蛋白表达量较对照组(control)和未处理组(untransfected)显著减少,差异有统计学意义(P<0.05)。而对照组与未处理组细胞间蛋白表达无显著差异,见图3。
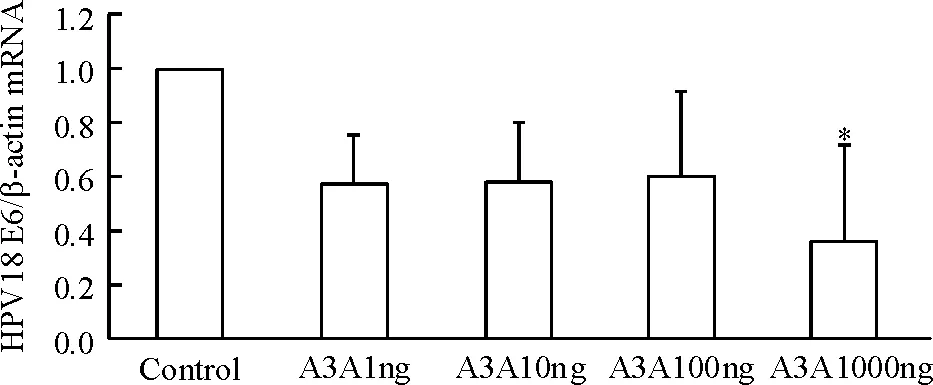
Figure 2. Effect of A3A plasimid transfection on mRNA expression of HPV18 E6 in HeLa cells.Mean±SD.n=3.*P<0.05vscontrol.
图2A3A质粒转染对HeLa细胞HPV18E6mRNA表达的影响
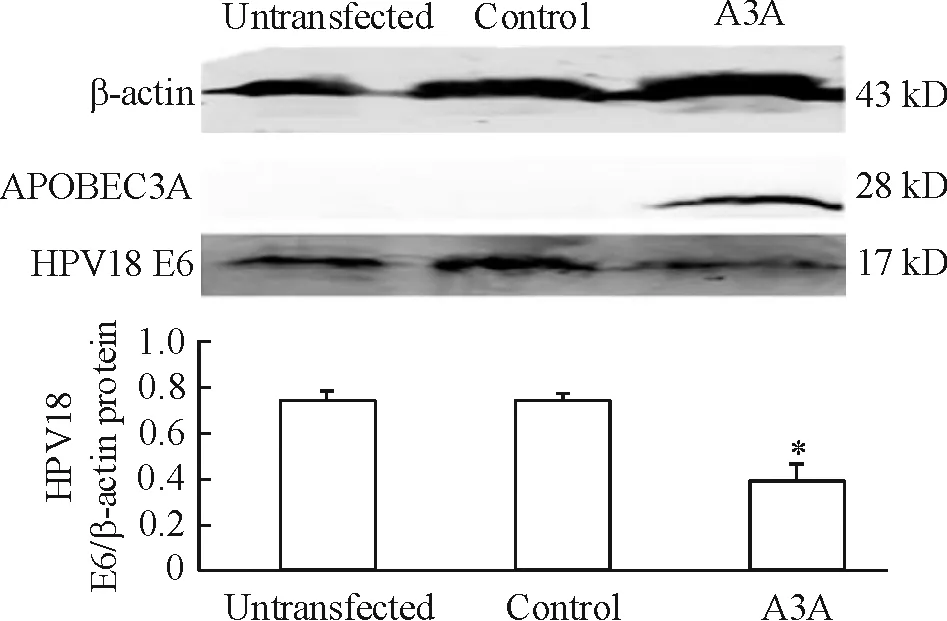
Figure 3. Effect of APOBEC3A overexpression on protein expression of HPV18 E6 in HeLa cells.Mean±SD.n=3.*P<0.05vsuntransfected.
图3A3A质粒转染HeLa细胞48h后APOBEC3A和HPV18E6蛋白水平的表达
讨 论
APOBEC 家族是近年来报道对多种病毒具有抑制活性的天然免疫分子,属于胞嘧啶脱氨酶家族。APOBEC 家族抗病毒功能可以通过至少 3 种途径发挥作用:DNA 编辑、RNA 编辑以及非编辑途径[11]。APOBEC 家族成员利用其胞苷脱氨酶活性,通过 DNA/RNA 编辑途径,一方面可通过尿嘧啶-DNA糖基化酶(uracil-DNA glycosylase,UNG)识别并去除尿嘧啶碱基 (U)[12],在负链上发生碱基缺失,最终发生降解;另一方面或可使病毒基因组正链上产生大量G到A高突变[13],最终产生终止密码子或无功能蛋白。
APOBEC 家族成员还可诱导病毒基因组超突变,为病毒的进化提供了促进因素,病毒基因组序列的变化会改变其表型,如逃避免疫识别获得抗药性、提高宿主适应能力、扩展宿主感染范围等等,与病毒的致病性、流行性及其进化都有着重要而紧密的联系[11-14],如具有对Oseltamivir抗药性的流感病毒,是基于其基因组上发生了单个C到 U 的突变[15-16],而C到 U 的超突变效应,可以由 APOBEC 或其它胞嘧啶脱氨酶家族成员的作用而实现。因此,APOBEC 蛋白在抑制病毒的同时,又促进了病毒的进化。
APOBEC3A是APOBEC家族中较新的成员之一,其基因位于人类 22 号染色体上, 全长13.24 kb, mRNA 全长1 390 bp, 其编码框为600 bp, 编码181个氨基酸。研究表明APOBEC3A具有编辑部分HPV基因组的作用[7],使HPV基因组突变频率增加。
关于APOBEC3A在宫颈癌组织中的表达鲜少见于报道。本研究通过免疫组化方法检测宫颈癌、CIN和正常宫颈组织中APOBEC3A蛋白的表达,结果显示宫颈癌组APOBEC3A阳性表达较正常宫颈组及CIN组明显下降,差异有统计学意义。此外,本研究结果显示在宫颈癌中APOBEC3A以阴性表达53.85%(14/26)和弱阳性表达30.77%(8/26)为主,表达水平显著低于正常宫颈及CIN组织,提示宫颈癌组织中存在APOBEC3A表达缺失和下调。在宫颈癌组织中HPV16以及HPV18感染率明显增高,分别为92.3%、80.8%。我们发现在2种高危型HPV16、HPV18感染中,宫颈组织中APOBEC3A蛋白的表达与HPV18感染呈负相关,即在APOBEC3A蛋白低表达时HPV18感染率增高,而在APOBEC3A蛋白高表达时HPV18感染率下降,提示APOBEC3A可能存在抑制高危型HPV18的作用。为了进一步明确APOBEC3A对抗HPV18感染的作用,我们以APOBEC3A质粒转染HPV18阳性表达的人宫颈癌HeLa细胞株,选取 HPV18 E6作为靶点,探讨APOBEC3A对宫颈癌细胞株HPV18 E6致癌基因表达的影响。在成功表达APOBEC3A的实验组中,HPV 18 E6 mRNA的表达较转染空质粒的对照组均有明显下降; HPV 18 E6蛋白的表达较对照组以及未处理组均明显下降。
综上所述,在宫颈癌组、CIN组与正常宫颈组中内源性APOBEC3A蛋白的高表达伴随高危型HPV18的感染率降低,增加宫颈细胞APOBEC3A的表达可以抑制HPV18 E6的转录以及表达。在APOBEC3A高表达的宫颈细胞可以产生较好的对抗高危型HPV18感染并抑制E6致癌基因的作用,在阻止感染高危型HPV的宫颈细胞发展成为宫颈癌的过程中起到一定的作用。APOBEC3A低表达的宫颈细胞感染高危型HPV,可能难以产生较好的清除HPV的作用,容易发展成为HPV的持续性感染,发生宫颈细胞癌变的机会明显增加。内源性APOBEC3A在宫颈癌组织中表达的显著下降可能参与了宫颈癌的发生和发展。
[1] Rogozin IB, Basu MK, Jordan IK, et al. APOBEC4, a new member of the AID/APOBEC family of polynucleotide (deoxy)cytidine deaminases predicted by computational analysis[J]. Cell Cycle, 2005, 4(9): 1281-1285.
[2] Mangeat B, Turelli P, Caron G, et al. Broad antiretroviral defence by human APOBEC3G through lethal editing of nascent reverse transcripts[J]. Nature, 2003, 424(6944): 99-103.
[3] Yu Q, Chen D, König R, et al. APOBEC3B and APOBEC3C are potent inhibitors of simian immunodeficiency virus replication[J]. J Biol Chem, 2004, 279(51): 53379-53386.
[4] Delebecque F, Suspène R, Calattini S, et al. Restriction of foamy viruses by APOBEC cytidine deaminases[J]. J Virol, 2006, 80(2):605-614.
[5] Turelli P, Mangeat B, Jost S, et al. Inhibition of hepatitis B virus replication by APOBEC3G[J]. Science, 2004,303(5665):1829.
[6] Chen H, Lilley CE, Yu Q, et al. APOBEC3A is a potent inhibitor of adeno-associated virus and retrotransposons[J]. Curr Biol, 2006, 16(5):480-485.
[7] Vartanian JP, Guétard D, Henry M, et al. Evidence for editing of human apillomavirus DNA by APOBEC3 in benign and precancerous lesions[J]. Science, 2008,320(5873):230-233.
[8] 周 莉, 陈 姗, 张帝开. 持续性人乳头瘤病毒感染与宫颈癌的研究进展[J]. 中国病理生理杂志, 2010,26(12):2482-2486.
[9] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011,61(2):69-90.
[10] 廖百花, 冯亦军, 曾禄贤, 等. 固相转染HPV16-siRNA对荷宫颈癌细胞SiHa小鼠瘤体体积及P53、P16表达的影响[J]. 中国病理生理杂志, 2011,27(3):509-513.
[11] Bishop KN, Holmes RK, Sheehy AM, et al. APOBEC-mediated editing of viral RNA[J]. Science, 2004,305 (5684): 645.
[12] Wijesinghe P, Bhagwat AS. Efficient deamination of 5-methylcytosines in DNA by human APOBEC3A, but not by AID or APOBEC3G[J]. Nucleic Acids Res, 2012,40(18):9206-9217.
[13] Cullen BR. Role and mechanism of action of the APOBEC3 family of antiretroviral resistance factors[J]. J Virol, 2006, 80(3): 1067-1076.
[14] Wang GF, Lin SY, Zhang H, et al. APOBEC 3F and APOBEC 3G have no inhibition and hypermutation effect on the human influenza A virus[J]. Acta Virol, 2008, 52(3): 193-194.
[15] Chutinimitkul S, Suwannakarn K, Chieochansin T,et al. H5N1 oseltamivir-resistance detection by real-time PCR using two high sensitivity labeled TaqMan probes[J]. J Virol Methods, 2007, 139(1):44-49.
[16] Yen HL, Herlocher LM, Hoffmann E,et al. Neuraminidase inhibitor-resistant influenza viruses may differ substantially in fitness and transmissibility[J]. Antimicrob Agents Chemother, 2005, 49(10): 4075-4084.
CorrelationofhumanAPOBEC3Aproteinexpressionwithhigh-riskHPVinfectionincervicalcancertissues
CHEN Shan1, DI Na2, QIN Jun-pu1, ZHENG Ting-ting1, LI Dan1, ZHOU Li1, ZHANG Di-kai1
(1DepartmentofObstetrics&Gynecology,TheSixthAffiliatedHospitalofSunYat-senUniversity,Guangzhou510655,China;2DepartmentofObstetrics&Gynecology,TheSecondAffiliatedHospitalofSunYat-senUniversity,Guangzhou510120,China.E-mail:diopen@21cn.com)
AIM: To study the effects of human apolipoprotein B mRNA-editing catalytic polypeptide-like protein 3A (APOBEC3A) on high-risk human papillomavirus (HPV) in cervical cancer tissues.METHODSImmunohistochemistry technique was used to detect the expression of human APOBEC3A protein, and Hybribio HPV GenoArray diagnostic kit was used to measure high-risk HPV16 and HPV18 in the specimens from 26 cases of cervical cancer, 27 cases of cervical intraepithelial neoplasia (CIN) I~III and 22 cases of normal cervix. The APOBEC3A plasmid was transfected into HeLa cells by Lipofectamine. The expression of HPV18 E6 at mRNA and protein levels was examined by RT-qPCR and Western blotting.RESULTSThe protein expression of APOBEC3A in cervical cancer, CIN and normal cervix was 46.2%, 92.6% and 86.4%, respectively. The protein expression of APOBEC3A in cervical cancer was significantly decreased compared with that in normal cervix (P<0.01). The infection rates of HPV16 in cervical cancer, CIN and normal cervix were 92.3%, 77.8% and 54.5%, respectively, and those of HPV18 were 80.8%, 51.8%, 68.2%, respectively. The protein expression of APOBEC3A was negatively correlated with the infection of HPV18 in cervical tissues (P<0.05). Compared with control group, the expression of HPV18 E6 at mRNA and protein levels was decreased after APOBEC3A plasmid was transfected into HeLa cells.CONCLUSIONIn cervical cancer, the high expression of APOBEC3A protein may fight against HPV18 infection, and APOBEC3A inhibits HPV18 E6 transcription and expression.
Apolipoprotein B mRNA-editing catalytic polypeptide-like protein 3A; Human papillomavirus; Uterine cervical neoplasms
R363
A
10.3969/j.issn.1000- 4718.2013.05.013
1000- 4718(2013)05- 0845- 05
2013- 02- 05
2013- 04- 16
广东省人口计生委基金资助项目(No.2009230)
△通讯作者 Tel: 020-38254117; E-mail: diopen@21cn.com
