非小细胞肺癌患者肿瘤组织和血清表皮生长因子受体第19、21外显子的检测及其临床特征的分析*
2013-10-24周韶璋于起涛曾爱屏宋向群
邹 敏, 周韶璋, 于起涛, 曾爱屏, 宋向群△
(广西医科大学 1附属肿瘤医院化疗二科, 2研究生院,广西 南宁 530021)
非小细胞肺癌患者肿瘤组织和血清表皮生长因子受体第19、21外显子的检测及其临床特征的分析*
邹 敏1,2, 周韶璋1, 于起涛1, 曾爱屏1, 宋向群1△
(广西医科大学1附属肿瘤医院化疗二科,2研究生院,广西 南宁 530021)
目的检测非小细胞肺癌 (non-small-cell lung cancer, NSCLC)患者血清与肿瘤组织中表皮生长因子受体(epidermal growth factor receptor,EGFR)的突变状态,分析两者的一致率及其临床特征,比较2种方法的优劣,探索血清代替组织检测的可行性。方法收集中国人群NSCLC患者肿瘤组织和匹配的血清标本共90对,肿瘤组织和血清均用蝎型探针扩增阻滞突变系统(scorpions amplification refractory mutation system,SARMS)和直接测序2种方法检测EGFR基因中第19和21外显子的突变状态,应用2检验和Fisher精确检验分析19和21外显子EGFR突变与患者临床特征的关系,分析在血清和肿瘤组织标本中基因突变的一致性及2种检测方法的灵敏度和特异度。结果SARMS法检测肿瘤组织和血清标本EGFR突变的检出率分别是46.7% (42/90)和18.9%(17/90),肿瘤组织和血清的突变阳性一致率为16.7%(15/90);而直接测序法检测肿瘤组织和血清标本EGFR突变的检出率分别是30%(27/90)和4.4%(4/90),两者的突变阳性一致率4.4%(4/90)。与测序法相比,SARMS法的灵敏度是35.8%。此外,肿瘤组织的EGFR突变与性别、吸烟史和病理类型有关(P<0.05),血清EGFR突变与年龄、性别、病理类型和临床分期无明显相关(P>0.05)。结论血清的突变检出率仍较组织低,但SARMS法的灵敏度较直接测序法高,肿瘤组织仍为目前确定NSCLC患者EGFR基因突变状态的主要来源和依据。
肺肿瘤; 受体,表皮生长因子; 外显子
肺癌是我国常见恶性肿瘤谱中的主要肿瘤之一,其发生率和死亡率近年来迅速增加,目前已发展成为我国癌症死亡率的首位,对于晚期的非小细胞肺癌(non-small-cell lung cancer,NSCLC),表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKIs)已成为重要的治疗方法,目前大量研究显示:NSCLC患者表皮生长因子受体(epidermal growth factor receptor, EGFR)突变均发生在酪氨酸激酶域ATP结合域附近(第18~21外显子),表现为1个或1段碱基的缺失、插入以及碱基替换引起的错义突变,这些突变可以引起酪氨酸激酶的活性增强[1]。EGFR基因第19和21外显子突变为活化性突变,第18和20外显子突变为耐药性突变,约90%突变集中在第19和21外显子[2]。张静等[3]研究表明第19外显子多个核苷酸框架缺失突变,位于EGFR-TKIs活化部位,都包含共同的碱基序列缺失(第747~750密码子,以下简称19del),分别编码亮氨酸、精氨酸、谷氨酸和丙氨酸(leucine,arginine, glutamic acid and alanine,LREA),第21外显子点突变位使858位上的亮氨酸被精氨酸替代(以下简称L858R)。对于最初EGFR基因突变的人群, EGFR-TKIs作为一线药物的客观缓解率为70.0%,均高于一线化疗的客观有效率29.0%~47.3%[ 4],这提示EGFR基因突变肿瘤对靶向治疗更为敏感。EGFR突变是EGFR-TKIs疗效强有力的预测因子[ 4],但是有部分晚期肺癌患者由于肿瘤生长部位取材困难或就诊时体能状态较差,有时难于获得足够的肿瘤组织用于病理诊断和基因检测。EGFR突变基因具有肿瘤异质性的体细胞遗传性,因而血液游离DNA中就有可能检测到相同的遗传改变。Kimura等[5]采用直接测序法对晚期12例NSCLC患者行外周血和肿瘤组织配对样本突变检测,结果显示外周血与肿瘤组织突变检测一致率为58%,血清的灵敏度为66%和特异度为63%,随后各国学者采用多种方法进行这方面研究[6-9],结论尚无法一致,本研究采用直接测序法和蝎型探针扩增阻滞突变系统(scorpions amplification refractory mutation system, SARMS)2种方法检测中国人群NSCLC肿瘤组织和血清EGFR基因的活化性突变状态,了解EGFR基因在肿瘤组织和血清的一致率,比较直接测序和SARMS法的优劣,对血清能否代替肿瘤组织的可能性进行探讨。
材 料 和 方 法
1研究对象
收集90例2009年1月至2012年10月期间就诊于广西医科大学附属肿瘤医院的非小细胞肺癌患者的血清和组织标本,患者入选标准包括:(1)病理学证实为非小细胞肺癌的患者;(2)所有的患者均未接受过靶向治疗和新辅助化疗;(3)确保所获得的标本能满足检测需要;(4)取材均符合伦理要求。肿瘤组织标本经过手术切除后立即浸泡于液氮中,随后保存于-80 ℃冰箱中,相匹配的血清标本均在手术前或获取组织标本前抽取全血后离心保存在-80 ℃的冰箱中。入选的患者均收集其以下信息:年龄、性别、吸烟史、组织病理类型及临床分期。病人的组织病理分型参考2004版世界卫生组织(World Health Organization,WHO)的肺癌组织学分类[10],临床分期参考第6版国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)的肺癌TNM分期。
2主要试剂
DNA提取试剂盒(DNA Mini Kit 51304)为Qiagen产品,直接测序所用引物[11](引物序列见表1)和Mix均由宝生物工程(大连)有限公司根据要求合成。DxS EGFR29 Mutation Kit, ABI 3730XL,Lightcycler 480,PCR 8联反应条辅助器(BIOplastics,Cat:B-79480)。
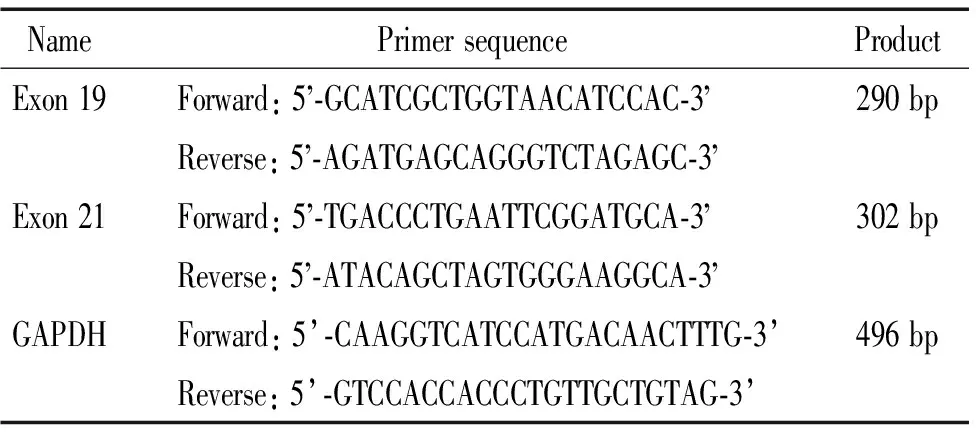
表1 EGFR基因外显子19和21 PCR扩增引物序列
3主要方法
3.1DNA提取 所有的标本均用DNA提取试剂盒提取,具体提取步骤按试剂盒说明书进行。提取的DNA均经过超微量分光光度计(Thermo Scientific NanoDrop 2000)检测,储存在-20 ℃冰箱中。
3.2PCR扩增和直接测序 PCR总的反应体系为50 μL,Mix 25 μL,上、下游引物(10 μmol/L)各2 μL,DNA模板2 μL,去离子水19 μL,扩增条件:94 ℃预变性2 min,94 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 30 s,共35个循环,72 ℃ 2 min。同时PCR反应设置内参照为GAPDH,其PCR反应引物见表1,内参照扩增条件为:94 ℃预变性3 min,94 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 45 s,共35个循环,72 ℃ 3 min。取PCR产物5 μL,在3%琼脂糖凝胶上电泳,后采用凝胶图像分析系统(Gel-Pro Analyzer 3.0)分析目的基因,见图1。对于显示目的基因的PCR产物送北京诺赛基因组研究中心有限公司直接测序(测序用仪器ABI 3730XL),测序的序列和GenBank中人类EGFR基因(AY588246)比对,见图2。

Figure 1. The PCR results of exons 19 and 21.M: marker (100 bp ladder);19: exon 19(290 bp);21:exon 21(302 bp)
图1PCR产物电泳图
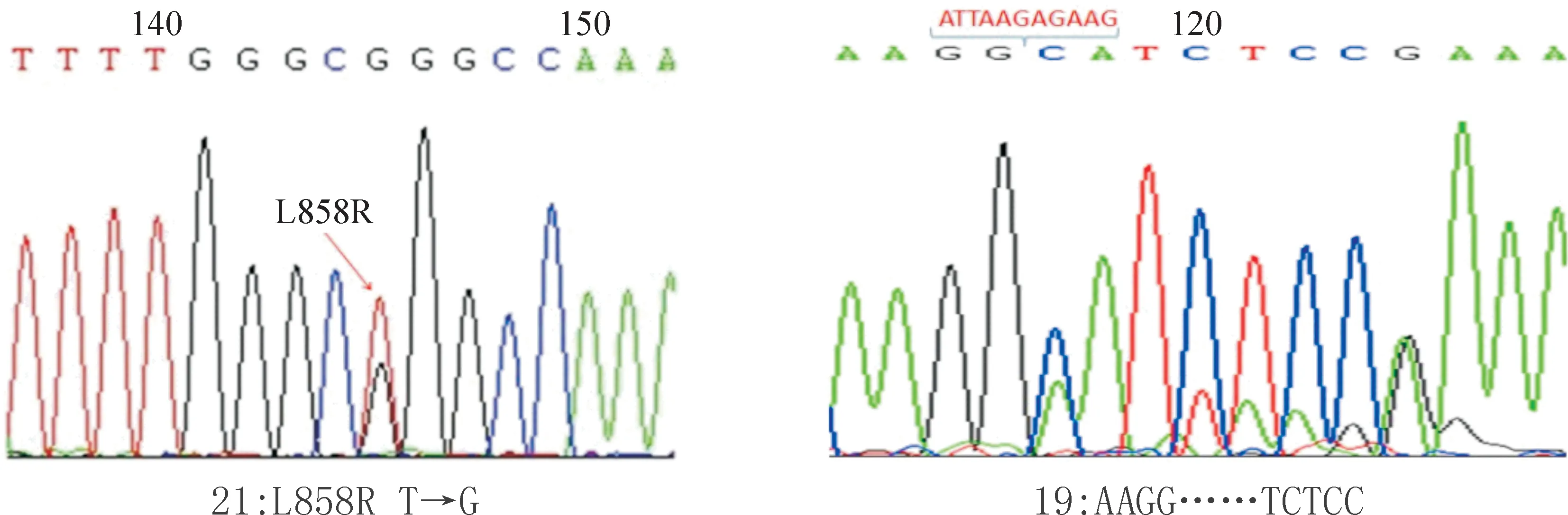
Figure 2. Base sequencing figures of the positive samples.
图2阳性标本的碱基测序图
3.3SARMS检测E746-A750del和L858R 按DxS EGFR29 Mutation Kit操作,根据文献[8]设置检测反应,反应体系为20 μL,其中DNA样品0.4 μL,去离子水3.6 μL,其它反应试剂16 μL。然后再进行RT-PCR扩增,RT-PCR的循环参数:第一阶段95 ℃ 10 min,1个循环;第二阶段95 ℃ 30 s,61.0 ℃ 1 min,40个循环,样品测试结果判读标准:参照试剂盒内容,阳性为Ct标本-Ct对照 4统计学处理 1研究对象临床特征 共90例患者,年龄<59岁占47.8%(43/90),≥59岁占52.2%(47/90),男性占61.1%(55/90),女性占38.9%(35/90),不吸烟占65.6%(59/90),吸烟占34.4%(31/90),腺癌占63.3%(57/90),非腺癌占36.7%(33/90),Ⅰ+Ⅱ期占37.8%(34/90),Ⅲ+Ⅳ期占62.2%(56/90)。 2NSCLC患者血清与肿瘤组织中EGFR基因19和21外显子突变状态及临床特征 采用直接测序法检测90例非小细胞肺癌患者的肿瘤组织和血清标本,肿瘤组织总共检测出27例EGFR基因突变,其中15例(55.56%)为19-del缺失,12例(44.44%)为L858R点突变,总突变检测率为30.0%(27/90);血清共检测出4例EGFR突变, 4例均为L858R点突变,总突变检测率为4.4%(4/90)。采用SARMS方法检测,肿瘤组织总共检测出42例EGFR基因突变,其中23例(54.76%)为19-del缺失,19例(45.23%)为L858R点突变,总突变检出率为46.7%(42/90);90例血清样本中, 共检测出17例,其中9例(52.94%)为19-del缺失,8例(47.05%)为L858R点突变,总突变检测率18.9%(17/90)。2种方法均未发现19-del缺失和L858R点突变共存现象。统计分析显示,非小细胞肺癌组织EGFR突变阳性和阴性患者在年龄和临床分期均无统计学差异(P>0.05),在性别、吸烟史和病理类型均有统计学差异(P<0.05),而血清EGFR突变阳性和阴性患者在年龄、性别、病理类型、吸烟史和临床分期均无统计学差异(P>0.05),见表2、3。 表2 患者肿瘤组织和血清病理特征和临床特征的比较(直接测序法) T-19:tumor tissue 19-del;T-21:tumor tissue L858R;Any-T:tumor tissue detection;P-19:serum 19-del;P-21:serum L858R;Any-P:serum detection. 表3 患者肿瘤组织和血清病理特征和临床特征的比较(SARMS法) T-19:tumor tissue 19-del;T-21:tumor tissue L858R;Any-T:tumor tissue detection;P-19:serum 19-del;P-21:serum L858R;Any-P:serum detection. 3EGFR活化性突变的阳性一致率及血清活化性突变的灵敏度、特异度、阳性预测价值和阴性测价值 SARMS法和直接测序法检测血清EGFR活化性突变的灵敏度分别为35.8%(15/42)和14.8%(4/27),特异度分别为95.9%(46/48)和100%(63/63),阳性预测价值分别为88.2%(15/17)和100%(4/4),阴性预测价值分别为73.0%(46/63)和73.2%(63/86)。肿瘤组织EGFR活化性突变的一致率为83.3%(75/90)。2种方法检测90例患者血清和肿瘤组织EGFR活化性突变的一致率分别为16.7%(15/90)和4.4%(4/90),见表4、5。 表4SARMS法检测血清和肿瘤组织中EGFR活化性突变的一致率 Table 4. The concordance rate of detecting the activated mutations ofEGFRin serum and tumor by SARMS TumortissueSerumTotalMutationNon⁃mutationMutation152742Non⁃mutation24648Total176390 Sensitivity (%)=(both tumor and serum mutation)/(total tumor mutation)×100%;specificity (%)=(both tumor and serum non-mutation)/(total tumor non-mutation)×100%;positive predictive value (%)=(both tumor and serum mutation)/(total serum mutation)×100%;negative predictive value (%)=(both tumor and serum non-mutation)/(total serum non-mutation)×100%;concordance (%)=(both serum and tumor mutation)/(total cases)×100%. 表5直接测序法检测血清和肿瘤组织中EGFR活化性突变的一致率 Table 5. The concordance rate of detecting the activated mutations ofEGFRin serum and tumor by direct sequencing Sensitivity (%)=(both tumor and serum mutation)/(total tumor mutation)×100%;specificity (%)=(both tumor and serum non-mutation)/(total tumor non-mutation)×100%;positive predictive value (%)=(both tumor and serum mutation)/(total serum mutation)×100%;negative predictive value (%)=(both tumor and serum non-mutation)/(total serum non-mutation)×100%;concordance (%)=(both serum and tumor mutation)/(total cases)×100%. 目前,越来越多的靶向药物被用于NSCLC的治疗。林小梅等[12]研究了针对新型融合基因EML4-ALK的靶向药物。该融合基因由棘皮动物微管相关蛋白样4(echinoderm microtubule-associated protein-like 4,EML4)和间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)两者的部分基因相互融合而成。中国人群EML4-ALK融合基因的突变率7.8%,因而针对该融合基因的靶向药物获益率较低。而Tony等[4]对1 217名ⅢB或Ⅳ期不吸烟或少吸烟的未接受过任何抗肿瘤治疗的肺腺癌患者行EGFR基因检测发现,EGFR突变占35.9%,其中19-del占53.6%,L858R占42.3%,T790M占4.2%,其它突变占3.8%;对EGFR活化性突变的患者使用一线药物吉非替尼获益率高,不仅明显延长无进展生存期(progression-free survival, PFS),而且提高了患者的生活质量,提高了客观缓解率,减少了毒副反应。Zhou等[2]对165名ⅢB或Ⅳ期且明确诊断EGFR基因第19或21外显子突变的NSCLC患者分别行一线药物化疗和EGFR-TKI(厄洛替尼)治疗,中位PFS分别是4.6个月和13.1个月,因此对NSCLC患者行EGFR基因第19和21外显子突变的检测对治疗有重大的意义。 EGFR基因检测标本的来源常见的有手术切除标本、纤维支气管镜下所取得的组织、外周转移的淋巴结活检等,但临床上有部分患者就诊时已失去手术机会,纤维支气管镜获取的标本较少,组织检测EGFR较困难, 对这部分患者进行EGFR检测是当前临床实践中较为棘手的问题。有研究[13]表明肺癌组织血供丰富,肿瘤患者血清中存在大量的游离DNA,其含量约为健康人的10倍以上,血清游离DNA主要来自凋亡坏死的癌细胞,其遗传特异性与肿瘤基因组DNA相同。Bai等[6]对晚期230例NSCLC患者行外周血和肿瘤组织配对样本突变检测,结果显示外周血与肿瘤组织突变检测一致率为87%,血清的灵敏度为82%和特异度为90%,进一步证实了血清循环DNA与肿瘤组织DNA的EGFR基因突变一致,因而以血清游离DNA为靶分子探讨疗效及预后分子的标志物成为目前研究的热点。 本研究中90例晚期NSCLC患者血清和肿瘤组织配对样本采用SARMS和直接测序2种方法行活化性感突变检测,阳性一致率分别是16.7%和4.4%,血清灵敏度分别是35.8%和14.8%,特异度分别是95.9%和100%,阴性预测值分别为73.0%(46/63)和73.2%(63/86)。这与Goto等[7]采用SARMS法对86例晚期NSCLC患者行外周血和肿瘤组织配对样本突变检测,外周血与肿瘤组织突变检测一致率为66%,血清的灵敏度为43%和特异度为100%是一致的,但本研究中阴性预测值73.0%高于Goto等[7]研究报道的阴性预测值54.7%,可能与本研究中入选NSCLC患者包含Ⅰ~Ⅳ期,而Goto等[7]选择晚期NSCLC患者有关,此外本研究对血浆DNA样本EGFR活化性突变检出的效率与Qin等[14]报道SARMS法灵敏度高于直接测序是一致的。因此对于同一组标本行EGFR活化性突变检测,SARMS阳性一致率和灵敏度均高于直接测序法,这可能是直接测序法只能检测大于30%突变拷贝数[15],而SARMS法采用的EGFR活化性突变检测试剂盒结合了ARMSTM和Scorpions 2种技术,检测起来方便、快捷、灵敏度和特异度高,可以检测约1%的拷贝数[9]。 本研究中,SARMS和直接测序法的活化性突变一致率分别是16.7%和4.4%,均低于Bai等[6]的研究,不仅可能和Bai等[6]的研究采用变性高效液相色谱法可以检测3%的突变拷贝有关系,而且可能与肿瘤组织释放至外周血游离DNA水平未达到检测水平或者肿瘤的异质性有关,还可能和血清中含有来自正常细胞的DNA有关。 目前肿瘤组织EGFR突变阳性多见于不吸烟、腺癌的非小细胞人群[4]。在本研究中比较血清EGFR基因19和21外显子阳性和阴性病人的临床及病理特征显示,阳性和阴性的病人在性别、年龄、吸烟史、病理类型和临床分期方面差别均无统计学意义,但入选本研究的患者是未经过筛选的非小细胞肺癌人群,2种方法检测均为EGFR活化性突变血清共4例,病人临床特征表现为:3例低于59岁,4例为不吸烟人群,3例为腺癌病人,1例为腺鳞癌病人,亦含有腺癌成分,这与Bai等[6]等研究结果是一样的,说明血清EGFR活化性突变可能多见于小于60岁、无吸烟史和腺癌患者,但由于阳性患者的样本量偏少,需要今后大样本的数据去验证。 综上所述,我们采用了SARMS和直接测序法分析了NSCLC患者EGFR基因19和21外显子的突变状态,相对于直接测序,SARMS有较高的灵敏度,更适于对肿瘤组织和血清EGFR活化性突变状态的检测,对于EGFR活化性突变状态,2种检测方法,肿瘤组织和血清有较好的总体一致率,但血清EGFR活化性突变的阳性检出率仍较低,且灵敏度和特异度也较肿瘤组织低,组织检测仍为目前确定患者EGFR基因突变状态的主要来源和依据。在无法获取肿瘤组织的情况下,对血清行EGFR敏感突变检测,SARMS相对于直接测序有较好的灵敏度,但用SARMS方法检测,血清能否替代肿瘤组织,仍然需要大样本、多中心、盲法研究进一步的证实。 [1] Paez JG,Janne PA,Lee JC,et al.EGFR mutations in lung cancer:correlation with clinical response to gefitinib therapy[J].Science,2004,304(5676):1497-1500. [2] Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study[J]. Lancet Oncol,2011,12(8): 735-742. [3] 张 静,梁智勇,曾 瑄,等.应用蝎形探针扩增组织突变系统检测非小细胞肺癌表皮生长因子受体基因突变与病理改变的关系[J].中华病理学杂志,2008,37(5):294-299. [4] Mok TS,Wu YL, Thongprasert S,et al.Gefitinib or Carboplatin-paclitaxel in pulmonary adenocarcinoma[J].N Engl J Med,2009,361(10):947-957. [5] Kimura H, Kasahara K, Shibata K, et al. EGFR mutation of tumor and serum in gefitinib-treated patients with che-motherapy-naive non-small cell lung cancer[J].J Thorac Oncol,2006,1(3): 260-267. [6] Bai H, Mao L, Wang HS, et al. Epidermal growth factor receptor mutations in plasma DNA samples predict tumor response in Chinese patients with stage IIIB to IV non-small-cell lung cancer[J]. J Clin Oncol, 2009, 27(16): 2653-2659. [7] Goto K, Ichinose Y, Ohe Y, et al. Epidermal growth factor receptor mutation status in circulating free DNA in se-rum:from IPASS, a phase III study of gefitinib or carboplatin/paclitaxel in non-small cell Lung cancer[J] . J Thorac Oncol, 2012, 7(1):115-121. [8] 周晓昀,李龙芸,崔 巍,等.检测肺癌患者血清游离DNA的EGFR基因点突变与EGFR-TKI疗效的相关性分析[J]. 癌症进展,2011,9(1):13-18. [9] Kimura H,Suminoe M,Kasahara K,et al.Evaluation of epidermal growth factor receptor mutation status in serum DNA as a predictor of response to gefitinib(IRESSA) [J].Br J Cancer,2007,97(6):778-784. [10] Beasley MB,Brambilla E,Travis WD.The 2004 World Health Organization classification of lung tumors[J].Semin Roentgenol,2005,40(2):90-97. [11] Lin CH, Yeh KT, Chang YS,et al. Rapid detection of epidermal growth factor receptor mutations with multiplex PCR and primer extension in lung cancer[J]. J Biomed Sci, 2010, 17:37. [12] 林小梅,莫娟梅,邹 敏,等.EGFR突变的非小细胞肺癌患者EML4-ALK融合基因的检测及临床特征分析[J].中国病理生理杂志,2012,28(6):1135-1139. [13] Sozzi G,Conte D,Leon M,et al.Quantification of free circulating DNA as a diagnostic marker in lung cancer[J].J Clin Oncol,2003,21(12):3902-3908. [14] Qin L,Zhong W, Zhang L,et al. Comparison of three methods for detecting epidermal growth factor receptor mutations in plasma DNA samples of Chinese patients with advanced non-small cell lung cancer[J]. Chin Med J (Engl), 2011,124(6):887-891. [15] Fan X,Furnari FB,Cavenee WK,et al. Non-isotopic silver-stained SSCP is more sensitive than automated direct sequencing for the detection of PTEN mutations in a mixture of DNA extracted from normal and tumor cells[J].Int J Oncol,2001,18(5):1023-1026. Determinationofmutationsinexons19and21ofepidermalgrowthfactorreceptorintumortissueandserumsamplesfromChinesepatientswithnon-small-celllungcancer ZOU Min1,2, ZHOU Shao-zhang1, YU Qi-tao1, ZENG Ai-ping1, SONG Xiang-qun1 (1TheSecondDepartmentofChemotherapy,AffiliatedTumorHospitalofGuangxiMedicalUniversity,2PostgraduateCollege,GuangxiMedicalUniversity,Nanning530021,China.E-mail:xiangquns@qq.163.com) AIM: To detect the mutations in exons 19 (deletion) and 21 (L858R) of epidermal growth factor receptor (EGFR) gene in serum and matched tumor samples from the patients with non-small-cell lung cancer (NSCLC) and to investigate the concordance rate between the sample sources.METHODSDNA from serum and matched tumor samples from 90 patients with NSCLC was extracted for detecting the mutations in exons 19 and 21 ofEGFRgene by direct DNA sequencing and scorpion amplification refractory mutation system (SARMS). The relationship betweenEGFRmutations and clinical features, and the concordance between the sample sources were analyzed by2-test and Fisher’s exact test. The sensitivity and specificity of the 2 methods were compared.RESULTSIn 90 patients, the mutations in exons 19 and 21 ofEGFRgene were detected in 17 serum samples and 42 tumor tissues by SARMS with the detection rates of 18.9% and 46.7%, respectively. Positive consistence rate between serum DNA and tumor DNA was 16.7%. Meanwhile,the mutations were only found in 4 serum samples (4.4%) and 27 tumor tissue samples (30%) by direct DNA sequencing, with the sex, positive consistence rate of 4.4%. Compared with direct sequencing, the sensitivity of SARMS was 35.8%. In addition, the mutations in exons 19 and 21 ofEGFRgene in the tumor tissues were correlated with sex, pathological type and smoking status (P<0.05), and the mutations in the serum were not associated with age, sex, pathological type, smoking status and clinical stage (P>0.05).CONCLUSIONThe detection rate of the mutations in exons 19 and 21 ofEGFRgene in serum samples is lower than that in tissue samples. The sensitivity of SARMS is higher than that of direct DNA sequencing. Tumor tissues are still the main source for detectingEGFRgene mutations in the patients with NSCLC. Lung neoplasms; Receptors,epidermal growth factor; Exons R363 A 10.3969/j.issn.1000- 4718.2013.05.012 1000- 4718(2013)05- 0839- 06 2013- 02- 01 2013- 03- 26 广西壮族自治区卫生厅重点学科资助项目(No.200968) △通讯作者 Tel: 0771-5334955; E-mail: xiangquns@qq.163.com结 果


讨 论
