丙戊酸钠对RPMI822和U266细胞增殖及IL-6/JAK/STAT信号通路的影响*
2013-10-24马泳泳周淑娟葛杭萍蔡芳芳
马泳泳, 周淑娟, 葛杭萍, 蔡芳芳, 章 瑜, 俞 康
(1温州医学院附属第一医院血液科, 2温州医学院,浙江 温州 325000)
丙戊酸钠对RPMI822和U266细胞增殖及IL-6/JAK/STAT信号通路的影响*
马泳泳1△, 周淑娟1, 葛杭萍2, 蔡芳芳1, 章 瑜1, 俞 康1
(1温州医学院附属第一医院血液科,2温州医学院,浙江 温州 325000)
目的探讨丙戊酸钠(valproic acid sodium, VPA)对人骨髓瘤RPMI8226和U266细胞增殖及IL-6/JAK/STAT信号通路的作用。方法RPMI8226和U266细胞经不同浓度VPA处理12及24 h后进行实验,MTT法检测VPA对细胞增殖的影响,流式细胞术检测VPA处理后的细胞周期及凋亡率,ELISA法检测培养细胞上清IL-6的浓度,半定量RT-PCR检测VPA作用后RPMI8226和U266细胞中STAT3、STAT5、Bcl-xL、Mcl-1、c-Myc、CCND1和VEGF mRNA表达水平。Western blotting检测JAK2和STAT5总蛋白及磷酸化蛋白表达水平。结果(1) 10、20及40 μmol/L VPA处理RPMI8226和U266细胞12 h及24 h后,细胞存活率值显著下降,与各对照组比较均有显著差异(P<0.05),各对照组之间无显著差异。(2) VPA处理RPMI8226和U266细胞 24 h后,G1/G0期细胞增多,S期细胞减少,细胞凋亡率增加,且凋亡率与VPA的作用剂量相关。(3) VPA处理RPMI8226和U266细胞24 h后,上清IL-6浓度与VPA浓度呈负相关。(4)RPMI8226和U266细胞组在40 μmol/L VPA处理后其STAT3、STAT5、Bcl-xL、Mcl-1、c-Myc、CCND1和VEGF mRNA表达减低,与未处理组比较有显著差异。(5)与对照组比较,VPA处理组p-JAK2、JAK2、p-STAT5和STAT5蛋白表达均显著降低。结论(1) VPA对多发性骨髓瘤细胞有体外抑制作用; (2) VPA对骨髓瘤细胞株的体外抑制可能是通过调节IL-6/JAK/STAT信号通路来实现的。
丙戊酸钠; 多发性骨髓瘤; 白细胞介素6; JAK/STAT信号通路
多发性骨髓瘤(multiple myeloma,MM)是一种浆细胞恶性克隆增生性疾病,是血液系统常见的恶性肿瘤。目前仍不可治愈。在MM肿瘤细胞生长和生存过程中及白细胞介素6(interleukin-6,IL-6)已被证实是重要旁分泌细胞因子[1]。在IL-6诱导的Janus 激酶/信号转导子及转录激活子(Janus kinase/signal transducers and activators of transcription,JAK/STAT) 通路中, STAT1和STAT3持续活化是MM肿瘤细胞生长和生存的重要刺激因子[2-3]。
丙戊酸钠(sodium valproate,VPA)是一种传统的抗癫痫、躁狂抑郁症药物,毒副作用轻微,长期使用患者耐受性好;属短链脂肪酸类组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor, HDACi)。近年来,越来越多的证据表明VPA具有抗肿瘤的作用[4-7]。但是VPA是否对多发性骨髓瘤有抑制作用及对骨髓瘤发生的主要激活通路IL-6/JAK/STAT信号通路的作用尚不清楚。本研究对VPA是否能抑制人骨髓瘤细胞株RPMI8226和U266的增殖及在其对IL-6/JAK/STAT信号通路的作用进行探讨。
材 料 和 方 法
1主要药品和试剂
VPA 购自杭州赛诺菲安万特公司。RPMI-1640培养液为Gibco 产品, 胎牛血清(fetal calf serium,FCS)购自杭州四季青生物公司,TRIzoL 购自Invitrogen; 逆转录试剂盒购自Fermentas, IL-6 ELISA 试剂盒购自晶美生物技术公司。JAK2、p-JAK2、STAT5和p-STAT5抗体购自Cell Signaling Technology。One-Step RT-PCR试剂盒均为Qiagen产品;噻唑蓝(MTT)购自Sigma;其它生化试剂均为进口分装或国产分析纯。所用引物由上海吉凯基因技术有限公司根据设计合成,见表1。
2主要方法
2.1细胞株的培养 多发性骨髓瘤细胞株RPMI8226和U266由温州医学院内科实验室长期保存,实验前从-196 ℃液氮罐中取出,快速复苏后用用含10% FCS的RPMI-1640培养液重悬后, 置于37 ℃、5%CO2、饱和湿度培养箱中培养, 每2~3 d换液1次。选择对数生长期细胞进行实验。
2.2MTT 增殖抑制实验 以每孔2×108/L的细胞密度接种于96 孔板中,每孔200 μL;培养过夜后分别加入0、10、20及40 μmol/L VPA;分别作用0、12及24 h后每孔加入MTT(5 g/L) 20 μL,37 ℃放置4 h;离心,弃上清液,每孔加入二甲亚砜(DMSO) 150 μL,混匀吹打,使沉淀充分溶解;用酶联免疫分析仪读取490 nm处的吸光度(A)值,并用以下公式计算各组细胞存活率。实验设4个平行孔,重复实验3次。存活率(%)=药物组A值/对照组A值×100%。

表1 引物序列
2.3流式细胞术检测细胞周期及凋亡率 选择未处理以及用10及40 μmol/L VPA处理24 h后的RPMI8226和U266细胞,将各组细胞吹打均匀,制成单细胞悬液,转移至5 mL离心管,1 000 r/min离心5 min。PBS洗2次,用PBS重悬细胞,计数,调整细胞浓度至1×109/L。沿管壁缓慢加入-20 ℃预冷的95%乙醇,使其终浓度为70%,冰浴30 min,4 ℃放置。用PBS洗去细胞固定液乙醇,调节细胞浓度至1×109/L,加入等体积的PI染液1 mL,4 ℃放置30 min。以300目尼龙膜过滤,流式细胞术测定每个细胞的荧光强度。
2.4血清IL-6检测 将1×109/L细胞接种于培养瓶,24 h后弃除培养液,分别加入10、20及40 μmol/L VPA,以不加药细胞作为对照。作用12和24 h后收集细胞,分别用于实验。根据IL-6 ELISA试剂盒说明书进行操作。
2.5RT-PCR法检测STAT3、STAT5、Bcl-xL、Mcl-1和c-Myc、CCND1和VEGF mRNA的表达 采用RNeasy Mini试剂盒分离纯化各组细胞的总RNA,分光光度法测定计算提取的总RNA含量及浓度。参照OneStep RT-PCR试剂盒实验操作说明进行RT-PCR,总反应体积50.0 μL,其中5× OneStep RT-PCR buffer 10.0 μL,dNTP Mix 2.0 μL,OneStep RT-PCR Enzyme Mix 2.0 μL,5× Q-Solution 10.0 μL, RNase inhibitor 10 U, RNA 1.0 μg,引物0.6 μmol/L。退火温度分别为56 ℃、56 ℃、58 ℃、60 ℃、58 ℃、57 ℃和58 ℃。然后,取RT-PCR产物10.0 μL,加上样缓冲液2.0 μL,在2%琼脂糖凝胶上电泳,70 V 40 min,凝胶图像成像系统拍摄保存实验结果,凝胶图像分析系统(Gel-Pro Analyzer 3.0)分析各目的基因与β-actin条带吸光度值。
2.6Western blotting检测JAK2、STAT5总蛋白及磷酸化JAK2、STAT5蛋白水平 U266和RPMI8226细胞经不同浓度VPA作用12和24 h后,收集各组骨髓瘤细胞4×109/L, PBS清洗后加入蛋白抽提裂解液50 μL抽提细胞总蛋白,冰浴15 min,离心收集细胞总蛋白。蛋白提取物经定量后, 30 μg上样至8% SDS-聚丙烯酰胺凝胶,电泳,常规转膜。后者经5%脱脂奶粉封闭后,分别与1∶500稀释度的相应Ⅰ抗(抗JAK2抗体、抗p-JAK2抗体、抗STAT5抗体和抗p-STAT5抗体)和适宜稀释度的Ⅱ抗(羊抗鼠Ig-HRP)孵育,经Odyssey显色系统显色,收集蛋白印迹图。
3统计学处理
用SPSS 16.0统计软件进行分析。数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法),以P<0.05为差异有统计学意义。
结 果
1MTT检测细胞存活率
VPA处理前U266和RPMI8226细胞存活率无显著差异(P>0.05);10、20及40 μmol/L VPA处理12 h及24 h后,细胞存活率显著下降,与各对照组比较均有显著差异(P<0.05),各对照组之间无显著差异,见表2。
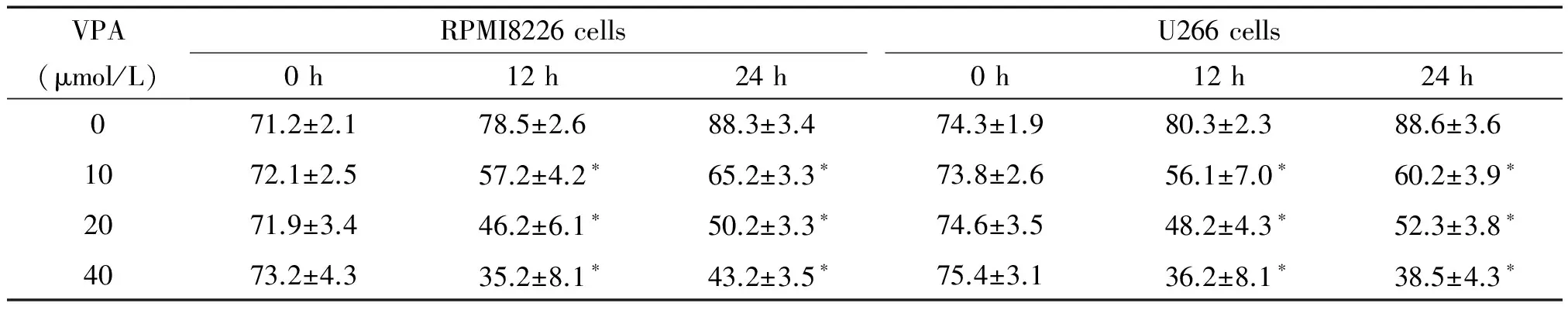
表2 RPMI8226和U266细胞的存活率
*P<0.05vs0 μmol/L VPA.
2流式细胞术检测VPA处理后RPMI8226和U266细胞细胞周期及凋亡率的影响
VPA处理24 h的RPMI8226和U266细胞,G1/G0期细胞增多,S期细胞减少,细胞凋亡率增加,且凋亡率与VPA的作用剂量呈正相关,见表3。
表3VPA处理24h对RPMI8226和U266细胞细胞周期分布和凋亡率的影响
Table 3. Distribution of cell cycle and apoptotic rates of RPMI8226 and U266 cells treated with VPA for 24 h(%.Mean±SD.n=12)

VPA(μmol/L)RPMI8226cellsU266cellsG0/G1SG2/MApoptoticrateG0/G1SG2/MApoptoticrate049.9±2.248.2±3.51.9±0.1045.8±3.252.8±2.11.4±0.201065.4±4.5∗31.2±3.6∗3.4±0.3∗5.9±1.0∗66.3±3.1∗29.1±1.8∗4.6±1.2∗6.3±1.1∗4072.1±6.9∗25.7±2.1∗2.2±0.37.8±1.6∗71.9±4.5∗24.4±2.3∗3.7±0.4∗8.6±2.5∗
*P<0.05vs0 μmol/L VPA.
3上清液IL-6检测
VPA处理24 h的RPMI8226和U266细胞上清液IL-6浓度与VPA浓度呈负相关,见图1。
4RT-PCR结果
RPMI8226和U266细胞在40 μmol/L VPA处理后其STAT3、STAT5、Bcl-xL、Mcl-1、c-Myc、CCND1和VEGF mRNA表达减低,与未处理组比较有显著差异,见图2、3。
5Westernblotting检测JAK2、STAT5总蛋白及磷酸化JAK2、STAT5蛋白水平
与阴性对照组比较,VPA处理组JAK2、p-JAK2、p-STAT5和STAT5 蛋白表达均显著降低,差异显著(P<0.05),见图4、表4。
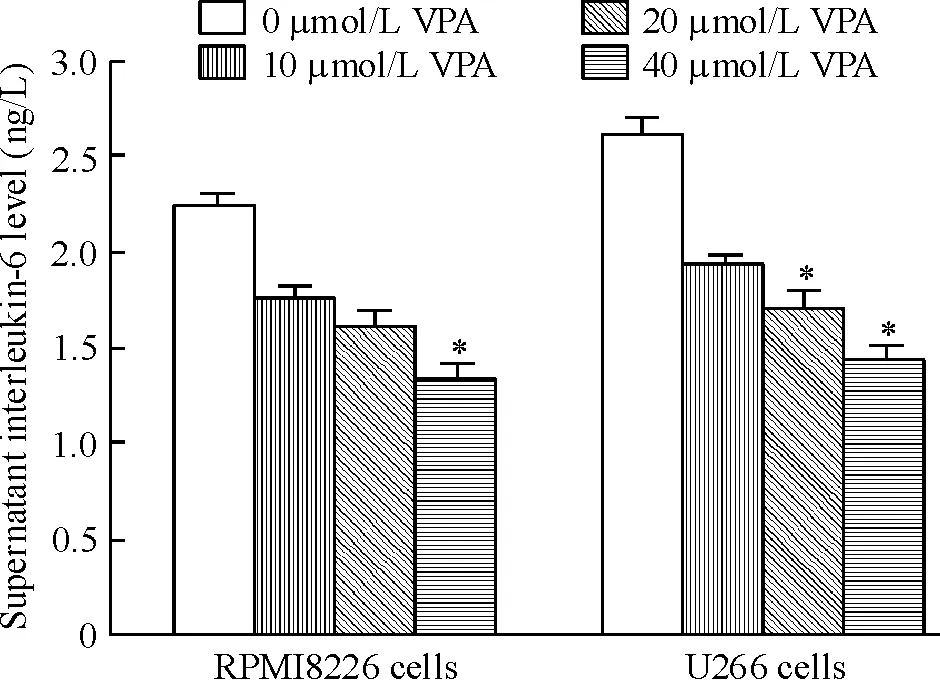
Figure 1. Supernatant interleukin-6 levels of RPMI8226 and U266 cells treated by VPA for 24 h.Mean±SD.n=12.*P<0.05vs0 μmol/L VPA.
图1VPA处理24h的RPMI8226和U266细胞上清液IL-6浓度
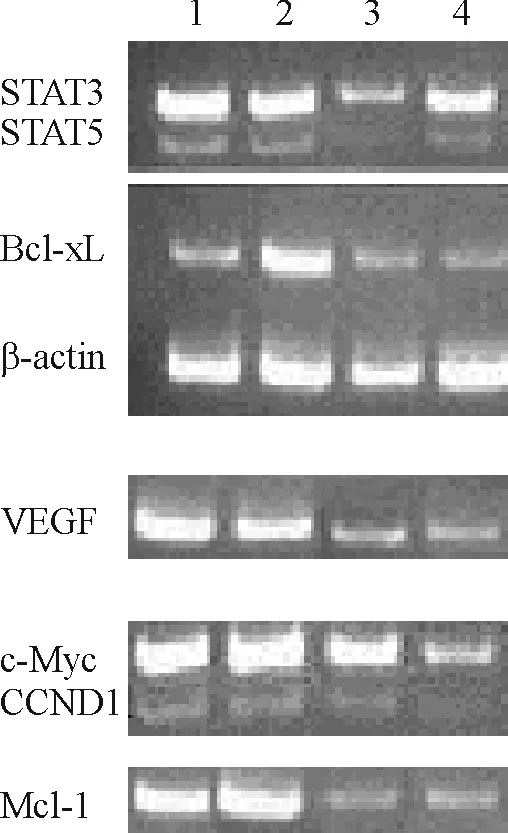
Figure 2. RT-PCR results for STAT3, STAT5, Bcl-xL, Mcl-1, c-Myc, CCND1 and VEGF mRNA expression levels.1,2: 0 μmol/L VPA; 3, 4: 40 μmol/L VPA; 1, 3: RPMI8226 cells; 2, 4: U266 cells.
图2RT-PCR检测40μmol/LVPA处理后STAT3、STAT5、Bcl-xL、Mcl-1、c-Myc、CCND1和VEGFmRNA表达水平
讨 论
多发性骨髓瘤发病机制涉及染色体易位、细胞因子异常、骨髓微环境改变以及信号通路异常等。细胞因子的异常可影响正常B细胞激活、发育和分化,对MM的发生、发展均起到关键性作用,IL-6已被证实是促进MM肿瘤细胞生长和生存的重要旁分泌细胞因子[1]。IL-6受体包含2条链:相对分子质量为8.0×104的α链(IL-6R)和相对分子质量为1.3×105的β链(gp130)。首先IL-6与IL-6R结合,形成复合物,再与gp130结合,进行信号转导。Gp130转导链的活化是浆细胞瘤增生信号转导的关键。Gp130同源/异源二聚化后,通过JAK/Tik激酶和Lyn激酶的活化、转录因子STAT家族的磷酸化、Ras-MAP通路各级激酶的活化以及各种转录因子由自身激酶磷酸化活化等机制实现IL-6信号转导[8]。
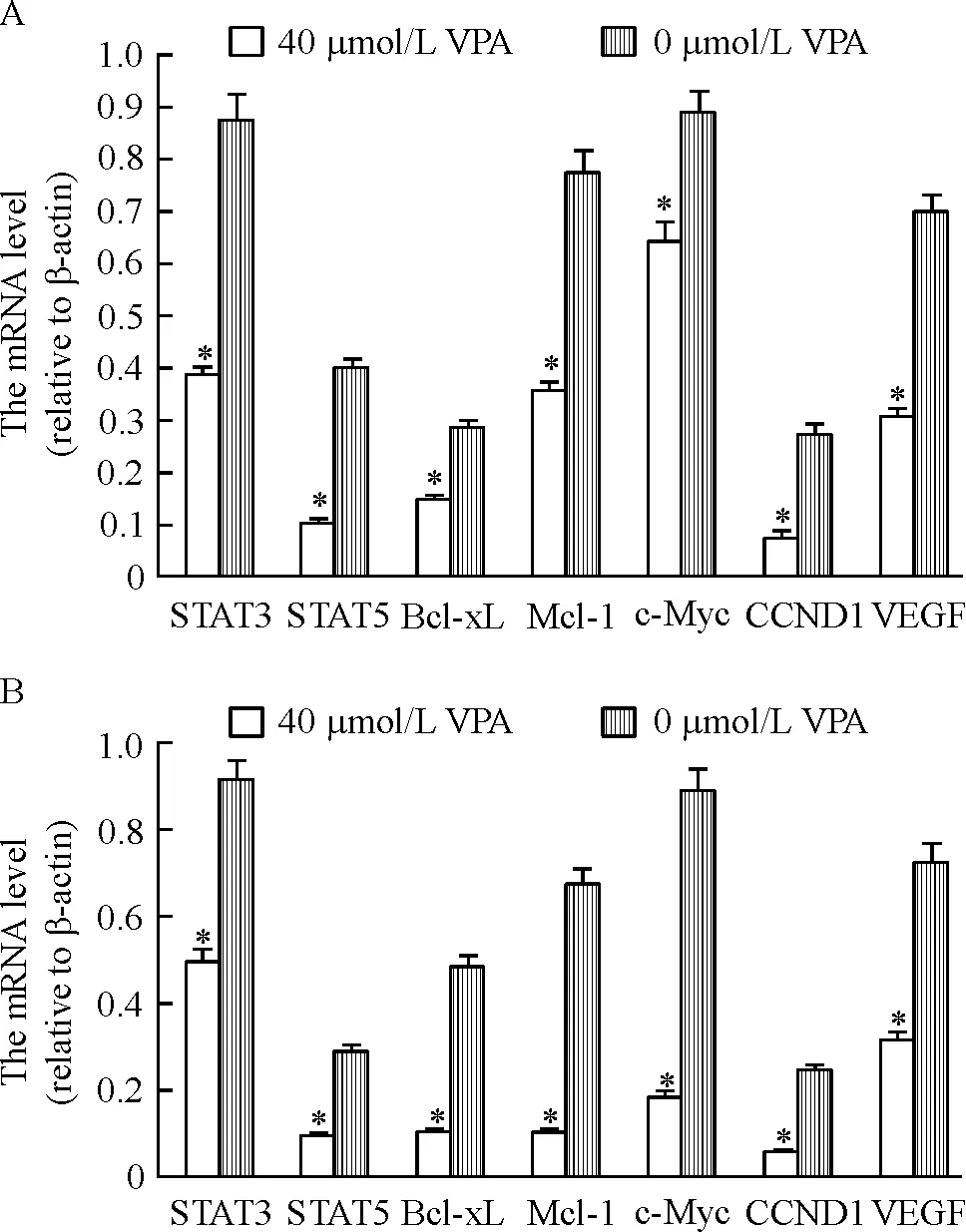
Figure 3. Expression of STAT3,STAT5,Bcl-xL,Mcl-1,c-Myc,CCND1 and VEGF mRNA in RPMI8226 cells (A) and U266 cells (B). Mean±SD.n=12.*P<0.05vs0 μmol/L VPA.
图3各组STAT3、STAT5、Bcl-xL、Mcl-l、c-Myc、CCND1和VEGFmRN表达水平
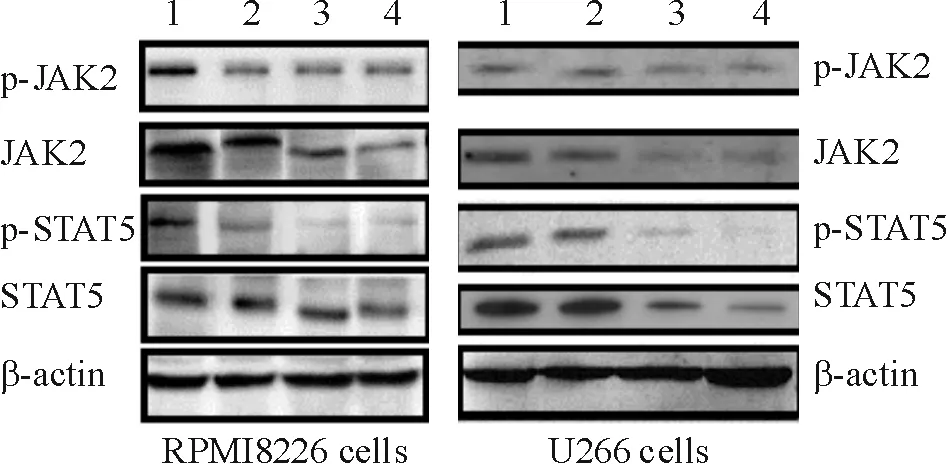
Figure 4. Expression of JAK2,p-JAK2,p-STAT5 and STAT5 proteins in RPMI8226 and U266 cells treated with VPA for 24 h.1~4: 0, 10, 20 and 40 μmol/L VPA, respectively.
图4Westernblotting检测JAK2和STAT5蛋白表达
表4Westernblotting检测JAK2和STAT5蛋白表达
Table 4. Expression of JAK2,p-JAK2,p-STAT5 and STAT5 proteins of RPMI8226 and U266 cells treated with VPA for 24 h (Mean±SD.n=12)
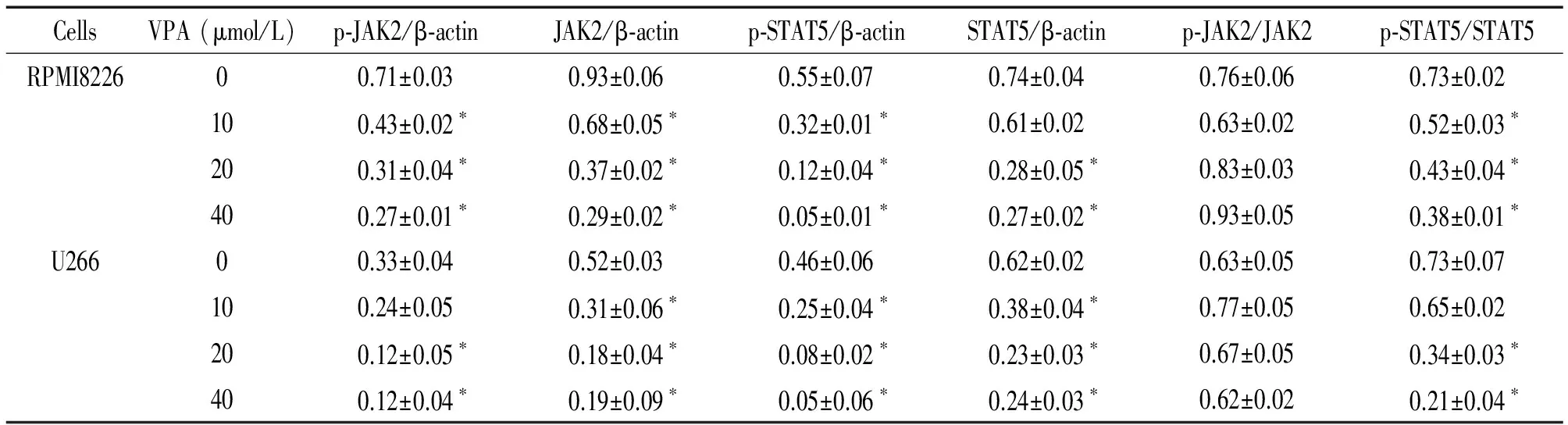
CellsVPA(μmol/L)p⁃JAK2/β⁃actinJAK2/β⁃actinp⁃STAT5/β⁃actinSTAT5/β⁃actinp⁃JAK2/JAK2p⁃STAT5/STAT5RPMI822600.71±0.030.93±0.060.55±0.070.74±0.040.76±0.060.73±0.02100.43±0.02∗0.68±0.05∗0.32±0.01∗0.61±0.020.63±0.020.52±0.03∗200.31±0.04∗0.37±0.02∗0.12±0.04∗0.28±0.05∗0.83±0.030.43±0.04∗400.27±0.01∗0.29±0.02∗0.05±0.01∗0.27±0.02∗0.93±0.050.38±0.01∗U26600.33±0.040.52±0.030.46±0.060.62±0.020.63±0.050.73±0.07100.24±0.050.31±0.06∗0.25±0.04∗0.38±0.04∗0.77±0.050.65±0.02200.12±0.05∗0.18±0.04∗0.08±0.02∗0.23±0.03∗0.67±0.050.34±0.03∗400.12±0.04∗0.19±0.09∗0.05±0.06∗0.24±0.03∗0.62±0.020.21±0.04∗
*P<0.05vs0 μmol/L VPA
JAK/STAT通路是细胞因子、生长因子和激素等衍广泛涉及的信号转导通路,此通路的持续激活与人类多种肿瘤尤其是造血系统恶性肿瘤的发生有关。在血液病患者中普遍存在JAK/STAT通路的持续激活,STAT3的持续性激活在MM肿瘤发生中的作用受到广泛关注[9]。STAT3作为一种核转录因子,在细胞内负责重要的信号转导,将细胞外的信号传递到细胞核,诱导下游靶基因表达。细胞因子等配体与细胞表面(或者胞浆内的)相应受体结合后,诱发了受体的集聚和二聚化,导致与gp130相连的JAK磷酸化而激活,继而使得STAT3分子C端的酪氨酸残基发生磷酸化,通过其SH2区形成二聚体而被活化[10]。激活的二聚体接着转入细胞核内,识别并结合到靶基因DNA特异的反应元件,诱导了抗凋亡蛋白Bcl-xL、Mcl-1和细胞周期控制蛋白c-Myc、cyclin D1和VEGF等表达[8,11]。
VPA是一种传统的抗癫痫、躁狂抑郁症药物,毒副作用轻微,长期使用患者耐受性好;属短链脂肪酸类HDACi。近年来,越来越多的证据表明VPA作为HDACi具有抗肿瘤的作用,可能机制在于其抑制了HDACs活性,导致组蛋白高乙酰化状态,使得染色质保持更加开放的构型,开放构型的染色质引起翻译沉默路径活化或通过募集一些阻遏蛋白抑制异常表达的基因,进而引起肿瘤细胞生长抑制,细胞周期阻滞及凋亡[12]。VPA对包括子宫内膜癌、乳腺癌和白血病在内的多种恶性肿瘤的生长均有抑制作用,并诱导其分化和凋亡。VPA对肿瘤细胞有选择性细胞毒性,而对正常造血细胞无严重毒性,且与多种化疗药物有协同作用。但是VPA是否对多发性骨髓瘤有抑制作用及对骨髓瘤发生的主要激活通路IL-6/JAK/STAT信号通路的作用尚不清楚。本研究对VPA是否能抑制人骨髓瘤细胞株RPMI8226和U266的增殖及在其对IL-6/JAK/STAT信号通路的作用进行探讨。
本研究发现VPA作用于RPMI8226和U266细胞12 h及24 h后,细胞增殖均出现不同程度的抑制,随VPA药物浓度升高,细胞增殖抑制作用逐渐增强,随作用时间延长抑制程度也逐渐增强。流式细胞术检测VPA处理后的细胞周期及凋亡率发现,随药物浓度升高,G1期细胞比例逐渐增多,S期细胞比例逐渐减少,细胞发生G0/G1期阻滞,凋亡增多,由此证实VPA对多发性骨髓瘤细胞有体外抑制作用。
本研究进一步检测了RPMI8226和U266细胞在VPA作用后IL-6/JAK/STAT通路中的IL-6浓度,STAT、Bcl-xL、Mcl-1、c-Myc、CCND1和VEGF表达水平,发现STAT通路各基因的mRNA表达下调,JAK2及STAT5总蛋白及磷酸化蛋白表达水平均显著降低。本研究显示不同浓度VPA作用于RPMI8226和U266细胞,能够从基因水平抑制STAT3和STAT5的表达,进而影响STAT3和STAT5蛋白的转录,抑制STAT3和STAT5的磷酸化,阻断其下游靶基因的转录,VPA浓度越高,抑制作用越明显。
本研究检测到IL-6/JAK/STAT信号通路靶基因的异常表达。而文献提示它们与肿瘤增殖密切相关;Bcl-xL和Mcl-1[13-14]是Bcl-2家族中重要的凋亡抑制蛋白,在正常组织中低表达,在人类恶性肿瘤组织中广泛表达,它们的异常表达可使已有基因异常改变的细胞逃避凋亡,与肿瘤的发生、发展及预后有关,与许多恶性肿瘤的化疗耐药性存在密切关系;原癌基因c-myc属myc基因家族中的一员,是调控细胞增殖的重要基因,与细胞的生长分化有关,对凋亡也起重要作用;CCND1基因编码的细胞周期素D1(cyclin D1)是一种重要的细胞周期调节因子,在乳腺癌、骨髓瘤等肿瘤中过度表达[15-16]。
本实验研究了VPA对骨髓瘤RPMI8226和U266细胞JAK/STAT信号通路的作用,但VPA抑制骨髓瘤是否还有其它信号途径的参与,以及这些信号通路与JAK/STAT信号通路的相互关系尚不清楚,VPA的多靶点抑制骨髓瘤作用尚待进一步研究。
[1] Klein B, Zhang X G, Jourdan M, et al. Paracrine rather than autocrine regulation of myeloma-cell growth and differentiation by interleukin-6[J]. Blood, 1989, 73(2): 517-526.
[2] Bauer K, Kretzschmar AK, Cvijic H,et al.Cyclophilins contribute to Stat3 signaling and survival of multiple myeloma cells[J].Oncogene, 2009, 28(31): 2784-2795.
[3] Heinrich PC, Behrmann I, Haan S, et al. Principles of interleukin(IL)-6-type cytokine signalling and its regulation[J]. Biochem J,2003, 374(Pt1): 1-20.
[4] 张祥忠,尹爱华,刘建华,等.丙戊酸钠诱导K562细胞周期阻滞和凋亡并上调p21WAF1基因mRNA的表达[J].中国病理生理杂志, 2008,24(9):1726-1729.
[5] Byun SS,Kim FJ,Khandrika L, et al.Differential effects of valproic acid on growth,proliferation and metastasis in HTB5 and HTB9 bladder cancer cell lines[J].Cancer Lett 2009,281(2):196-202.
[6] Wu Y,Guo SW.Histone deacetylase inhibitors trichostatin A and valproic acid induce cell cycle arrest and p21 expression in immortalized human endometrial stromal cells[J].Eur J Obstet Gynecol Reprod Biol,2008,137(2):198-203.
[7] 张国强,彭敏霞,王晔恺,等.地西他滨联合丙戊酸钠促进胃癌MGC-803细胞凋亡和G0/G1期阻滞的机制研究[J].中国病理生理杂志, 2012,28(10):1856-1860.
[8] Aggarwal BB, Sethi G, Ahn KS, et al. Targeting signal-transducer-and-activator-of-transcription-3 for prevention and therapy of cancer: modern target but ancient solution[J]. Ann N Y Acad Sci,2006,1091:151-169.
[9] Benekli M,Baer MR,Baumann H, et al. Signal transducer and activator of transcription proteins in leukemias[J]. Blood, 2003, 101(8): 2940-2954.
[10] Garcia R, Jove R. Activation of STAT transcription factors in oncogenic tyrosine kinase signaling[J]. J Biomed Sci,1998,5(2):79-85.
[11] Xi S, Gooding WE, Grandis JR.Invivoantitumor efficacy of STAT3 blockade using a transcription factor decoy approach: implications for cancer therapy[J]. Oncogene,2005,24(6):970-979.
[12] Richon VM,O’Brien JP.Histone deacetylase inhibitors:a new class of potential therapeutic agents for cancer treatment[J].Clin Cancer Res,2002,8(3):662-664.
[13] Futamura Y,Sawa R,Umezawa Y,et al.Discovery of incednine as a potent modulator of the anti-apoptotic function of Bcl-xL from microbial origin[J].J Am Chem Soc,2008,130(6):1822-1823.
[14] Warr MR,Shore GC.Unique biology of Mcl-1: therapeutic opportunities in cancer[J].Curr Mol Med,2008,8(2): 138-147.
[15] Millar EK,Dean JL,McNeil CM,et al.Cyclin D1b protein expression in breast cancer is independent of cyclin D1a and associated with poor disease outcome[J].Oncogene,2009,28(15):1812-1820.
[16] Marsaud V,Tchakarska G,Andrieux G,et al.Cyclin K and cyclin D1b are oncogenic in myeloma cells[J].Mol Cancer,2010,9:103.
EffectsofsodiumvalproateonRPMI8226andU266cellproliferationandIL-6/JAK/STATsignalingpathway
MA Yong-yong1, ZHOU Shu-juan1, GE Hang-ping2, CAI Fang-fang1, ZHANG Yu1, YU Kang1
(1DepartmentofHematology,TheFirstAffiliatedHospitalofWenzhouMedicalCollege,2WenzhouMedicalCollege,Wenzhou325000,China.E-mail:myy8635@126.com)
AIM: To investigate the effects of sodium valproate (VPA) on the proliferation of multiple myeloma cell lines RPMI8226 and U266 and the regulation of IL-6/JAK/STAT signaling pathway.METHODSThe cells were treated with different concentrations of VPA for 12 h and 24 h. The growth of RPMI8226 cells and U266 cells was detected by MTT assay. Apoptotic rates and cell cycle were analyzed by flow cytometry. The mRNA expression of STAT3, STAT5 and STAT target genes Bcl-xL, Mcl-1, c-Myc, CCND1 and VEGF was measured by RT-PCR. Western blotting analysis was used to determine the total proteins and protein phosphorylation levels of JAK2 and STAT5.RESULTSVPA inhibited the growth and induced the apoptosis of RPMI8226 cells and U266 cells in a concentration- and time-dependent manner. The levels of IL-6 in the culture supernatants of RPMI8226 cells and U266 cells treated with VPA were significantly higher than that in negative control group. VPA down-regulated the mRNA expression of STAT3, STAT5, Bcl-xL, Mcl-1, c-Myc, CCND1 and VEGF. After treated with VPA, the protein levels of p-JAK2, JAK2, p-STAT5 and STAT5 in RPMI8226 cells and U266 cells were significantly lower than those in control group.CONCLUSIONVPA inhibits the proliferation of PRMI8226 cells and U266 cellsinvitro. The modulation of IL-6/JAK/STAT signaling pathway may be involved in its potential mechanisms.
Valprote acid sodium; Multiple myeloma; Interleukin-6; JAK/STAT signaling pathway
R557+.3
A
10.3969/j.issn.1000- 4718.2013.05.011
1000- 4718(2013)05- 0833- 06
2012- 11- 19
2013- 03- 27
温州市科技计划(No. Y20100106)
△通讯作者 Tel: 0577-88069517; E-mail: myy8635@126.com
