毛细管电泳结合高效液相色谱-质谱用于天然产物活性成分的筛选
2013-10-22张艳梅康经武
张艳梅, 康经武
(中国科学院上海有机化学研究所,上海 200032)
由于具有化学结构多样性和良好的类药性质,天然产物一直是发现新药的重要资源[1-3]。据统计,1981年到2010年间,全球新发现的1073个小分子药物中,有64%来自天然产物或者天然产物衍生物[4]。在治疗癌症和传染病方面的新药中分别有60%和75%的新药源于天然产物以及衍生物[4-6]。
传统的天然产物活性成分研究的方法是先分离纯化,再进行结构鉴定和活性测试。这样的方法耗时费力,分离纯化过程常常需要几个月之久,也容易丢失具有活性的微量成分。近年来,开始采用活性追踪分离(bioassay-guided fractionation)策略,将活性测试贯穿于分离过程中,只分离有活性的组分,这样就可以减少不必要的工作量。然而分离纯化技术仍难与高通量筛选技术相匹配,这大大减慢了从天然产物中筛选活性成分的速度[3,7]。据统计,近20年来全球获得批准上市的天然产物类药物有逐渐减少的趋势[4]。因此,非常有必要充分利用高效液相色谱(HPLC)技术,结合微量的活性测试技术,发展能够实现高通量分离纯化、结构确证和活性筛选的天然产物活性成分研究的新技术。
HPLC与质谱(MS)的联用技术使得复杂成分的分析更为快捷,已经成为药物研究的重要工具之一[8-10]。毛细管电泳(CE)作为继 HPLC 之后又一强有力的分离分析方法,不仅具有高的分离效能和灵活多样的分离方式,而且也能成为药物筛选多样化的平台[11]。毛细管电泳介导的酶微反应器技术(EMMA)[12-14]实现了反应和检测的一体化,试剂消耗量为纳升级,反应分离速度快,自动化程度高,可以不受复杂样品基质的干扰,非常适合用于天然产物粗提物中活性成分的筛选[15-19]。
本文中我们报道一种将毛细管电泳活性测试与高效液相色谱-质谱(HPLC-MS)分离纯化相结合,应用于天然产物活性成分筛选的研究。CE可以作为微量的活性测试平台,而HPLC可以作为高效的天然产物分离纯化工具。本文选择乙酰胆碱酯酶(ACHE)和对ACHE有抑制作用的黄连粗提物[18]为实验模型,验证所发展的筛选体系。利用半制备HPLC将黄连粗提物中的成分分离纯化,再用EMMA对分离得到的微克级组分进行活性测试,用二级质谱确定活性成分的结构。与传统的筛选方法相比,我们发展的方法集成了分离纯化和活性筛选,这将大大缩短筛选天然产物中活性成分的时间,同时也能够用于中药有效成分的研究。
1 实验部分
1.1 仪器与试剂
Agilent毛细管电泳仪,Agilent 1260液相色谱仪(Waldbron,德国),LCQ Fleet离子阱质谱仪(Thermo Scientific,美国),Millipore-Simplicity UV超纯水系统(Millipore,MA,美国)。熔融石英毛细管(SGE Analytical Science,澳大利亚),50 μm i.d.,370 μm o.d.,柱长 34.5 cm,有效长度 26 cm。
乙酰胆碱酯酶、盐酸硫代乙酰胆碱(AThCh)购自Sigma-Aldrich,小檗碱(berberine)、药根碱(jatrorrhizine)、黄连碱(coptisine)、巴马汀(palmatine)购自阿拉丁,木兰花碱(magnoflorine)、表小檗碱(epiberberine)、非洲防己碱(columbamine)、甲基黄连碱(worenine)购自上海彩佑实业有限公司,异丙醇、四硼酸钠和β-环糊精均为AR级,购自国药集团化学试剂有限公司,乙腈(HPLC级)购自 Merck,甲酸(HPLC级)购自TEDIA,黄连饮片购自上海雷允上药店。
1.2 样品配制
黄连粗提物的制备:取10 g黄连饮片,磨成细粉,加入50 mL 70%(v/v)乙醇超声提取3次,每次45 min,所得提取液经抽滤后用旋转蒸发仪浓缩,然后抽真空干燥待用。用于分离纯化的黄连粗提物溶液的配制:称取黄连粗提物30 mg,加入3 mL含50%(v/v)异丙醇的水溶液配制成为10 g/L的溶液,涡旋混合,超声溶解2 min,以12000 r/min离心3 min。用于活性测试的溶液的配制:黄连粗提物、各种标准品、半制备色谱柱纯化的组分用50%(v/v)异丙醇水溶液溶解并用水配成质量浓度为0.25 g/L的溶液。
其他溶液由Millipore纯化系统净化的超纯水配制,所有缓冲溶液使用前需用0.45 μm滤膜过滤。所有溶液使用时均需新鲜配制。
1.3 黄连粗提物的HPLC分析条件及质谱条件
分析色谱柱为Agilent XDB-C18(250 mm×4.6 mm,5 μm);流动相A相为10 mmol/L甲酸铵(含0.1%(v/v,下同)甲酸)水溶液,B相为乙腈(含0.1%甲酸)。采用30 min梯度洗脱:0~6 min,5%B ~20%B;6~25 min,20%B ~30%B;25~30 min,30%B~100%B;流速为1 mL/min。黄连粗提物的质量浓度为1 g/L;检测波长为345 nm,进样体积为10 μL。
电喷雾电离正离子模式,喷雾电压为4.5 kV,鞘气流速12 L/min,辅助气流速1.5 L/min,金属毛细管温度为320℃,金属毛细管电压为35 V,二级质谱碰撞能量为36 V。
1.4 黄连粗提物分离纯化的色谱条件
半制备色谱柱为Thermo Scientific ODS-C18(250 mm×10 mm,5 μm);流动相 A相为H2O(含0.1%甲酸),B相为乙腈 (含0.1%甲酸)。采用20 min梯度洗脱:0~20 min,25%B~32%B;流速为3.5 mL/min。黄连粗提物的质量浓度为10 g/L;检测波长为345 nm,进样体积为50 μL。
1.5 黄连粗提物中活性成分筛选的实验步骤和电泳条件
新毛细管柱用0.1 mol/L NaOH溶液处理30 min,再分别用去离子水、30 mmol/L硼砂缓冲溶液冲洗5 min。每次上样分析前用1 mol/L NaCl、0.1 mol/L NaOH、去离子水、缓冲液冲洗3 min。本文中乙酰胆碱酯酶抑制剂筛选的实验步骤如图1所示:(1)将0.4 g/L ACHE和底物AThCh(含或不含抑制剂)溶液分别以2000 Pa×4 s的压力依次导入毛细管进样端。在每次进样前设定进样程序,使毛细管柱进口端浸入盛有去离子水的样品瓶中5 s以防止样品之间的污染。(2)在毛细管两端加上1 kV×15 s的电压使酶溶液和底物溶液区带充分混合。(3)在毛细管两端加上15 kV的电压将未反应底物和产物在线分离,通过紫外检测可直接测定产物巯基胆碱(TCh)的面积,即可以表征酶的活性。对于抑制剂的筛选,在底物溶液中加入一定量的待筛选化合物,通过产物TCh峰面积的减小来判定待筛选化合物是否具有抑制酶活性的作用。
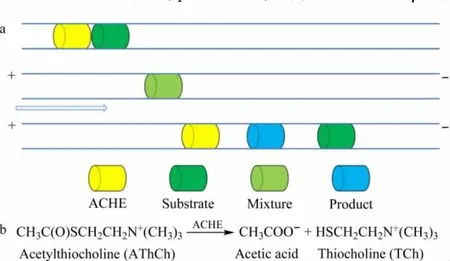
图1 (a)电泳介导的酶微反应器(EMMA)测试ACHE活性的示意图和(b)ACHE催化水解AThCh的反应方程式Fig.1 (a)Schematic illustration of EMMA procedure for ACHE activity assay and(b)ACHE catalyzed reaction
经过优化后的电泳条件为:毛细管总长为34.5 cm,有效长度为26 cm,柱内径为50 μm;缓冲溶液为 30 mmol/L 硼砂(pH=8.00),含 15 mmol/L β-环糊精;进样2000 Pa×4 s;分离电压为15 kV;柱温37℃;检测波长230 nm;酶质量浓度0.4 g/L;硫代乙酰胆碱浓度为10 mmol/L(含20 mmol/L硫酸镁);混合时间15 s;孵育时间0 min。
2 结果与讨论
2.1 黄连粗提物成分的HPLC分析及半制备分离条件的建立
本文采用HPLC-MS对黄连粗提物溶液(1 g/L)进行分析,通过改变流动相中甲酸的含量,缓冲盐的类型(乙酸铵、甲酸铵)及其浓度,最终确定用于HPLC分析的最佳流动相组成为10 mmol/L甲酸铵水溶液-乙腈(各含0.1%甲酸)。UV检测器检测波长为345 nm,质谱检测采用正离子模式。所得到的色谱图和总离子流图见图2。黄连粗提物中的主要成分是异喹啉生物碱。我们得到的黄连粗提物的HPLC-MS/MS色谱图有13个峰,其中8个主要峰经质谱鉴定,分别是木兰花碱(峰3)、药根碱(峰6)、表小檗碱(峰7)、非洲防己碱(峰8)、黄连碱(峰9)、甲基黄连碱(峰10)、巴马汀(峰11)、小檗碱(峰12),它们的结构式如图3。

图2 黄连粗提物的HPLC分析Fig.2 HPLC analysis of Rhizoma coptidis extract
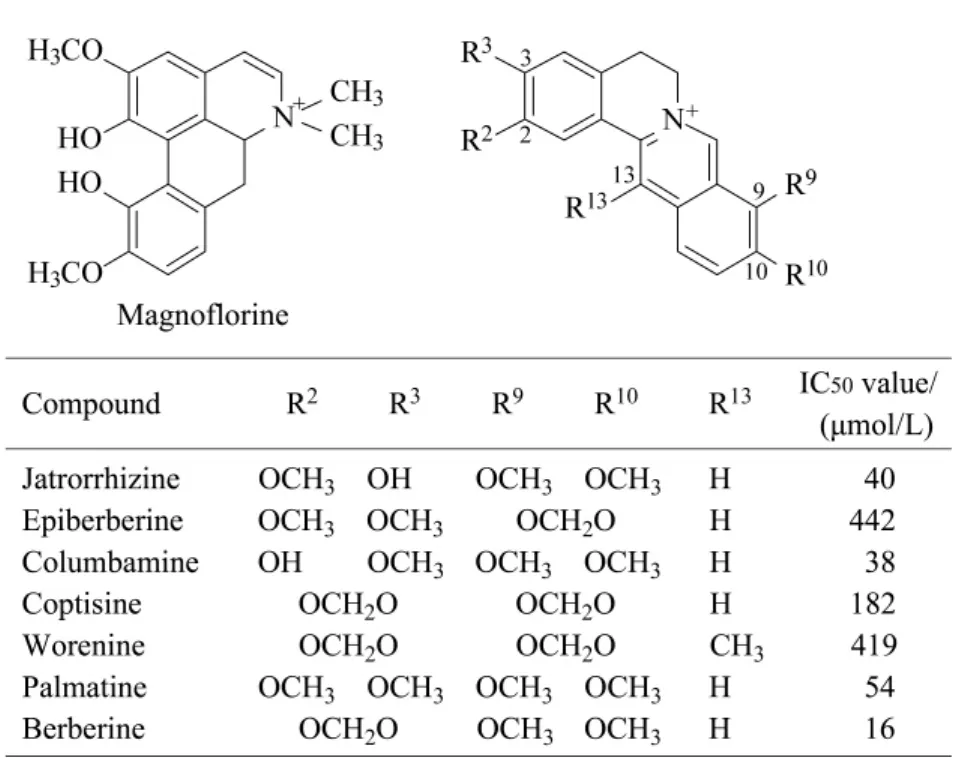
图3 黄连粗提物中部分生物碱的结构式及对ACHE的IC50值Fig.3 Structures of some alkaloids of Rhizoma coptidis extract and IC50values for ACHE inhibition
由于使用半制备HPLC对黄连粗提物进行分析时,进样量增加,因此除了图2中经质谱鉴定的8个峰之外(其中7和8号峰重叠在一起,视为一个组分),其他5个峰的紫外响应信号得到增强,其色谱分离如图4a所示。

图4 黄连粗提物的(a)半制备色谱分离图及(b)分离制备的13个组分对ACHE的抑制率Fig.4 (a)Chromatogram of semipreparative HPLC analysis of Rhizoma coptidis extract and(b)inhibition rates of thirteen fractions of Rhizoma coptidis extract on ACHE
采用本课题组发展的乙酰胆碱酯酶抑制剂的筛选方法[18]对黄连粗提物及HPLC分离制备的化合物进行活性测试,其电泳分离图如图5所示,从图5中可明显看出底物AThCh、抑制剂和产物TCh都达到了基线分离,并且当筛选样品底物溶液中加有黄连粗提物时,其产物峰面积与空白相比明显降低。将分离纯化的每个组分用真空离心干燥仪干燥后,用50%(v/v)异丙醇水溶液重新溶解,用EMMA分别测定各组分对ACHE的抑制作用,各个组分的抑制作用百分比如图4b所示。结果表明,在各组分质量浓度为0.25 g/L下,除了组分1、2、3对ACHE的活性没有抑制作用外,其余的9个组分均有不同程度的抑制作用,其抑制作用由强到弱排序为:组分12>11>7+8>6>10≈ 9≈ 5>13>4。

图5 ACHE抑制剂筛选的电泳分离图Fig.5 Electropherograms for screening the ACHE inhibitor
2.2 活性化合物组分的验证
我们用8个化合物的标准品进行活性测试验证,发现除了木兰花碱没有抑制作用以外,其余的7种化合物均有抑制作用,这个结果与黄连粗提物分离制备的组分的抑制作用相吻合。我们测得的这7种化合物对乙酰胆碱酯酶的抑制曲线如图6所示,测得这7种化合物的IC50值见图3。
结果显示,木兰花碱这种非小檗碱型生物碱对ACHE没有抑制作用。7种小檗碱型生物碱的2、3、9、10、13位有着不同的取代基(见图3),其取代基可能为-OH、-OCH3、-OCH2O-、-CH3。通过对比各化合物的IC50值可知,不同的取代基将会影响化合物的抑制活性。

图6 黄连粗提物中7种生物碱对ACHE的抑制曲线Fig.6 Inhibition curves of ACHE in the presence of seven alkaloids
比较小檗碱和巴马汀以及表小檗碱和黄连碱,前者的抑制作用为后者的3倍多以及2倍多,之所以抑制作用有如此大的差异,主要是因为R2、R3不同,表明R2、R3处的-OCH2O-对抑制作用有着增强的作用。当巴马汀的R3或R2取代基的-OCH3变为-OH时,化合物相应变为药根碱、非洲防己碱,其抑制作用有所增强,表明了 R2、R3处的-OH对ACHE的抑制作用也有增强的作用。R9、R10对ACHE的抑制作用同样具有重大的影响。当巴马汀的 R9、R10处的-OCH3变为-OCH2O-,其对 ACHE 的抑制作用降低至不足原来的1/8;当小檗碱的R9、R10处的-OCH3变为-OCH2O-,其对ACHE的抑制作用降低至不足原来的1/11,这一结果表明R9、R10处的-OCH3对ACHE的抑制作用有着增强作用。R13同样影响对ACHE的抑制作用,当黄连碱的R13变为-CH3,其抑制作用降低至不足原来的1/2,这一结果表明R13处的-CH3对ACHE的抑制作用有减弱效果。总之,所得到的结果表明了木兰花碱、表小檗碱、黄连碱、甲基黄连碱没有或者具有较弱的抑制作用,而药根碱、非洲防己碱、巴马汀、小檗碱具有较强的抑制作用。
3 结论
本文建立了CE的活性测试与HPLC-MS的快速分离相结合的技术用于筛选天然产物活性成分,可以实现天然产物活性成分的分离纯化、活性测试和结构鉴定。HPLC-MS具有较高的分离效能,每次分离制备仅需20 min;CE可以较快地进行活性测试,每次分离仅需2.5 min。纳升级的酶用量使筛选成本显著降低,纳升级的待筛化合物用量减轻了对天然产物分离制备的工作量。将分离纯化-活性筛选相结合,可以适用于复杂样品,可以高效、有选择性地对天然产物进行活性成分的筛选和结构鉴定。本工作建立的CE/HPLC-MS筛选体系为高通量快速筛选、寻找先导化合物以及开发新药提供了新技术。
[1]Koehn F E,Carter G T.Nat Rev Drug Discov,2005,4(3):206
[2]Harvey A L.Drug Discov Today,2008,13(19/20):894
[3]Li J W H,Vederas J C.Science,2009,325(5937):161
[4]Newman D J,Cragg G M.J Nat Prod,2012,75(3):311
[5]Wu S,Yang L,Gao Y,et al.J Chromatogr A,2008,1180(1/2):99
[6]Shu Y Z.J Nat Prod,1998,61(8):1053
[7]Lam K S.Trends Microbiol,2007,15(6):279
[8]Eldridge G R,Vervoort H C,Lee C M,et al.Anal Chem,2002,74(16):3963
[9]Mishra K P,Ganju L,Sairam M,et al.Biomed Pharmacother,2008,62(2):94
[10]Deng G,Sanyal G.J Pharm Biomed Anal,2006,40(3):528
[11]Glatz Z.J Chromatogr B,2006,841(1/2):23
[12]Bao J,Regnier F E.J Chromatogr A,1992,608(1/2):217
[13]Regnier F E,Patterson D H,Harmon B J.TrAC-Trends AnalChem,1995,14(4):177
[14]Hai X,Yang B F,Van Schepdael A.Electrophoresis,2012,33(1):211
[15]Belenky A,Hughes D,Korneev A,et al.J Chromatogr A,2004,1053(1/2):247
[16]Iqbal J,Burbiel J C,Müller C E.Electrophoresis,2006,27(12):2505
[17]Guo L P,Jiang T F,Lv Z H,et al.J Pharm Biomed Anal,2010,53(5):1250
[18]Tang Z M,Wang Z Y,Kang J W.Electrophoresis,2007,28(3):360
[19]Wang T D,Kang J W.Electrophoresis,2009,30(8):1349
