食品安全分析样品前处理-快速检测联用方法研究进展
2013-10-22黄怡淳丁炜炜张卓旻李攻科
黄怡淳, 丁炜炜, 张卓旻, 李攻科
(中山大学化学与化学工程学院,广东广州 510275)
近年来,“染色馒头”、“毒奶粉”等食品安全问题层出不穷,食品安全问题正受到人们前所未有的关注。食品中痕量非法添加剂、农药、兽药、抗生素、致癌毒素等有害物质严重威胁人类的身体健康,对其含量进行快速准确分析对食品安全具有重要意义。
食品安全分析往往具有待测样品量大、时效性强的特点。快速检测技术(以下简称“快检技术”)比通常的检测技术具有更快的检测速度,且装置便携、易于实现在线现场检测,在食品安全分析中发挥了重要作用。传感器技术、可视化技术、光谱技术、酶联免疫技术、便携气相色谱技术等是目前常用的食品安全快检技术,但它们的选择性、灵敏度、重现性较差,准确度不高,大部分快检技术在实际食品安全分析过程中仅能实现定性筛查,难以准确定量。引起快检测试结果的精准度波动与灵敏度不足的主要原因在于复杂基体中目标物的检测选择性差。样品前处理技术利用物质的物理、化学和生物学等方面性质的差异,将待测物从不同基质中分离富集出来。在分析过程中采用适当的样品前处理技术,可有效浓缩待测试样中的目标物,并降低基体干扰,从而提高后续分析检测过程的灵敏度和准确度。因此,将高效的样品前处理技术与快检技术联用,有效地降低食品基体的干扰,提高待测试样中目标物的浓度,是发展选择性好、准确度高、可定量的食品安全快速检测新技术的关键。本文概述了近年来食品安全快速检测方法的研究进展,重点综述了食品安全分析中样品前处理-快速检测联用技术的研究进展,以期为发展食品安全现场定量快速检测新技术提供参考。
1 食品安全快速检测方法的研究进展
快检技术是基于分析物某一特性而建立的快速筛选检测方法,比常规的化学分析及仪器分析技术具有检测速度快、装置便携、可现场检测等特点,能较好地满足食品安全分析样品量大、时效性强的特点需求,从而受到广泛关注。传感器技术、可视化技术、便携光谱技术、酶联免疫分析技术及便携气相色谱技术等是目前应用较广的食品安全快检分析方法。
1.1 传感器技术
传感器技术通过将待测物含量信息转化成对应的传感信号如光、电信号等,实现痕量待测物的即时检测。半导体传感器、电化学传感器、生物传感器等在食品安全快检中具有重要应用,表1总结了近年来传感器快检技术在食品安全分析中的典型应用。
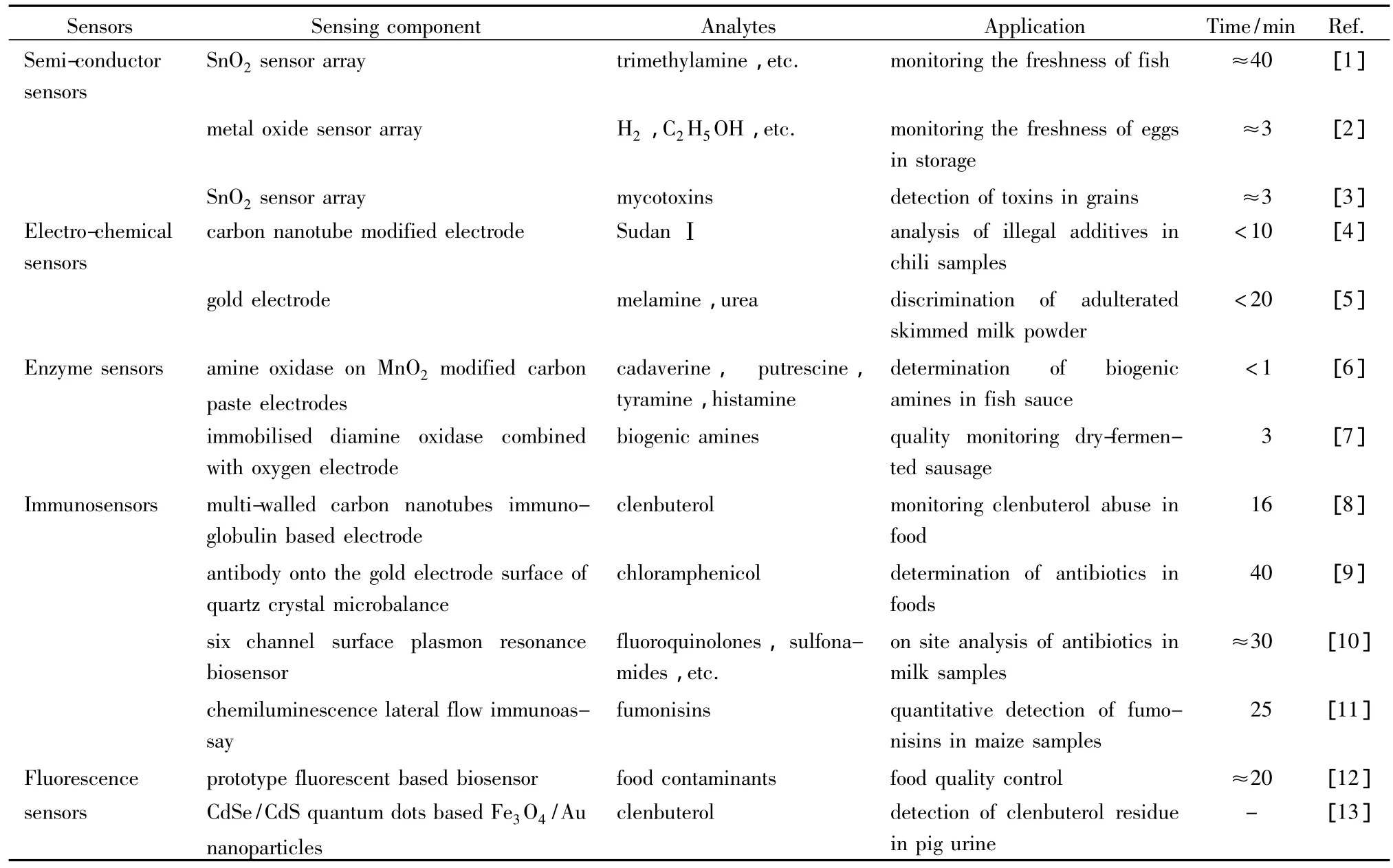
表1 传感器快检技术在食品安全分析中的典型应用Table 1 Typical applications of sensors based rapid detection technology in food security analysis
半导体传感器主要用于食品风味物质、农药、兽药残留的快检。食品风味物质的鉴定对食品质量评价具重要作用。Aparicio等[14]联合Alpha-MOS FOX 4000阵列传感器与气相色谱(GC)对复杂的食品风味进行快速分析,20 min可完成橄榄油中的28种挥发性成分的检测。Lan等[15]采用空气传感器对牛肉气味进行快检,用于判别牛肉的新鲜度。电化学传感器技术主要用于食品中痕量非法添加剂及农药、兽药残留的快速检测。Wu等[4]制备了一种基于多壁碳纳米管薄膜的电化学传感器用于辣椒样品中苏丹红染料的快速定量分析,吸附苏丹红Ⅰ后电信号显著提高,线性范围介于0.01~1.0 mg/L,检测过程耗时少于10 min。Pundir等[16]在铟锡氧化物修饰的玻璃膜上电沉积固载乙酰胆碱酶的Fe3O4纳米颗粒/多壁碳纳米管涂层,并将此传感器用于痕量农药残留的快检,检出限达0.1 nmol/L。食品安全分析中常用的生物传感器包括酶传感器和免疫传感器。由于酶具有专一性、高效性,故以酶作为传感敏感器件的酶传感器具有较好的选择性、灵敏度,且作用时间短,但酶的作用环境要求苛刻,使其在实际样品分析中的适用性以及稳定性不理想。Urraca等[17]设计的流动-酶传感器装置可实现谷类等实际样品中玉米烯酮的高灵敏自动化快速检测,约25 min可完成试样的全自动检测。Gan等[18]将氯霉素偶联牛血清白蛋白修饰的Fe3O4/Au纳米粒子组装在Nafion/碳纳米管/二茂铁复合物膜上研制了一种新型安培免疫传感器,在磷酸盐缓冲溶液环境中可实际用于牛奶样品中氯霉素快检,回收率介于88%~102%。Kim等[19]研制了一种简单、快速的化学发光-免疫膜传感器系统,5 min内可实现肉类及牛奶样品中痕量氯霉素的快检,在大量样品食品安全初筛中具有重要意义。虽然传感器技术已能初步用于食品安全快检,但因其选择性低、重现性差和使用寿命短等限制,仍难以实现准确、稳定的定量快速分析。荧光传感器无需参照体系、操作简便、仪器便携,在农药残留检测、毒素分析等领域应用广泛。Pitchumani等[20]研制了一种 Eu(Ⅲ)复合物荧光传感器,在对氧磷、甲基对氧磷、对硫磷、杀螟松等有机磷农药中对杀螟松具有良好的选择性,检出限达10-12mol/L。量子点荧光传感器是基于量子点受激前后荧光变化的传感快速检测技术。Yu等[21]用硫普罗宁作为稳定剂研制了水溶性的高荧光CdTe/CdS量子点传感器,对百草枯具有特异性传感作用。Wang等[13]在磁性核壳Fe3O4/Au纳米粒子载体上采用CdSe/CdS量子点作为荧光标记物,建立了猪尿中克伦特罗的荧光免疫快检方法,线性范围介于0.5~20000 pg/mL。
1.2 可视化技术
可视化快检技术是根据介质与目标物作用引起的特定颜色变化进行快速定性、定量分析的快检技术。可视化快检技术具有直观、便携、快速等优点,在大批量样品抽检中发挥着重要作用。食品安全分析常用的可视化快检技术包括显色速测技术、测试条技术、可视化荧光检测技术等。
显色速测技术是依据显色反应的颜色变化对目标物进行快速分析的快检技术,不同的显色反应适用于多种类别的目标物。Ding等[22]基于甲醛与羟胺反应得到的硫酸与甲基黄的显色反应建立了甲醛的高选择性可视化快检方法,一系列的挥发性化合物中仅甲醛可产生此颜色变化,检出限达50 μg/L。基于酶联免疫反应或者化学反应的测试条技术是另一种便携的可视化快检技术,在农药残留[23]、霉菌毒素[24]、非法添加剂[25]等食品安全快检分析中应用广泛。Wu等[26]基于黑腹果蝇乙酰胆碱酯酶和吲哚乙酸酯的酶传感器研制的可视化测试条,适于有机磷、氨基甲酸酯等农药残留的现场快检。但测试条技术检出限较高、易出现假阳性结果,使其在需要准确定量的实际样品快检分析中受到一定的限制。可视化荧光检测技术具有响应快、灵敏度高等优势。Mignani等[27]制备了用于指示牛奶中M1黄曲霉素含量的便携式荧光计,该荧光计是一种直观、简易的半定量食品安全快检装置,当样品中黄曲霉素含量分别处于安全范围(低于25 ng/L)、25~50 ng/L及高于50 ng/L时,荧光计则对应显示为淡黄色、土黄色和橙红色。Zhu等[28]研制了一种基于发光氧化石墨烯的新型比率荧光纳米复合探针,在紫外光照下随着Fe2+浓度的增加,探针的荧光颜色相应地从红色变为蓝色,从而实现对 Fe2+的可视化快速检测。
1.3 便携光谱技术
便携式光谱仪由传统光谱仪发展而来。经过光路系统的优化设计,便携式光谱仪体积更小、便于携带、适于现场分析。目前,便携光谱技术中表面增强拉曼散射(surfaceenhanced Ramanscattering,SERS)技术及近红外光谱技术(near infrared spectrum,NIR)是常用的食品安全快检方法。
拉曼效应是在1928年由科学家Raman发现的[29],SERS技术是基于粗糙贵金属表面引起的被测物拉曼强度增强的高灵敏快检技术,其测定时间仅需数秒钟。目前,SERS技术已用于三聚氰胺[30]、苏丹红染料[31]等食品非法添加剂以及农药、兽药残留[32]等食品中痕量有害物质的快检。Yao等[33]建立了基于金纳米粒子SERS技术分析硝基呋喃抗生素的快检方法,以1008、1162 cm-1为特征峰可对呋喃妥因、呋喃它酮进行定性判别,检出限达5 mg/L。然而,适于 SERS法检测的对象较少,且SERS快检过程基体干扰严重,因此目前SERS技术尚未广泛用于实际样品分析。NIR技术具有分析速度快、样品无污染、分析成本低等优势,依据分析物的近红外吸收光强度可进行定量分析,20世纪50年代中后期以来NIR技术开始广泛应用于农副产品中痕量农药残留等有害物质的快检。Jia等[34]采用傅里叶转换NIR法测定鱼粉中的三聚氰胺,以6873~5697 cm-1波数段作为三聚氰胺特征峰进行定量分析,方法的准确分类率达 99.5%。Soto-Ca'mara等[35]通过NIR检测硬质小麦中的杀菌剂残留,准确率达84%。Prado等[36]采用NIR法对土壤中的咪唑烟酸进行快速检测,与高效液相色谱(HPLC)检测结果相符。然而,便携光谱技术难以用于多目标物分析,且稳定性较差,极易受基体影响,未来的研究中还需进一步结合样品前处理技术,提高NIR技术在复杂食品样品分析中的准确性。此外,紫外[37]、瑞利散射[38]、荧光[39]等光谱技术也逐步应用于食品安全快检中。但是,紫外检测对基质纯度要求高,荧光分析中荧光物质寿命短,瑞利散射光信号弱、易受干扰等特点使它们在实际食品安全快检中仍受到限制。
1.4 酶联免疫检测技术
基于专一性酶抗体-抗原免疫反应的酶联免疫检测技术(enzyme-linkedimmunosorbentassay,ELISA)具有高选择性,已初步应用于食品中偶氮染料[40]、三聚氰胺[41]、莱克多巴胺[42]、邻苯二甲酸二丙酯[43]等非法添加剂,恩诺沙星[44]、唑烷酮类[45]等药物残留,伏马菌素[46]、黄曲霉素[47]等毒素的定量快检。然而,ELISA的抗原抗体反应易受基体干扰,测试结果易出现假阳性/假阴性。此外,对不同目标物其特定的抗原抗体的研究周期长、成本偏高。
1.5 便携式气相色谱技术
气相色谱技术中小型气相色谱技术及快速气相色谱技术(high-speed gas chromatography,HSGC)作为便携式气相色谱技术是常见的食品安全分离快检技术,其便携、快速、高效等特点使其在食品安全现场样品的分离检测中具有独特优势,一般仅十几分钟即可完成复杂食品中多组分目标物的分离分析。目前,便携式气相色谱技术在食品风味鉴定[48]、农药残留检测[49]等相关食品安全分析研究中已有报道。但便携气相色谱技术对待测样品要求高,食品色素干扰严重,样品前处理手段繁琐等问题限制了其在食品安全分析中的进一步应用。
2 样品前处理-食品安全快速检测联用方法的研究进展
目前,复杂食品样品快检分析的瓶颈在于实际样品基体干扰严重,而快检方法对目标物的选择性不高,导致快检结果的准确度较低。将高效的样品前处理技术与食品安全快检技术联用,可以有效减少基体干扰对快检过程的影响,提高快检准确度,是发展准确定量食品安全快检技术的关键所在。适于食品安全快检技术联用的样品前处理技术应该具有选择性好、快速简便、方便与后续快检技术联用等特点。目前,固相萃取、微萃取以及磁分离等样品前处理技术已能与食品安全快检技术联用,建立适于复杂食品样品分析的快检方法。
2.1 固相萃取技术
固相萃取技术(solid phase extraction,SPE)基于选择性吸附目标物、洗脱杂质分子的液相色谱法分离原理,能有效降低复杂基质干扰、提高快检方法的灵敏度与准确度。Wang等[50]将商用C18SPE与具有选择性的ELISA法联用建立痕量非法添加剂去甲睾酮的快检方法,并成功用于抗疲劳功能食品中甲睾酮的分析。Amin等[51]采用C18SPE膜富集5-(4-氯苯基偶氮)-6-羟基嘧啶二酮与Ni(Ⅱ)快速反应形成的复合物,结合紫外-可见分光光度法(UV-Vis)可快速检测食品样品中痕量Ni(Ⅱ),方法富集倍数达100,定量下限达0.01 μg/mL。
除了商用SPE小柱,许多研究通过研发新型SPE小柱与相应快检技术联用,进一步提高了食品安全分析方法的选择性与适用性。Afkhami等[52]研制了2,4-二硝基苯肼修饰的氧化铝纳米粒子SPE小柱,并用于食品中痕量甲醛的高效富集,有效提高了食品中甲醛快检的选择性。Soylakc等[53]制备了磺化四苯基卟啉合锰[Mn(TPPS)OAc]键合离子交换树脂IRA 400的SPE小柱,对药物残留硫氰酸盐具有选择性富集分离能力,有效提高了复杂样品中痕量硫氰酸盐分光光度快检方法的准确度。基于空穴-模板选择识别作用研制的分子印迹材料填充的SPE(简称MISPE)具有很好的萃取选择性和富集能力,与相应的快检技术联用,大大提高了食品安全快检技术用于实际样品分析过程的选择性、灵敏度及准确度。Xu等[54]采用自制的敌百虫分子MISPE与化学发光传感器联用,建立了果蔬样品中敌百虫农药残留在线快检方法,在8 min内可实现实际样品中敌百虫农药残留的准确检测。Guo等[55]基于孔雀石绿对鲁米诺发光信号的猝灭效应,设计了一种MISPE与化学发光联用的分析方法,可实际用于鱼肉中孔雀石绿的定量快检。Yu等[56]基于L-苯基丙氨酸对荧光的猝灭效应,建立了新型MISPE-流动注射-电化学发光联用分析鸡蛋蛋白、鸡肉样品中L-苯基丙氨酸的快检方法,有效提高了快检方法的选择性。
基质分散固相萃取(matrix solid-phase dispersion,MSPD)是一种新型SPE技术。MSPD采用涂渍有C18等聚合物的固相萃取材料与样品一同研磨后获得的半干状态混合物作为填料装柱,提取样品后采用淋洗液洗脱吸附柱上的待测物进行检测[57]。MSPD适用于固体、半固体、黏稠样品的萃取,无需样品匀浆、沉淀、离心等操作,减少了前处理中待测物的损失,处理速度快,易与便携式光谱及色谱等检测技术联用。目前,MSPD在食品中多药物残留、农药残留同时分离分析的前处理上发挥着重要作用。Singh等[58]以弗罗里硅土为分散剂,采用MSPD-GC-电子捕获检测器联用技术建立了蔬果、谷物、药用植物等多种食品中六氯环己烷异构体的快检方法,检出限达ng/g级别。Tang等[59]采用氨丙基分散介质的MSPD法富集山茶油中的15种有机磷农药残留,并与GC-火焰光度检测器联用进行定量快检,回收率介于71.5%~104%。
分散固相萃取技术(dispersive solid-phase extraction,DSPE)是2003年提出的适用于食品农药残留分析的新型前处理技术,因其具有快速、简单、便宜、有效、可靠和安全的特点,故也称为QuECh-ERS方法。QuEChERS法通过溶剂提取食品中的待测物,在提取液中直接加入除水剂及固相吸附剂进行除水、净化,离心后取上清液直接进行分析,是一种省时、绿色、成本低的新型前处理技术。QuECh-ERS法在食品安全快检中常与便携式气相色谱快检技术联用。Tyagi等[60]采用QuEChERS与气相色谱(GC/MSD/μECD/FPD)、液相色谱-质谱技术联用建立了果蔬样品中59种农药残留的快速分析方法,该法仅需10 g样品,检出限低至0.001~0.01 mg/kg。Liu等[61]采用异丙醇为QuEChERS提取溶剂,与GC联用,有效降低了复杂样品基质(蛋白质等)的干扰,提高了鱼肉中拟除虫菊酯的提取率。Srijaranai等[62]将改进后的QuEChERS方法同浊点萃取法结合提取蔬菜样品中的西维因,并采用分光光度法进行快速分析,该联用方法集样品富集、净化与一体,检测速度快、分析灵敏度高。
2.2 微萃取技术
液相微萃取(liquid phase microextraction,LPME)与固相微萃取技术(solid phase microextraction,SPME)具有介质体积小、萃取平衡时间短、采样装置便携、操作简便、适于现场采样等特点,且易与后续食品安全快检技术联用实现复杂实际样品痕量组分的快检分析。
2.2.1 液相微萃取
目前,与食品安全快检联用的LPME技术主要包括悬滴微萃取(single drop microextraction,SDME)及分散液液微萃取(dispersive liquid liquid microextraction,DLLME)。SDME是采用悬挂在进样器针端的小体积有机相液滴对大体积样品溶液中目标物进行富集、萃取的一种前处理技术,装置简单、溶剂使用量少。Wen等[63]将“绿色溶剂”离子液体1-丁基-3-甲基咪唑六氟磷酸盐作为SDME萃取剂,结合分光光度法建立了茶叶以及脱脂奶粉样品中痕量重金属Cu2+的快检方法,检出限达0.15 μg/L。Verma等[64]将二苯基联苯二脒溶于单滴二氯甲烷SDME萃取剂,基于二苯基联苯二脒与钒酸盐的键合作用进行萃取,结合傅里叶红外光谱技术建立钒酸盐的快检方法,并实际用于生物环境样品的分析。Hu等[65]采用静态SDME富集水样以及果汁样品中的有机磷农药残留,结合HSGC技术建立了简单、高效的快检方法,加标回收率介于77.7%~113%。
Rezaee等[66]于2006年提出了 DLLME 技术,在样品溶液中加入少量萃取剂混合分散得到乳浊液,再经离心分层后取微量萃取剂进样分析。DLLME操作简便、适用性广,经常与光谱技术联用实际用于食品安全快检。Filik等[67]基于硫离子与酞二醛的显色反应,采用DLLME富集衍生化产物异吲哚并结合光度法实现灵敏的选择性分析,富集因子达133。Wen等[68]采用 DLLME-分光光度法联用技术建立了大米、茶叶等食品中痕量Cd(Ⅱ)的快检方法,该方法环境友好、灵敏度高,富集因子达3458。Zarei等[69]基于福林试剂与氮杂环丙烷的衍生化反应,采用DLLME富集衍生化后的显色产物,结合UV-Vis技术建立了4种食品兴奋剂的快检方法。DLLME也可与便携式GC联用从而实现快速分离富集。Kokya等[70]采用DLLME-HSGC联用技术分离分析饮料中的防腐剂山梨酸、苯甲酸,检出限分别达0.2及0.5 mg/L。
2.2.2 固相微萃取
固相微萃取是一种环境友好的样品前处理技术,不用或少用有机溶剂;集富集、萃取、进样于一体,操作简便;易于自动化及与其他技术如气相色谱等实现在线联用。目前,以SPME纤维及SPME薄膜技术为代表的固相微萃取技术常与便携式HSGC联用,用于建立食品安全快检方法。Verzera等[71]采用顶空SPME-HSGC联用技术建立了聚苯乙烯包装的酸奶样品中痕量苯乙烯、乙苯含量的快检方法,其采样、萃取、检测过程仅15 min。复旦大学邓春晖等[72]采用聚二甲基硅氧烷/二乙烯苯SPME-GC联用技术对番茄植物释放的3种醛类进行衍生化快速检测。SPME与聚合物表面声波传感器联用可用于食品风味物质的实时监测,对食品质量控制具有重要意义。目前,SPME-聚合物表面声波传感器联用技术已经实际用于果蔬生熟程度、糖异味的高效监测[73],是一种低成本、便携的现场快检方法。SPME薄膜技术将SPME萃取相固定为膜形态,其稳定性、萃取率优于SPME纤维[74]。由于SPME膜可卷曲,能方便地与后续的红外、色谱等检测技术联用,因此扩大了食品安全快检技术的适用范围。
2.3 磁分离技术
磁分离技术一般采用具有磁性的富集材料为前处理介质,在前处理过程完成后采用磁铁吸引即可实现富集材料与样品基体的分离。磁分离技术不仅减少了离心、过滤等样品前处理步骤,降低了样品损失率、缩短了分析时间,而且易于与食品安全快检技术联用,提高了食品安全快检技术的准确度和精密度。Raba等[75]将赭曲霉素单源抗体固载在磁性纳米粒子上,采用免疫检测法分析苹果中的赭曲霉素,过程仅需 16 min。Jing等[76]基于硫醇功能化的Fe3O4@Ag核壳磁性SERS增强基底建立分析多环芳烃类的SERS原位快检方法,采用高饱和磁化强度的基底实现了多环芳烃从样品基质中的快速磁分离,检出限介于 10-5~10-7mol/L。Luo 等[77]采用核壳结构的磁性磺胺嘧啶分子印迹纳米粒子作为富集介质,结合流动注射-化学发光检测,建立了磺胺嘧啶高选择性、高灵敏度的定量快检方法。Sandhu等[78]研制了一种磁光生物传感器,根据其自组装旋转功能化超顺磁性微球的光散射变化进行分析,其生物分子的识别时间少于30 s。Yazgan等[79]将核壳Fe3O4-AuNPs球形粒子与具有拉曼活性的杆状金纳米粒子混合,制备了一种对三聚氰胺具有强作用力的新型SERS敏感基底,集成前处理富集-SERS检测过程,仅需15 min便可以实现牛奶中痕量三聚氰胺的高灵敏分析。
3 结语
食品安全快检技术具有分析速度快、操作简单、成本低等优点,然而在实际分析中受复杂样品的基质干扰,其检测选择性及灵敏度不足,难以实现准确定量。将新型高效的样品前处理技术与食品安全快检技术联用,可在保持快检技术快速、经济、便携、操作简单等原有优点的前提下,进一步提高食品安全快检技术的稳定性、选择性、灵敏度及定量准确性。固相萃取、微萃取、磁分离等多种新型前处理技术与食品安全快检技术联用,有效地降低了复杂食品样品的基体干扰,拓宽了食品安全快检分析方法的适用范围,从而提高了食品安全快检方法的灵敏度及准确性。在未来的研究中,研发小型化、便携、稳定性好、灵敏度高的食品安全快检装置,并进一步发展与之相匹配的现场、原位、高效的前处理技术,是发展便携、灵敏、可准确定量的食品安全快检技术的关键。
[1]El Barbri N,Amari A,Vinaixa M,et al.Sensor Actuat B-Chem,2007,128(1):235
[2]Wang Y W,Wang J,Zhou B,et al.Anal Chim Acta,2009,650(2):183
[3]Campagnoli A,Dell'Orto V,Savoini G,et al//Proceedings of the 13th International Symposium on Olfaction and Electronic Nose.Brescia,Italy:2009
[4]Gan T,Li K,Wu K B.Sensor Actuat B-Chem,2008,132(1):134
[5]Hilding-Ohlsson A,Fauerbach J A,Sacco N J,et al.Sensors,2012,12(9):12220
[6]Telsnig D,Terzic A,Krenn T,et al.Int J Electrochem Sci,2012,7(8):6893
[7]Hernández-Cázares A S,Aristoy M C,Toldrá F.J Food Eng,2012,110(2):324
[8]Liu G,Chen H D,Peng H Z,et al.Biosens Bioelectron,2011,28(1):308
[9]Adányi N,Váradi M,Kim N,et al.Curr Appl Phys,2006,6(2):279
[10]Fernández F,Hegnerová K,Piliarik M,et al.Biosens Bioelectron,2010,26(4):1231
[11]Mirasoli M,Buragina A,Dolci L S,et al.Biosens Bioelectron,2012,32(1):283
[12]Mcgrath T F,Andersson K,Campbell K,et al.Biosens Bioelectron,2013,41:96
[13]Wang X L,Tao G H,Meng Y.Anal Sci,2009,25(12):1409
[14]García-González D L,Aparicio R.Food Chem,2010,120(2):572
[15]Zhe Z,Tong J,Chen D H,et al.J Bionic Eng,2008,5(1):67
[16]Chauhan N,Pundir C S.Electrochim Acta,2012,67:79
[17]Urraca J L,Benito-Pena E,Perez-Conde C,et al.J Agric Food Chem,2005,53(9):3338
[18]Yang X,Gan N,Luo N X,et al//20092nd International Conference on Biomedical Engineering and Informatics(BMEI).Tianjin,China:2009.DOI:10.1109/BMEI.2009.5304881
[19]Park I,Kim N.Anal Chim Acta,2006,578(1):19
[20]Kanagaraj K,Affrose A,Sivakolunthu S,et al.Biosens Bioelectron,2012,35(1):452
[21]Bian Q Q,Liu Y F,Yu J S.Chemical Journal of Chinese Universities(卞倩茜,刘应凡,于俊生.高等学校化学学报),2010,31(6):1118
[22]Wang X F,Si Y,Wang J L,et al.Sensor Actuat B-Chem,2012,163(1):186
[23]Guo X S,Zhang X Y,Cai Q,et al.Food Control,2013,30(1):15
[24]Krska R,Molinelli A.Anal Bioanal Chem,2009,393(1):67
[25]Li X M,Luo P J,Tang S S,et al.J Agric Food Chem,2011,59(11):6064
[26]Han Z,Chi C,Bai B,et al.Anal Chim Acta,2012,720:126
[27]Cucci C,Mignani A G,Dall'Asta C,et al.Sensor Actuat BChem,2007,126(2):467
[28]Zhu H J,Zhang W,Zhang K,et al.Nanotechnology,2012,23(315502):1
[29]Raman C V,Krishnan K S.Nature,1928,121:501
[30]Mecker L C,Tyner K M,Kauffman J F,et al.Anal Chim Acta,2012,733:48
[31]Di Anibal C V,Marsal L F,Callao M P,et al.Spectrochim Acta A,2012,87:135
[32]Xie Y F,Mukamurezi G,Ying S Y,et al.Eur Food Res Technol,2012,234(6):1091
[33]Xie Y F,Zhu X Y,Sun Y Y,et al.Eur Food Res Technol,2012,235(3):555
[34]Liu X L,Jia G,Wu C M,et al.J Near Infrared Spec,2010,18(2):113
[35]Soto-Cámara M,Gaitán-Jurado A J,Domínguez J.Talanta,2012,97:298
[36]Soto-Barajas M,González-Martin I,Hernández-Hierro J M,et al.Anal Methods,2012,4(9):2764
[37]Gonzáleza M,Lobo M G,Méndez J,et al.Food Control,2005,16(2):105
[38]Li Y L,Liu Z F,Xie L S,et al.Chinese J Chem,2007,25(7):947
[39]Jia G F,Li L,Qiu J,et al.Spectrochim Acta A,2007,67(2):460
[40]Xue H Y,Xing Y,Yin Y M,et al.Food Addit Contam A,2012,29(12):1840
[41]Zhou Y,Li C Y,Li Y S,et al.Food Chem,2012,135(4):2681
[42]Zhang Y,Wang F X,Li F,et al.J Biomed Biotechnol,2009,2009:1
[43]Zhang M C,Hu Y R,Liu S H,et al.Food Anal Methods,2012,5(5):1105
[44]Yu F,Wu Y J,Yu S C,et al.Spectrochim Acta A,2012,93:164
[45]Song J,Yang H,Wang Y Z,et al.Food Chem,2012,135(3):1330
[46]Sheng Y J,Jiang W X,Saeger D S,et al.Toxicon,2012,60(7):1245
[47]Kav K,Col R,Tekinsen K K.Food Control,2011,22(12):1883
[48]Zhang C,Hu K P,Hashi Y K,et al.Chinese Journal of Chromatography(张超,胡可萍,端裕树,等.色谱),2007,25(4):586
[49]Ding L P,Wei Y H,Li H.World Pesticides(丁立平,魏云昊,李华.世界农药),2010,32(4):32
[50]Zhang Y,Pan T,Fang G Z,et al.J Food Sci,2009,74(8):T64
[51]Amin S A,Al-Attas A S.Journal of Saudi Chemical Soci,2012,16(4):451
[52]Afkhami A,Bagheri H.Microchim Acta,2012,176(1/2):217
[53]Ghaedi M,Parham H,Moghadam M,et al.Ann Chim-Rome,2006,96(11/12):689
[54]Meng L,Qiao X G,Song J M,et al.J Agric Food Chem,2011,59(24):12745
[55]Guo Z Y,Gai P P,Hao T T,et al.J Agric Food Chem,2011,59(10):5257
[56]Lu J J,Ge S G,Wan F W,et al.J Sep Sci,2012,35(2):320
[57]Chen D M,Tao Y F,Yu H,et al.Chemistry(陈冬梅,陶燕飞,余欢,等.化学通报),2009(8):713
[58]Abhilash P C,Singh V,Singh N.Food Chem,2009,113:267
[59]Liu Y H,Shen D Y,Tang F B.Bull Environ Contam Toxicol,2012,89:1057
[60]Satpathy G,Tyagi Y K,Gupta R K.Eur J Chem,2011,2(4):524
[61]Jia F Y,Wang W W,Wang J,et al.Anal Methods,2012,4:449
[62]Karnsa-Ard S,Santaladchaiyakit Y,Srijaranai S,et al.Curr Anal Chem,2013,9:150
[63]Wen X D,Deng Q W,Guo J.Spectrochim Acta A,2011,79(5):1941
[64]Verma D,Deb M K.Int J Environ An Ch,2012,92(1):59
[65]Xiao Q,Hu B,Yu C H,et al.Talanta,2006,69(4):848
[66]Rezaee M,Assadi Y,Hosseini M M,et al.J Chromatogr A,2006,1116(1/2):1
[67]Filik H,Cetintas G.Food Anal Methods,2012,5(6):1362
[68]Wen X D,Yang Q L,Yan Z D,et al.Microchem J,2011,97(2):249
[69]Zarei A R,Mardi K,Dehghani H.Food Anal Methods,2012,5(6):1398
[70]Kokya T A,Farhadi K,Kalhori A A.Food Anal Methods,2012,5(3):351
[71]Verzera A,Condurso C,Romeo V,et al.Food Anal Methods,2010,3(2):80
[72]Deng C H,Li N,Zhu W M,et al.J Sep Sci,2005,28(2):172
[73]Barié N,Bücking M,Rapp M.Sensor Actuat B-Chem,2006,114(1):482
[74]Jiang R,Pawliszyn J.Trac-Trend Anal Chem,2012,39:245
[75]Fernández-Baldo M A,Bertolino F A,Fernández G,et al.Analyst,2011,136(13):2756
[76]Du J J,Jing C Y.J Phys Chem B,2011,115(36):17829
[77]Lu F G,Sun M,Fan L L,et al.Sensor Actuat B-Chem,2012,173:591
[78]Park S Y,Handa H,Sandhu A.Nano Letters,2010,10(2):446
[79]Yazgan N N,Boyaci I H,Topcu A,et al.Anal Bioanal Chem,2012,403:2009
