气相色谱-质谱法测定蔬菜和水果中193种农药的残留量
2013-10-22崔淑华陈慰双钱家亮刘同英张立东
崔淑华,陈慰双,钱家亮,段 浩,刘同英,张立东
(1.山东出入境检验检疫局食品农产品检测中心,山东 青岛 266002;2.中国海洋大学环境科学与工程学院,山东 青岛 266003;3.临沂出入境检验检疫局检验检疫技术中心,山东 临沂 276034)
蔬菜和水果是人类平衡膳食的重要组成部分,近年来各国膳食指南都强调增加蔬菜和水果的摄入种类和数量,因此蔬菜和水果的质量安全非常重要。近年来,由于不正确、不合理使用农药,导致污染蔬菜和水果,引起农药中毒的事件不断发生。各国政府为保障国民健康和保护国内贸易,对果蔬中几百种农药制定了严格的最高残留限量要求。因此发展快速、可靠、灵敏和实用的多种类农药残留分析技术是控制其残留、保证食品安全和避免国际间有关贸易争端的基础。
近几年,随着分析仪器的研发和应用,液相色谱-串联质谱(LC-MS/MS)、液相色谱-四极杆-飞行时间质谱(LC-Q-TOF MS)及气相色谱-串联质谱(GC-MS/MS)等高灵敏度、高选择性仪器不断应用于果蔬中农药多残留分析[1-9],但这些仪器价格比较昂贵,对操作人员素质的要求较高,因此,使用气相色谱-质谱(GC-MS)进行蔬菜和水果中农药多残留分析仍是最常用的检测技术。在农药残留分析中,样品前处理技术具有十分重要的作用,直接决定了分析结果的精确性。固相萃取(SPE)技术因具有通用性强、净化效果好和操作简单等优势而成为目前国内外农药多残留分析中最常用的样品前处理技术。目前国内外对蔬菜和水果中农药多种类残留的检测报道很多,采用的固相萃取柱主要有PSA[10,11]、NH2[5,12]、C18[13]、CARB/NH2[3,4,14-17]、SAX/PSA[18]、CARB/PSA 柱[19-21]等。但这些检测方法对固相萃取吸附剂净化机理的研究很少,对不同类型吸附剂净化效果的比较也不多。本文在初步明确PSA、C18和CARB净化机理的基础上,通过系统优化SPE柱填料、洗脱溶剂和洗脱体积,建立了净化效果好、操作简便、选择性好和灵敏度高的蔬菜和水果中193种农药的多残留分析方法,在实际检测应用中取得了满意的结果。
1 实验部分
1.1 仪器与试剂
7890A气相色谱-5975C质谱联用仪,配有电子轰击源(EI)和7683型自动进样器(美国Agilent公司);R-210型旋转蒸发仪(瑞士BUCHI公司);5810R型离心机(德国Eppendorf公司);T25型均质器(德国IKA公司);TurboVap LV型样品自动浓缩仪(美国Caliper公司);MS 3基本型旋涡混合器(德国IKA公司)。
乙腈、正己烷(色谱纯,德国 Merck公司);丙酮、甲苯(色谱纯,美国TEDIA试剂公司);氯化钠、无水硫酸镁(分析纯,国药集团化学试剂有限公司,用前在450℃下烘5h,冷却至200℃时取出、冷却,备用);SAX/PSA固相萃取柱(6mL,500mg/500 mg,美国VARIAN公司);C18/PSA固相萃取柱(6 mL,500mg/500mg)、CARB固相萃取柱(6mL,500mg)、NH2固相萃取柱(6mL,500mg)均购自天津博纳艾杰尔科技有限公司。
农药标准物质:纯度不低于95%,均购自德国Dr.Ehrenstorfer GmbH。
1.2 标准溶液的配制
标准储备液的配制:根据农药标准物质的纯度,准确称取适量农药标准物质,用丙酮/正己烷(3/7,v/v)配成1000mg/L标准储备液。混合标准中间液的配制:193种农药根据化合物保留时间分成Ⅰ、Ⅱ、Ⅲ组,分别移取一定体积的标准储备溶液,用上述丙酮/正己烷配成10mg/LⅠ、Ⅱ、Ⅲ组的混合标准中间液。内标溶液的配制:准确称取适量磷酸三苯酯(TPP),用上述丙酮/正己烷配成300mg/L标准储备溶液。再取上述标准储备液用上述丙酮/正己烷配成3mg/L内标溶液。
基质混合标准工作溶液的配制:先分别将10 mg/LⅠ、Ⅱ、Ⅲ组混合标准中间液稀释配成5、2、1、0.5、0.2、0.1mg/L混合标准溶液。Ⅰ、Ⅱ、Ⅲ组基质混合标准工作溶液是在样品空白基质提取净化残渣中,加入850μL上述丙酮/正己烷溶剂、50μL内标溶液和100μL上述混合标准溶液,涡旋混匀后配成10、20、50、100、200、500、1000μg/L基质混合标准工作溶液。该溶液临用现配。
1.3 样品前处理
提取:称取10g样品(精确至0.01g)置于50 mL离心管中,准确加入20mL乙腈溶液,均质提取1min,然后加入3g无水硫酸镁和2g氯化钠,于5000r/min下离心5min,取10mL上层提取液至鸡心瓶中,于40℃真空旋转蒸发浓缩至约1mL。
净化:用4mL乙腈预洗C18/PSA固相萃取柱,当液面到达吸附剂的顶部时,将上述提取溶液转入柱中,用2mL乙腈洗涤样液瓶,将洗涤液移入SPE柱中,再用1mL乙腈重复洗瓶并将其转入SPE柱中。待溶液达到吸附剂顶部时,加入2mL乙腈至该柱进行洗脱,收集所有流出物,氮气吹干。定量加入50μL 3mg/L内标溶液、950μL丙酮/正己烷(3/7,v/v)溶剂,涡旋混匀后,用于 GC-MS测定。
1.4 气相色谱-质谱条件
1.4.1 气相色谱条件
色谱柱:HP-5ms石英毛细管柱,30m×0.25 mm×0.25μm;色谱柱升温程序:初温70℃,保留1 min,以25℃/min升至150℃,再以3℃/min升至200℃,最后以8℃/min升至280℃,保留5min;载气:氦气,纯度≥99.999%;恒压模式,压力为137.9kPa;进样口温度:250℃,脉冲不分流进样;进样量:2μL。
1.4.2 质谱条件
EI源,碰撞能量:70eV;离子源温度:230℃;四极杆温度:150℃;GC-MS接口温度:280℃;采集方式:SIM;溶剂延迟:5.0min。每种化合物分别选择1个定量离子、2~3个定性离子,每组所有需要检测的离子按照出峰顺序,分时段分别检测。每种化合物通过GC-MS检测的保留时间、定量离子及定性离子等质谱条件见表1。

表1 193种农药的保留时间、特征离子、线性相关系数、定量限、检出限、回收率范围及精密度(n=6)Table 1 Retention times,characteristic ions,correlation coefficients,LOQs,LODs,recovery ranges and RSD(n=6)ranges of the 193 pesticides

表1 (续)Table 1 (Continued)
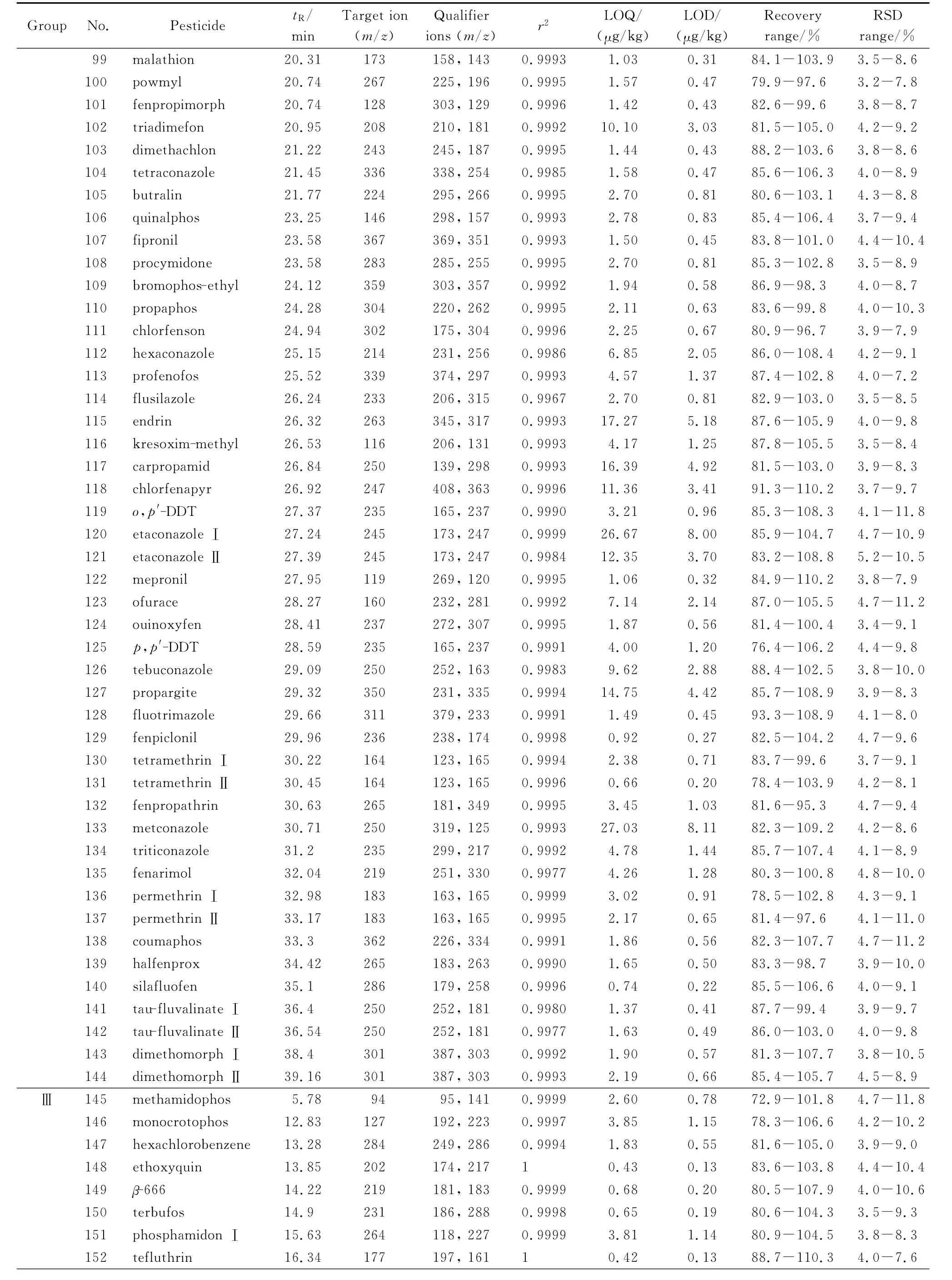
表1 (续)Table 1 (Continued)

表1 (续)Table 1 (Continued)
2 结果与讨论
2.1 样品净化方法的选择
2.1.1 SPE填料的选择
本研究对菠菜提取液经PSA、CARB和C18固相萃取柱净化、乙腈洗脱的净化液进行全扫描分析,全扫描图谱分别见图1~图3。对净化后的干扰物进行NIST谱库检索发现,PSA净化后的干扰物主要为维生素E、豆甾醇和植物醇等多种甾醇类化合物,C18净化后的干扰物主要为亚油酸、亚麻酸和棕榈酸等多种脂肪酸,而使用CARB净化后仅有少量的软脂酸和硬脂酸干扰物。可见,3种净化剂对不同基质干扰物的吸附性能差别较大。PSA主要对脂肪酸类化合物产生吸附,C18主要吸附样品基质中的甾醇、维生素等干扰物,CARB对甾醇、维生素和色素等杂质的吸附效果都很好。但CARB对具有平面结构的化合物(如噻菌灵、蝇毒磷和嘧菌环胺等)吸附很强,单独使用乙腈对多农药进行洗脱时,很多农药都不能被洗脱下来,必须加入甲苯进行洗脱,而甲苯的加入会破坏CARB对多种杂质的吸附效果,使最终净化效果变差。考虑到C18与CARB吸附的干扰物类型相似,但C18具有对大多数农药都不产生吸附,不需用甲苯这种高毒性溶剂洗脱等优点,本研究选择C18和PSA作为SPE填料。

图1 菠菜提取液经PSA固相萃取柱净化后的总离子流图Fig.1 TIC chromatogram of spinach extract purged by an SPE column filled with PSA

图2 菠菜提取液经C18固相萃取柱净化后的总离子流图Fig.2 TIC chromatogram of spinach extract purged by an SPE column filled with C18
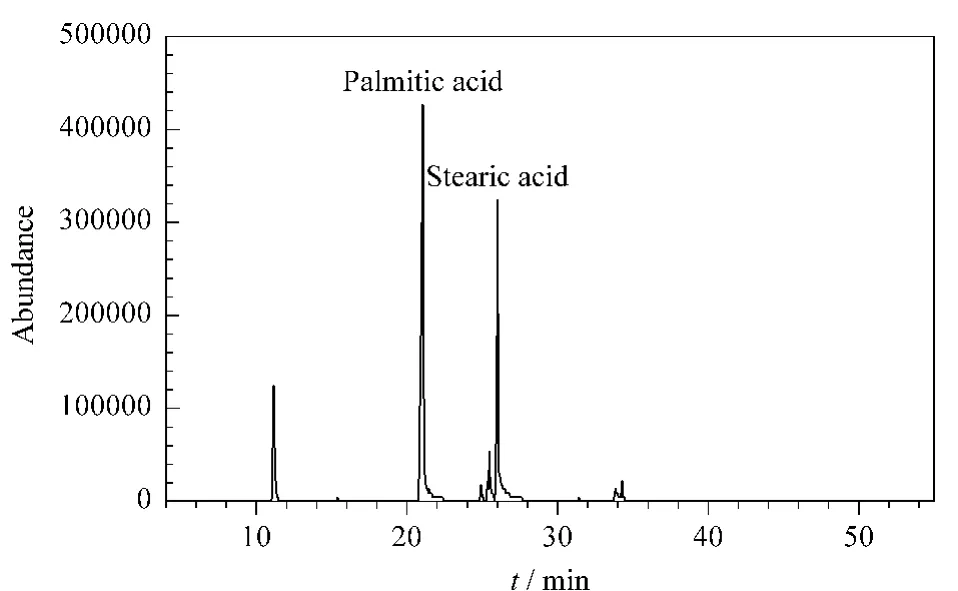
图3 菠菜提取液经CARB固相萃取柱净化后的总离子流图Fig.3 TIC chromatogram of spinach extract purged by an SPE column filled with CARB
2.1.2 SPE填料串联模式的确定
将Ⅰ组混合标准溶液分别添加于C18和PSA固相萃取柱上进行梯度洗脱试验,结果发现:用C18柱净化时,1mL乙腈对农药的洗脱率大多处于70%~80%之间,2mL乙腈可将大多数农药全部洗脱;而使用PSA柱净化时,除少数农药外,使用1mL乙腈即可将大多数农药全部洗脱。因此,SPE柱填装时,采用C18在上,PSA在下,即C18/PSA串联方式。
2.1.3 洗脱溶剂的选择和洗脱体积的确定
将Ⅰ组混合标准溶液添加于C18/PSA柱上,分别用不同体积的乙腈和丙酮/正己烷(3/7,v/v)进行洗脱,以明确其洗脱回收率。结果发现:使用乙腈洗脱时,3mL乙腈可使大多数农药的洗脱回收率达95%以上,但对速灭磷、异丙威和氧化乐果需4mL以上乙腈才能使其洗脱回收率达90%以上;使用丙酮/正己烷洗脱时,2mL即可使大多数农药的洗脱回收率达到90%以上,但对三唑类农药(如粉唑醇、烯唑醇、氟苯嘧啶醇)和菊酯类农药(如氟丙菊酯、氟氯氰菊酯、溴氰菊酯)需4mL洗脱溶剂才使其被全部洗脱。可见,使用这两种洗脱溶剂进行洗脱时,洗脱用量均应大于4mL。由于提取时使用100mL鸡心瓶对提取液进行浓缩,因此需要使用一定量的溶剂洗涤鸡心瓶。本实验确定先使用2mL和1 mL洗脱液洗涤鸡心瓶2次,将洗涤液倾入SPE柱中,待洗涤液达到SPE柱顶部时,再加入2mL洗脱液,共5mL洗脱液进行SPE净化洗脱。
取菠菜提取液过C18/PSA柱净化,分别用5 mL乙腈和丙酮/正己烷(3/7,v/v)洗脱;同时将提取液使用GB/T 19648-2006“水果和蔬菜中500种农药及相关化学品残留量的测定:气相色谱-质谱法”的净化方法(过CARB/NH2柱,用乙腈/甲苯(3/1,v/v)洗脱)进行处理,净化液浓缩后进行全扫描分析,扫描图谱见依次图4~图6。可见,用C18/PSA净化、乙腈洗脱的净化效果最好,各种基质干扰物被较好地吸附在固相萃取柱中。因此,本研究选择过C18/PSA固相萃取柱、5mL乙腈洗脱的净化方式,与GB/T 19648-2006相比,操作简便、使用较少量的溶剂取得了更佳的净化效果。

图4 菠菜提取液经C18/PSA净化、乙腈洗脱的总离子流图Fig.4 TIC chromatogram of spinach extract cleaned-up with C18/PSA and eluted by acetonitrile

图5 菠菜提取液经C18/PSA净化、丙酮/正己烷(3/7,v/v)洗脱的总离子流图Fig.5 TIC chromatogram of spinach extract cleaned-up with C18/PSA and eluted by acetone/hexane(3/7,v/v)
2.2 方法的线性关系、检出限和定量限
将基质混合标准工作溶液进样分析,以TPP为内标,以农药的质量浓度对农药峰面积与TPP峰面积的比值进行线性回归。结果表明,甲基对硫磷等34种农药在20~1000μg/L、乙氧羧草醚等26种农药在50~1000μg/L、叶菌唑等3种农药在100~1000μg/L,其余130种农药在10~1000μg/L范围内呈线性关系,相关系数为0.9967~1.0000。方法的检出限(S/N=3)为0.04~8.26μg/kg,定量限(S/N=10)为0.13~27.03μg/kg。193种农药的标准曲线的相关系数、检出限和定量限结果见表1。

图6 菠菜提取液经CARB/NH2 净化、乙腈/甲苯(3/1,v/v)洗脱的总离子流图Fig.6 TIC chromatogram of spinach extract cleaned-up with CARB/NH2and eluted by acetonitrile/toluene(3/1,v/v)
2.3 方法的回收率和精密度
在阴性菠菜、大葱、草莓和苹果样品中添加20、40、100μg/kg的甲基对硫磷、对硫磷、多效唑、腈菌唑、环丙唑醇、烯唑醇、三唑磷、丙环唑、苄呋菊酯、氟苯嘧啶醇、氟丙菊酯、腈嘧菌酯、敌百虫、硫线磷、炔戊菊酯、安果、三唑酮、己唑醇、丙溴磷、加普胺、溴虫睛、戊唑醇、氯菊酯、甲胺磷、久效磷、磷胺、螺环菌胺、三唑醇、杀扑磷、p,p′-DDE、硫丹、氰戊菊酯混合标准溶液,50、100、200μg/kg的氟菌唑、乙氧羧草醚、氟氯氰菊酯、氯氰菊酯、苯醚甲环唑、溴氰菊酯、乙酰甲胺磷、氟铃脲、α-666、炔戊菊酯、唑螨酯、异狄氏剂、炔螨特、灭菌唑、氯丹混合标准溶液,100、200 μg/kg的乙环唑和叶菌唑混合标准溶液和10、20、100μg/kg的193种农药中其余农药混合标准溶液,静置30min,待农药被样品充分吸收后,按上述前处理方法进行处理,做回收率试验,每个水平重复6次,计算精密度,结果见表1。由表1可见,193种农药平均加标回收率为71.6%~117.9%,相对标准偏差(RSD)为3.0%~11.8%。
2.4 实际样品分析
按照本方法对从农贸市场购买的香蕉、苹果、葡萄、草莓等20个水果样品和菠菜、青椒、蒜薹、大葱等50个样品进行测定,共检测样品300多批,结果在3个样品中检出4种农药,分别为草莓中毒死蜱20.2μg/kg,氯氰菊酯102.8μg/kg,青椒中嘧霉胺110.6μg/kg,小松菜中甲霜灵88.2μg/kg。
3 结论
通过对样品净化步骤的优化,本文建立了一种简单、高效的测定蔬菜和水果中193种农药残留的检测方法。该方法用乙腈均质提取残留农药,C18/PSA固相萃取柱净化,乙腈洗脱浓缩后进行GC/MS分析。与其他多残留分析方法相比,具有净化效果好、溶剂使用少、操作简单等优点,在日常实际检测中应用取得了满意的结果。
[1]Shi J W,Li J G,Wang Y F,et al.Chinese Journal of Chromatography(施家威,李继革,王玉飞,等.色谱),2012,30(6):602
[2]Sun B X,Guo D H,Ding Z P,et al.Journal of Instrumental Analysis(孙碧霞,郭德华,丁卓平,等.分析测试学报),2010,29(10):1017
[3]Li J,Sun C P,Hou Y,et al.Modern Agrochemicals(李娟,孙程鹏,侯颖,等.现代农药),2011,10(3):31
[4]Cao H,Lin Z Z,Chen X Z,et al.Journal of Zhejiang University of Technology(曹慧,林珍珍,陈小珍,等.浙江工业大学学报),2012,40(3):279
[5]Jiang J,Li P W,Xie L H,et al.Chinese Journal of Analytical Chemistry(姜俊,李培武,谢立华,等.分析化学),2011,39(1):72
[6]Kmellara B,Fodora P,Pareja L,et al.J AOAC Int,2003,86(2):412
[7]Cervera M I,Medina C,Portolés T,et al.Anal Bioanal Chem,2010,397:2873
[8]Yang X,Zhang H,Liu Y,et al.Food Chem,2011,127(2):855
[9]Bienvenida G L,Juan F R,Milagros M,et al.Talanta,2007,55:10548
[10]Wang J,Yue Y D,Tang F,et al.Journal of Instrumental A-nalysis(王进,岳永德,汤锋,等.分析测试学报),2011,30(2):161
[11]SN/T 1379-2007
[12]Wang Y,Jin H Y,Ma S C,et al.J Chromatogr A,2011,1218:334
[13]Beatriz A,Consuelo S B,Jose L T.Talanta,2005,66:917
[14]GB/T 19648-2006
[15]SN/T 2149-2008
[16]Li F,Hu J M,Li F G,et al.Chinese Journal of Health Laboratory Technology(李芳,胡建民,李锋格,等.中国卫生检验杂志),2011,21(10):2416
[17]Li J G,Wang Y F,Fan J Z,et al.Chinese Journal of Health Laboratory Technology(李继革,王玉飞,范建中,等.中国卫生检验杂志),2010,20(11):2711
[18]SN/T 2915-2011
[19]Olga S,Yuhui Y,Katherine S,et al.J Chromatogr A,2007,1165:18
[20]Rosa M G R,Raquel R O,Beatriz C G,et al.J Chromatogr A,2008,1196/1197:100
[21]Rosa M G R,Beatriz C G,Jesús S G.J Chromatogr A,2009,1216:6033
