分散固相萃取-超高效液相色谱-串联质谱法同时检测火锅食材中11种喹诺酮类药物
2013-10-22耿金培张禧庆梁君妮沙美兰关丽丽
曹 鹏,牟 妍,高 飞,耿金培,张禧庆,隋 涛,梁君妮,沙美兰,关丽丽
(1.烟台出入境检验检疫局,山东 烟台 264000;2.青岛出入境检验检疫局,山东 青岛 266000;3.烟台杰科检测服务有限公司,山东 莱阳 265231)
喹诺酮类药物(quinolones,QNs)是一类合成抗生素,具有抗菌谱广、活性高、无交叉耐药性、耐药突变概率低、口服吸收好、半衰期长、价格便宜、不良反应少等优点,被世界各国广泛应用于畜禽和水生动物疾病的防治[1]。若长期食用残留量高或被此类药物污染的食品,会在人体内积累,同时会使致病菌产生耐药性,从而危害人类健康[2]。目前市场上出现了非法使用该类药物的情况,比如餐饮行业中的火锅和麻辣烫,有部分商家在火锅和麻辣烫里添加喹诺酮类药物(防止人食用该类食物后细菌中毒,引起肠胃不适等)。在我国卫生部公布的食品中违法添加的物质名单中即有此类药物[3]。为了保障人民饮食安全,有必要建立一种快速、准确、灵敏的方法对火锅和麻辣烫食材中的喹诺酮类药物进行检测,进而可以有效地监督管理。
目前用于喹诺酮类药物残留的检测方法有微生物法[4-6]、高效液相色谱法[7-9]、高效液相色谱-质谱联用法[10-15]、酶联免疫分析法[16-18]、毛细管区带电泳法[19]等,基质主要是畜禽、水产品的肌肉、内脏等组织及副产品[4-19],对火锅食材、火锅底料等成分复杂、油性大的基质检测还没有相关报道。
QuEChERS法是由Anastassiades等[20]开发的一种快速(quick)、简单(easy)、廉价(cheap)、高效(effective)、耐用(rugged)、安全(safe)的分散固相萃取方法,由于该方法有简单易行、稳定可靠的优点,现已被用于农药残留[21,22]和兽药残留[23-26]的检测。现在常用的普通液液萃取和固相萃取柱的方法存在提取不完全、基质干扰大等问题,不适用于各种火锅食材样品中喹诺酮类药物的检测。针对上述问题,本文将QuEChERS法和超高效液相色谱-串联质谱有机结合起来,对提取净化方法、色谱-质谱条件进行了改进和优化,建立了一种分散固相萃取净化结合超高效液相色谱-串联质谱同时检测火锅食材中11种喹诺酮类药物的方法。
1 实验部分
1.1 仪器与试剂
Agilent 1290UPLC-6490A超高效液相色谱-三重四极杆串联质谱联用仪(美国Agilent公司);漩涡 混 合 器 VOATEX-2(Scientific Industries);SB5200型超声波清洗机(美国Branson公司);CF16RXⅡ型高速冷冻离心机(日本Hitachi公司);Milli-Q超纯水(美国 Millipore公司);氮吹浓缩仪(美国Organomation Associates公司)。
恩诺沙星(enrofloxacin)、环丙沙星(ciprofloxacin)、诺氟沙星(norfloxacin)、氧氟沙星(ofloxacin)、达氟沙星(danofloxacin)、沙拉沙星(sarafloxacin)、洛美沙星(lomefloxacin)、培氟沙星(pefloxacin)、二氟沙星(difloxacin)、奥比沙星(orbifloxacin)、马波沙星(marbofloxacin)均购自德国Dr.Ehrenstorfer公司(纯度>99.0%)。乙腈、甲醇、甲酸为色谱纯,氯化钠、醋酸钠、乙酸铵、硫酸镁均为分析纯;N-丙基乙二胺吸附剂(PSA,Agilent公司),十八烷基键合硅胶吸附剂(C18,Agilent公司),石墨化炭黑(GCB,Agela公司);微孔滤膜(0.22μm)。
1.2 标准溶液的配制
分别精密称取11种喹诺酮类药物标准品,折合成目标化合物20mg(精确至0.1mg)置于100mL棕色容量瓶中,用乙腈溶解并定容至刻度,混匀配制成200mg/L的单标储备液;分别准确移取1mL各单标储备液置于100mL棕色容量瓶中,用乙腈定容至刻度,配成2mg/L的混合标准中间液;根据需要移取适量混合标准中间液,用乙腈-水(含0.1%甲酸)(1∶1,v/v)稀释成适用浓度的标准工作溶液。各种标准溶液密封保存于4℃冰箱中。
1.3 样品前处理
将样品用食品加工机充分搅拌、均质,分出0.5 kg作为试样,置于清洁的样品容器中,密封,并做好标记。将制备好的试样于0~4℃下冷藏保存。
1.3.1 样品提取
菜类:称取15.0g样品至50mL离心管中,加15mL含5%甲酸的正己烷饱和的乙腈、3.0g醋酸钠和3.0g氯化钠,剧烈振荡,超声提取15min,于6000r/min下离心5min,吸取上清液10mL于10 mL离心管中,提取液待净化。
调味料、肉制品、脱水制品等:称取5.0g样品至50mL离心管中,加入10mL水剧烈振荡摇匀,浸泡15min,然后加入15mL含5%甲酸的正己烷饱和的乙腈、3.0g醋酸钠和3.0g氯化钠,剧烈振荡,超声提取15min,于6000r/min下离心5min,吸取上清液10mL于50mL离心管中,提取液待净化。
1.3.2 样品净化
提取液中依次加入500mg C18、200mg PSA、1.0g无水硫酸镁,轻微振荡1min,于5000r/min下离心5min,分取上层净化液2.0mL,氮气吹干,加入2.0mL乙腈-水(含0.1%甲酸)(1∶1,v/v)溶解并定容(若有油脂可再加入0.8mL乙腈饱和的正己烷去除),过0.22μm微孔滤膜,滤液供液相色谱-质谱测定。
1.4 色谱和质谱条件
色谱柱:Poroshell 120EC-C18柱(100mm×3.0mm,2.7μm);柱温:35 ℃;进样量:5μL;流速:0.25mL/min。流动相:A 为5mmol乙酸铵-0.1%甲酸水,B为甲醇。梯度洗脱程序:0~2.0 min,90%A;2.0~6.0min,90%A~10%A;6.0~7.0min,10%A~90%A;7.0~8.0min,90%A。
本次在整个灌浆处理措施前未进行钻孔弹模测试,仅在复合灌浆前和灌浆后分别进行了3个孔和5个孔共50多点的测试。鉴于该水道系统的最大作用水头,最大工程压力取6 MPa,变形模量计算取2 MPa~6 MPa压力对应的模量。
离子源:电喷雾电离,正离子模式(ESI+);毛细管电压:3.0kV;离子源温度:120℃;脱溶剂气:N2;脱溶剂气温度:350℃;脱溶剂气流速:750L/h;碰撞气:高纯Ar;扫描方式:多反应监测(MRM)。11种喹诺酮类药物的质谱分析参数见表1。

表1 11种喹诺酮类药物的多反应监测质谱参数Table 1 MS parameters in MRM mode for the 11 QNs
2 结果与讨论
2.1 样品前处理条件的优化
2.1.1 提取条件的选择
喹诺酮类化合物的分子结构中含有羧基和叔胺基,具有酸碱两性性质,易溶于酸性或碱性溶液。文献报道的提取方法大多用纯有机溶剂(乙腈、甲醇、二氯甲烷等),而在有机溶剂中添加一定比例的酸或碱等提取可显著提高回收率[24,25]。本文首先考察了QuEChERS法常用提取溶剂(乙腈、乙酸乙酯)的提取效果。试验发现,乙腈与乙酸乙酯的提取回收率相当;但用乙酸乙酯提取的溶剂颜色较深,表明其带出了弱极性基质成分,这将增加后续净化的难度;乙腈在有效提取目标物的同时具有沉淀蛋白质的作用,且其带出的弱极性成分少,反映在质谱上响应高、基质影响小,因而选用乙腈作提取溶剂。
本文在已有研究[23-26]的基础上,进一步采用含5%甲酸的正己烷饱和的乙腈溶液作为提取溶剂进行提取试验。正己烷饱和的乙腈在提取过程中能更好地起到浸润的作用,降低了提取溶液及含水基质提取液中的水分,从而减轻了后续的除水压力。结果表明,该提取试剂不仅去除脂肪和蛋白质的效果好,而且容易浓缩,提取回收率也可满足要求。
另外,在提取时,比较了直接乙腈提取与先加水分散再用乙腈提取的处理方法,结果(见图1)表明,先加水将样品充分分散后再用乙腈提取可获得更高的回收率,这可能与乙腈具有的蛋白质凝结作用有关,凝结的蛋白质阻碍了其进入内部发生作用,所以选择先加水分散再用乙腈提取的处理方法。

图1 不同提取方法对11种药物回收率的影响Fig.1 Effects of different extraction methods on the recoveries of the 11 compounds
2.1.2 净化条件优化
分散固相萃取是QuEChERS方法的净化手段,PSA、C18、GCB是常用的吸附剂。采用PSA分散性固相萃取净化,可有效去除乙腈提取液中脂肪酸、糖类、酚类以及极性色素等成分;C18具有良好的除脂能力;GCB可去除提取液中的色素成分,但对含苯环官能团的化合物有较强的吸附作用。禽肉中含有丰富的蛋白质(用乙腈提取时已被沉淀)及脂肪类物质,而目标物几乎都含有苯环,故本研究只选取PSA、C18作为净化吸附剂进行优化。

图2 不同净化条件对11种药物回收率的影响Fig.2 Effects of different purification conditions on the recoveries of the 11 compounds
将最终净化液在氮气下缓缓吹干,某些复杂基质会有少许黄色液滴,可在定容后加入0.8mL乙腈饱和的正己烷,振荡离心后去除,过微孔滤膜后溶液即澄清。
2.2 色谱条件的优化
为维持流动相的低pH值以抑制硅醇基的解离和保证喹诺酮类化合物在流动相中的稳定溶解状态。本文采用0.1%甲酸或乙酸来控制流动相的pH值,试验发现二者均可得到对称、尖锐的峰形,但甲酸更利于喹诺酮类化合物的离子化,可得到较高的检测灵敏度,故本实验中选择用0.1%甲酸控制流动相的pH值,可以提高灵敏度,并且加入微量的NH+4可使峰形更尖锐、响应更稳定。最终本实验选择5mmol乙酸铵-0.1%甲酸水作为流动相A。
实验还对定容溶液进行了选择,发现采用不同的溶剂作为标准稀释液或样品处理后的复溶溶液会对质谱响应及色谱峰形产生显著影响。比例过高的有机溶剂能明显增强质谱响应,但同时也会造成部分化合物的色谱峰形坍塌,比例过低的有机溶剂不能完全溶解目标物。经多次试验,确定以乙腈-水(含0.1%甲酸)(1∶1,v/v)溶液作为定容溶液,可获得对称、尖锐的峰形和良好的质谱响应。
2.3 质谱条件的优化
喹诺酮类化合物因含有羰基等多电子基团而适合在ESI源的正离子模式下形成[M+H]+准分子离子,以此作为母离子。在ESI模式下分别对1.0 mg/L的11种QNs的单标准溶液进行全扫描得到准分子离子峰,再通过优化碰撞能量等参数得到11种药物的子离子。11种药物的定量和定性子离子及相应的质谱参数见表1。
2.4 基质效应的消除
尽管样品经乙腈沉淀蛋白质、分散固相萃取后得到了良好的净化,但仍无法完全消除基质效应。本文在建立方法过程中,发现大部分QNs均存在不同程度的基质效应,且均为抑制效应。综合考虑,本方法采用蔬菜类、肉类及火锅底料类3种空白样品配制基质匹配标准溶液,很好地消除了基质影响(见表2),完全能满足喹诺酮类药物残留检测的要求。
2.5 方法的线性范围和检出限
采用基质加标工作曲线进行外标法定量。根据基质的不同,按上述方法进行提取、净化和浓缩,采用不同浓度的标准溶液进行定容、检测,得到基质加标工作曲线。实验表明,在1.0~100.0μg/L范围内,11种喹诺酮类药物的线性方程相关系数均大于0.998。分别根据3倍和10倍信噪比确定化合物的检出限(LOD)和定量限(LOQ)。11种喹诺酮类药物的线性方程、相关系数、LOD和LOQ见表3。

表2 基质效应消除前后11种药物的回收率Table 2 Recoveries of the 11 compounds before and after matrix effect elimination
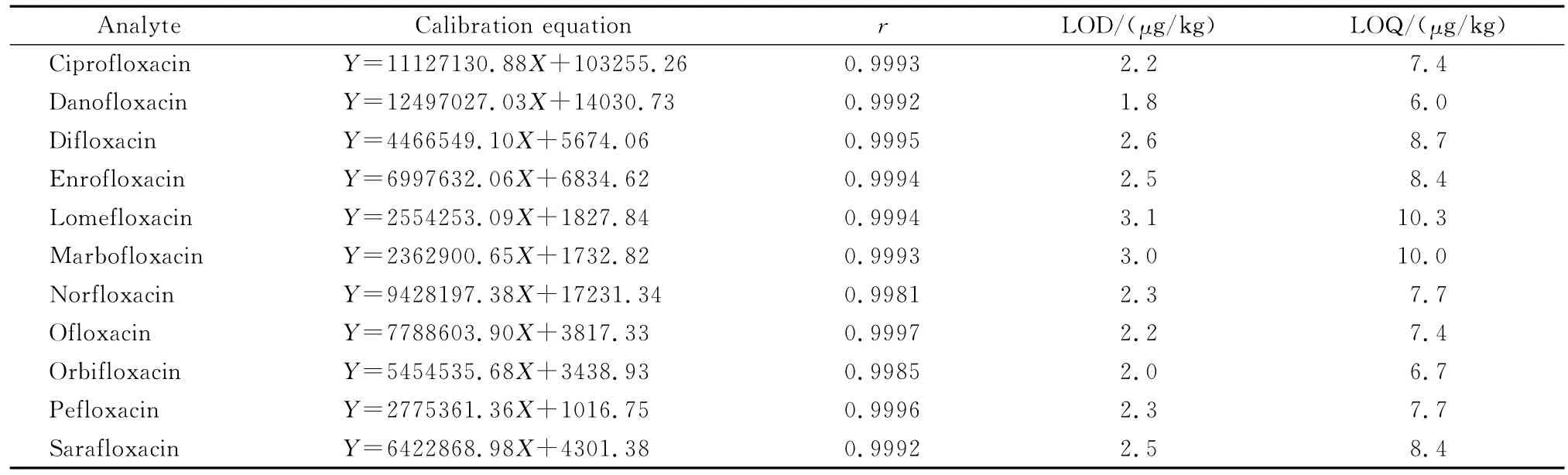
表3 11种喹诺酮类药物的线性关系、检出限及定量限Table 3 Linear relationships,LODs and LOQs of the 11 QNs
2.6 方法的回收率和精密度
在不同的火锅食材样品中添加喹诺酮类标准溶液,分别添加3个不同浓度水平的混合标准溶液,每个水平重复测定6次,采用外标法进行定量,计算回收率和精密度(以相对标准偏差表示)。图3为火锅底料中11种QNs类药物的MRM谱图。结果表明,本方法11种药物的回收率范围为70.1%~100.3%,RSD都小于11%(见表4),表明本方法有良好的准确度和精密度,满足喹诺酮类药物痕量分析的要求。
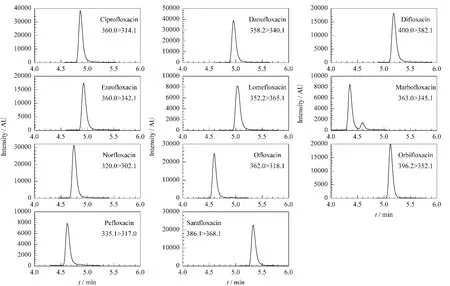
图3 火锅底料中11种喹诺酮类药物的MRM谱图(添加水平为10μg/kg)Fig.3 MRM Chromatograms of the 11 QNs in hotpot seasoning spiked at 10μg/kg
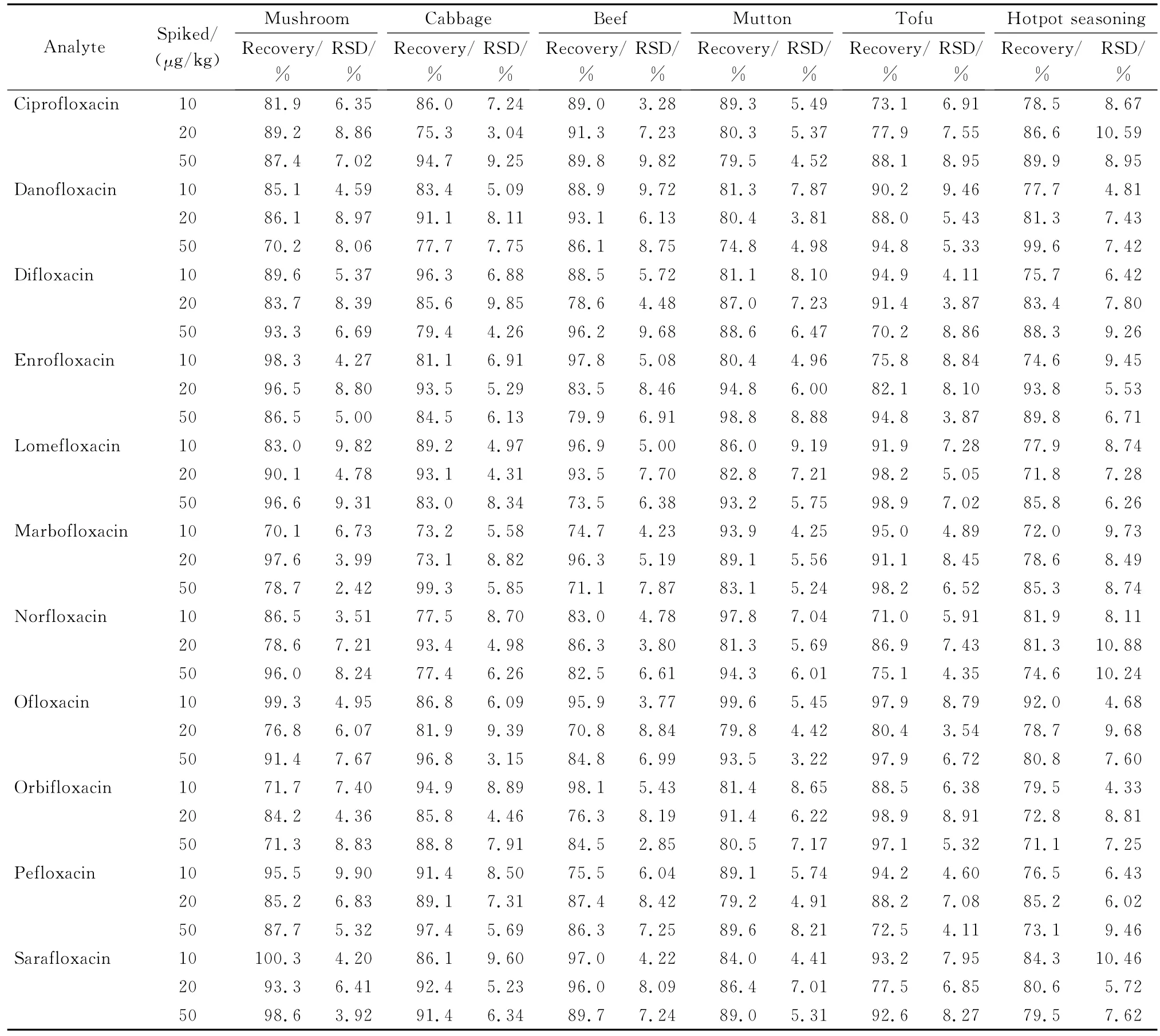
表4 不同食品中11种喹诺酮类药物的回收率和精密度(n=6)Table 4 Recoveries and relative standard deviations(RSDs)of the 11 QNs spiked in different foods(n=6)
2.7 实际样品测定
为验证该方法的可靠性,从超市购买了18种火锅底料、蔬菜、豆腐、蘑菇、禽肉制品进行测定,同时作质控样品。样品均未检出QNs药物残留,质控样品的回收率等指标均达到分析要求,表明结果准确、可靠。下一步准备扩大取样,准备从火锅店抽取样品进行检测。
3 结论
本文建立了同时检测火锅食材中11种喹诺酮类药物残留的分散固相萃取-超高效液相色谱-串联质谱法。采用酸化乙腈溶液提取后进行分散固相萃取净化,有效提高了提取率,减少了杂质的干扰,快速、简洁。在优化了提取和净化方法的同时,采用基质匹配标准溶液的方法很好地消除了基质影响,提高了检测灵敏度。该方法作为火锅食材中11种喹诺酮类药物残留的确证方法,具有简便、灵敏、准确的优点,可以更有效地监控市场违法添加喹诺酮类药物的行为,保证人民食品安全。
[1]Shi X F,Lu G L.China Journal of Animal Quarantine(施杏芬,陆国林.中国动物检疫),2008,25(9):16
[2]Winter R W,Kelly J X,Smilkstein M J.Experim Parasitol,2008,118(4):487
[3]Ministry of Health of the People’s Republic of China.Food Maybe Illegal and Easy to Add non-food Substances of Abuse List of Food Additives(中华人民共和国卫生部.食品中可能违法添加的非食用物质和易滥用的食品添加剂名单).[2011-04-22].http:/www.moh.gov.cn/mohwsjdj/s9164/201104/51440.shtml
[4]Zheng J,Huang X R,Zheng J C,et al.Chinese Journal of Health Laboratory Technology(郑晶,黄晓蓉,郑俊超,等.中国卫生检验杂志),2006,16(1):79
[5]SN/T 1751.1-2006
[6]Huang X R,Zheng J,Li S S,et al.Freshwater Fisheries(黄晓蓉,郑晶,李寿崧,等.淡水渔业),2005,35(4):3
[7]Qian Z Z,Su X H,Wei B J,et al.Food Science(钱卓真,苏秀华,魏博娟,等.食品科学),2010,31(6):185
[8]Zhao S J,Li C,Jiang H Y,et al.Chinese Journal of Analytical Chemistry(赵思俊,李存,江海洋,等.分析化学),2007,35(6):786
[9]Holizapple C K,Buckley S A,Stanker L H.J Chromatogr B,2001,754:1
[10]Shi B,Zhang Z G,Wu S H,et al.Inspection and Quarantine Science(施冰,张志刚,吴抒怀,等.检验检疫科学),2004,14(B12):25
[11]Van Hoof N,De Wasch K,Okerman L.Anal Chim Acta,2005,529(1/2):265
[12]Yue Z F,Lin X Y,Tang S B,et al.Chinese Journal of Chromatography(岳振峰,林秀云,唐少冰,等.色谱),2007,25(4):491
[13]Bao X L,Ren Y P,Zhang H.Chinese Journal of Analytical Chemistry(包晓丽,任一平,张虹.分析化学),2009,37(3):389
[14]Samanidou V,Evaggelopoulou E,Trützmüllerb M.J Chromatogr A,2008,1203(2):115
[15]GB/T 20366-2006
[16]Burkin M A.Food Agric Immunol,2008,19(2):131
[17]Zhu Y,Li L,Wang Z H.J Agric Food Chem,2008,56(14):5469
[18]Yang Z T,Zhang N S,Wei D.Chinese Journal of Veterinary Science(杨正涛,张乃生,魏东.中国兽医学报),2008,28(9):7501
[19]Hernandez M,Borrull F,Calull M.Electrophoresis,2002,23(3):506
[20]Anastassiades M,Lehotay S J,Stajnbaher D,et al.J AOAC Int,2003,86(2):412
[21]Shi J W,Li J G,Wang Y F,et al.Chinese Journal of Chromatography(施家威,李继革,王玉飞,等.色谱),2012,30(6):602
[22]Ye J L,Jin G E,Zhuang W E,et al.Chinese Journal of Analysis Laboratory(叶江雷,金贵娥,庄婉娥,等.分析试验室),2011,30(10):115
[23]Zhang Y,Yue Z F,Lan F,et al.Chinese Journal of Analytical Chemistry(张毅,岳振峰,蓝芳,等.分析化学),2012,40(5):724
[24]Cao J,Chen Y,Yang R Z,et al.Chinese Journal of Veterinary Drug(曹军,陈勇,杨瑞章,等.中国兽药杂志),2011,45(7):21
[25]Li H F,Yin J G,Liu Y M.Chinese Fishery Quality and Standards(李慧芳,殷军港,刘永明.中国渔业质量与标准),2012,2(1):62
[26]Li F G,Su M,Li X Y,et al.Chinese Journal of Chromatography(李锋格,苏敏,李晓岩,等.色谱),2011,29(2):120
