纤维素酶产生菌的筛选及产酶条件的研究
2013-10-22胡格华苏香萍龚大春
胡格华 苏香萍 潘 虹 李 洋 龚大春,2 邹 坤
(1.三峡大学 化学与生命科学学院,湖北 宜昌 443002;2.三峡大学 艾伦·麦克德尔米德再生能源研究所,湖北 宜昌 443002)
我国是农业大国,农作物秸秆又是世界上最丰富的纤维素类物质之一.然而目前这一巨大资源不仅没有得到充分利用,反而大部分焚烧或被弃置于环境中造成环境污染和资源的浪费.如何利用纤维素酶将这些秸秆纤维素废弃物大规模地转化为简单糖类或蛋白质等产品,再进一步转化为酒精、饲料等已成为全世界研究的热点,也是缓解当今世界所面临的粮食短缺、饲料资源的紧张、能源危机和环境污染等问题的有效途径之一[1-3].
自然界中能分解纤维素的生物主要为真菌类和部分细菌,以木霉、曲霉、青霉的能力最突出,但目前研究最多的是一些真菌经物理、化学处理(辐射、蒸汽爆破、酸化、碱化等)后的纤维素酶的作用,生产成本高,对环境的污染严重,限制了农作物秸秆的高效利用.因此筛选性能稳定的纤维素酶菌株,研究其对未处理的天然纤维素的降解作用来解决上述问题至关重要[4].
目前所选育出来的一些菌种虽具有一定的产酶能力,但是应用于生产还不是很理想,有待于进一步选育出更多高活力优良菌株.本课题选用CMC-Na培养基进行分离纯化单个菌株,经刚果红染色初筛,挑选透明圈直径与菌落直径比大的菌株进行三角瓶固体培养复筛,通过测定其酶活复筛出一株产纤维素菌株酶活较高的菌株,通过单因子实验和正交实验来优化其最佳的产酶发酵条件.
1 材料和方法
1.1 实验材料
1.1.1 培养基
1)选择培养基[5-6],即羧甲基纤维素钠 (CMCNa)培养基:氯化钠6g,硫酸镁0.1g,磷酸二氢钾0.5 g,二氯化钙0.1g,磷酸氢二钾2.0g,CMC-Na 15g,硫酸铵2g,琼脂1.5%,蒸馏水1000mL,pH 7.0~7.4.
2)菌种保藏培养基:PDA琼脂培养基.
3)液体种子培养基:硫酸铵1%,硫酸镁0.1%,磷酸二氢钾0.5%,葡萄糖6%,蒸馏水100mL.
4)三角瓶固体培养基:稻草6g,麸皮6g,于250 mL三角瓶中,加入营养液36mL,混匀后灭菌.营养液:磷酸二氢钾1%,硫酸铵1%~2%,硫酸镁0.1%.
以上培养基均需在121℃、0.5MPa下灭菌20min.
1.1.2 实验仪器
SW-CJ-1Cu双人单面净化工作台:武汉市志飞净化设备技术有限公司;HQD98L恒温培养摇床:武汉海声达仪器设备有限公司;BPC-250F生化培养箱:武汉瑞华仪器设备有限责任公司;UV-1100紫外可见分光光度计:上海天美科学仪器有限公司;THZ-98AB恒温振荡水槽:北京东方精瑞科技发展有限公司.
1.2 实验方法
1.2.1 分离纤维素酶产生菌的样品采集
从三峡地区丘陵地带不同生态环境采集烂草、朽木、肥沃的菜地土壤、发霉的桔子皮和苹果核作为分离筛选纤维素酶产生菌的样品.
1.2.2 产纤维素酶菌株的初筛[5-6]
将采集到的腐烂的各含菌的样品放在三角瓶中,加入一定量的蒸馏水,充分搅匀后静置,用三层纱布过滤,再静置,吸取上清液分别稀释1,2,3,4,5,6倍,将稀释液涂布在CMC-Na选择培养基平板上,28℃恒温培养2~3d,从培养基上挑取单菌落于CMC-Na平板上划线分离纯化,获得的菌株分别转接于CMCNa平板上,28℃再培养2d,用刚果红染色10min后再用NaCl脱色5min,能分解纤维素酶的菌株周围会出现清晰的透明圈,选择出透明圈直径与菌落直径比较大的菌株保藏为下一步实验做准备.
1.2.3 制备种子液
在无菌操作台上将初筛得到的保藏菌种挑取一环于已灭菌的液体种子培养基中,每一菌种培养一瓶种子液,28℃振荡培养2~3d.
1.2.4 三角瓶固体培养复筛
接种10mL种子于已灭菌的发酵培养基中,充分搅拌后于28±1℃恒温箱中培养72h成曲,每24h时振荡培养瓶一次.
1.2.5 菌种初步鉴定
通过菌落形态观察、显微镜检的特征,对菌株进行初步鉴定.
1.2.6 酶活测定
羧甲基纤维素酶(CMCase)活性、滤纸酶(FPA)活性和β-葡萄糖苷酶活性(β-G酶活),采用3,5-二硝基水杨酸显色法(DNS法)[7-8]测定.
1.2.7 发酵条件优化
在250mL锥形瓶中进行液体发酵,在研究pH对菌株产酶的影响时,种子液按5%的接种量接种到50mL、温度28℃的液体发酵培养基中,然后分别置于初始pH 5、6、7、8、9下,120r/min摇床培养72h后,分别测定酶活,选出最佳培养pH.然后依次改变培养时间、培养温度和装液量中的某一因素,并保持其他发酵条件不变,通过测定CMCase、FPA活性和β-G酶活,研究各因素对产酶的影响.
2 结果与分析
2.1 产纤维素酶菌株分离、筛选
从三峡地区丘陵地带采集的含菌烂草、朽木、肥沃的菜地土壤、发霉的桔子皮和苹果核等作为分离样品.采用刚果红染色初筛到20株菌株,其中有3株菌的三种纤维素酶活性较高,如表1所示,菌株X3的三种纤维素酶活性最高.
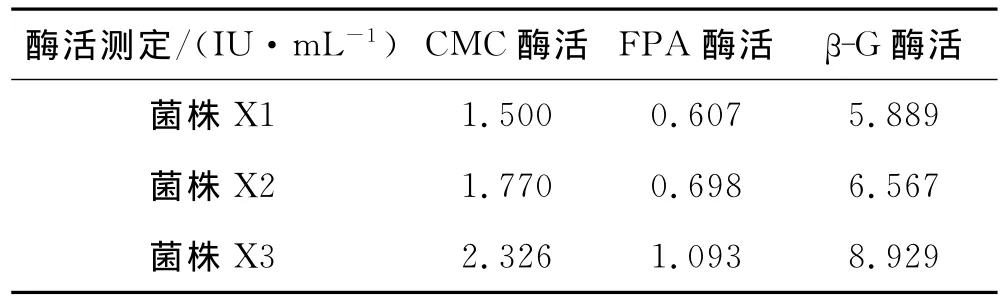
表1 3株菌株的三种纤维素酶活力的比较
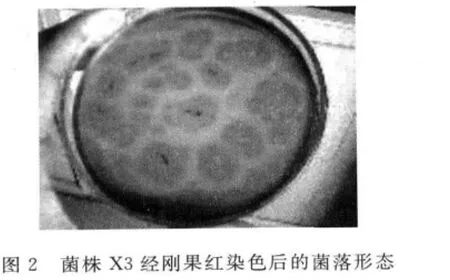
菌株X3的菌落形态描述如下:培养基上菌落颜色为黑色,菌落光滑,不透明;菌落开始时是白色,随着时间的推移颜色加深,最后呈现黑褐色.其菌丝为蜘蛛网状,分生孢子球形,孢子头成放射状.
根据《微生物分类学》[9]的描述:曲霉属—营养菌丝体由具横隔的分支菌丝组成,从菌丝特化形成厚而膨大的足细胞,在垂直长出直立的方向上长出分生孢子梗,分生孢子梗顶端膨大形成顶囊,某些种能产生菌核或类似菌核的结构,还有少数产生壳细胞.
鉴定:各形态特征基本符合上述分类学描述,故属丝孢纲,丝孢目,丛梗孢科,曲霉属.
图1和图2分别为菌株X3在CMC-Na培养基生长的菌落特征,其菌落加刚果红前和后的菌落形态比较.可见图1加刚果红前,培养基上菌落水解纤维素产生水解圈;图2经刚果红染色及氯化钠脱色后,所得菌落周围可更清晰地看见透明圈.故选择透明圈直径与菌落直径比较大的菌株X3保藏并作为下一步产酶条件研究的对象,对其进行单因素和正交优化实验.

2.2 产酶条件的的研究
2.2.1 培养基初始pH值对产酶的影响
在其他产酶条件不变的情况下,改变培养基初始pH,研究其对产酶的影响.实验结果如图3所示,当初始pH为6时,此三种酶活分别最高.可以看出过高和过低的pH都不利于该菌株X3的生长从而影响其酶的产量,其原因在于不适当的酸和碱可以使酶的空间结构在一定程度上遭到破坏,引起酶构象的改变,酶活性减弱或丧失.故最适培养基的pH为6.

图3 初始pH对酶活的影响
2.2.2 培养时间对产酶的影响
在其他产酶条件不变的情况下,研究培养时间对产酶的影响.结果如图4所示,该图也为菌株X3的生长曲线图,可以看出该菌株在纤维素固体摇瓶培养基上生长状态良好.当培养时间为72h时,此时三种酶活分别最高.随着培养时间的延长菌株X3生长逐渐成熟并趋进于最佳产酶的生长阶段,当培养时间太长时,菌株老化,产酶能力下降,部分酶因环境等因素而活性有所下降,所以表现为有略微的下降.故最适培养时间为72h.

图4 培养时间对酶活的影响
2.2.3 培养温度对产酶的影响
在其他条件不变的情况下,研究培养温度对菌株X3产酶的影响.实验结果如图5,当培养温度为28℃时,此时三种酶活分别最高.在一定培养温度范围内,当温度升高时,与一般化学反应一样,无论是菌株生长时体内的生化反应还是产酶反应速率都有所加快,故酶活力有所升高;另一方面当温度过高,菌株体内的蛋白质有变性使得菌株的生长和产酶都有所影响.故最适培养温度为28℃.
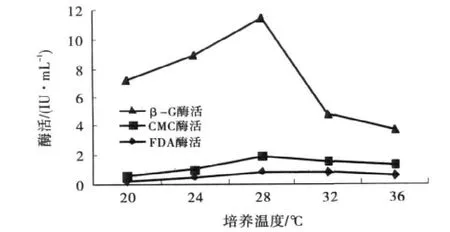
图5 培养温度对酶活的影响
2.2.4 装量对产酶的影响
在其他产酶条件不变的情况下,不同装量对菌株X3产酶的影响.实验结果如图6,当装量为15mL/250mL三角瓶时,此时三种酶活分别最高.可以证明该菌株X属于好氧菌株,在相同体积的三角瓶中进行发酵,装量(20mL)大则溶氧量相对较少,菌株没有足够的氧气,酶活自然就较低,而在适宜的装量(15 mL)条件下,产纤维素酶菌株生长旺盛,产酶能力最大,酶活最高,也符合工业生产中的低成本,高效率问题.故最适装量为温度为15mL/250mL三角瓶.

图6 装量对酶活的影响
2.3 正交实验确定最佳生产发酵条件
在单因素实验的基础上,选用温度、时间、初始pH和装量进行四因素三水平正交设计实验,分别测定FPA酶活、CMC酶活、β-G酶活,各酶活单位为IU/mL,最终以β-G酶活为考察指标优化产酶条件,正交设计见表2,正交实验及结果见表3.
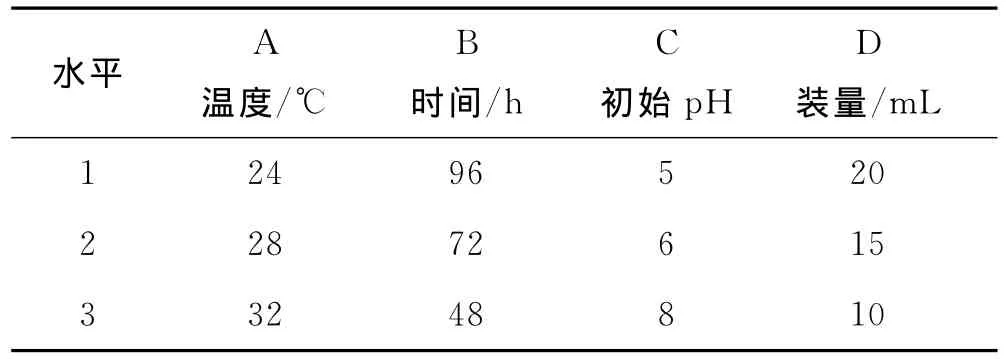
表2 因素水平表
综合以上3个酶活的正交实验分析可得如下结论,装量对酶活影响最大,其次分别为培养时间、初始pH值、培养温度.菌株X3的最佳产酶条件为A2B2C2D2,在此最佳培养条件下的FPA酶活、CMC酶活、β-G 酶活分别:2.413IU/mL、2.406IU/mL、10.633IU/mL,分别是菌株X3初始酶活的1.04倍、2.20倍、1.19倍.
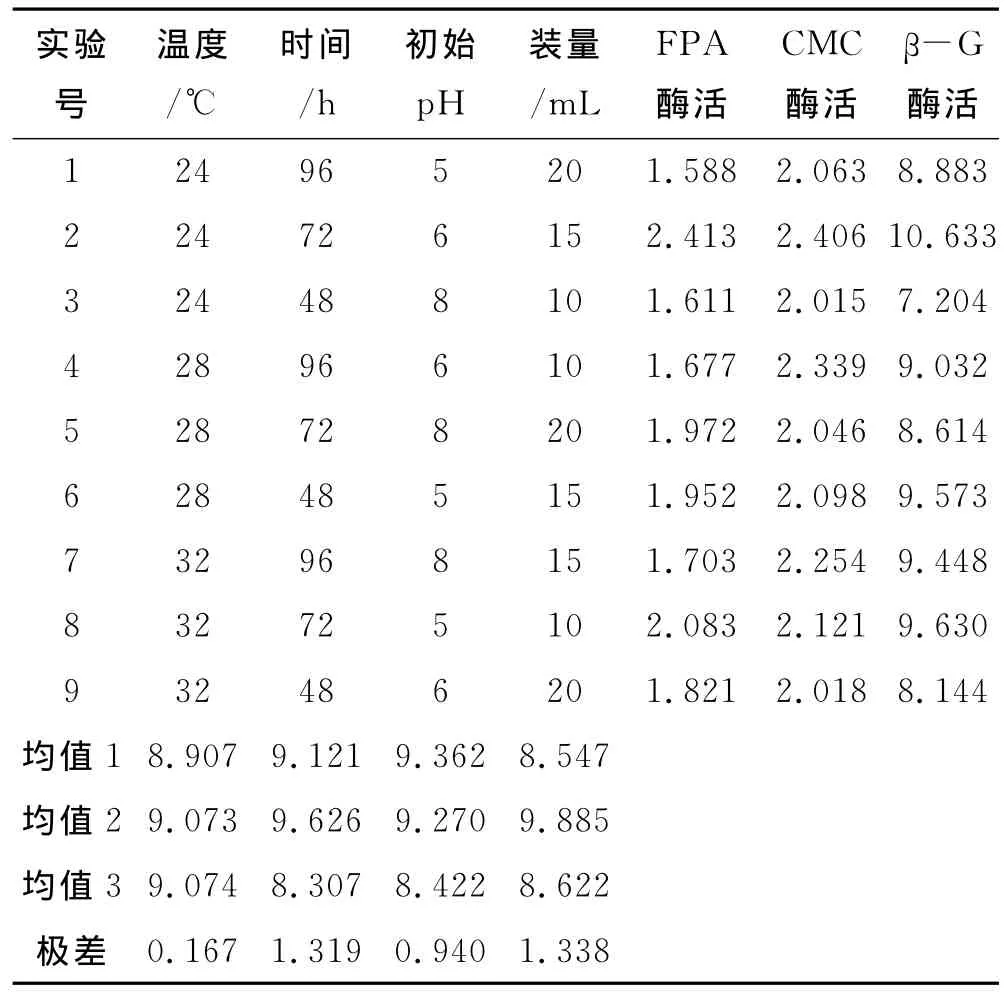
表3 正交实验结果
3 结 论
1)本实验是从三峡地区丘陵地带采样经稀释富集培养、反复分离纯化、刚果红初染,从中挑选出透明圈直径与菌落直径比较大的三株纤维素酶产生菌,经三角瓶固体发酵培养得到一株酶活最高的产生菌X3,该菌株初步鉴定为曲霉属,其CMC酶活为2.326 IU/mL、FPA酶活为1.093IU/mL、β-葡萄糖苷酶活为8.929IU/mL.
2)通过单因素实验对菌株X3产酶条件的初步探讨,发现其产酶的最佳培养温度为28℃,最佳培养时间为72h,最佳初始pH为6,最佳装量为15mL/250mL三角瓶.
本文结果将为降低纤维素酶的生产成本和提高稻草秸秆粉的利用水平提供实验基础.本论文只对部分发酵条件进行研究分析,进一步工作可以对菌株X3进行接种量、料水比、生长因子和翻动固体培养基的时间等发酵条件进行研究,或对其进行诱变育种,从而综合考虑以达到更高产酶水平.
[1]李 琦,刘伍生,刘正初.不同地点筛选纤维素酶产生菌的研究进展[J].中国农学通报,2012,28(33):194-198.
[2]Abdelnasser Salah Sheble Ibrahim,Ahmed I El-diwany.Isolation and Identification of New Cellulases Producing Thermophilic Bacteria from an Egyptian Hot Spring and Some Properties of the Crude Enzyme[J].Australian Journal of Basic and Applied Sciences,2007,1 (4):473-478.
[3]Goldemberg J.Ethanol for a Sustainable Energy Future[J].Science,2007(315):808-810.
[4]Hill J,Nelson E,Tilman D,et al.Environmental,E-conomic Andenergetic Costs and Benefits of Biodiesel and Ethanol Biofuels[J].Proc Natl Acad Sci USA,2006,103(30):11206-11210.
[5]王淑军,扬从发,陈 静.用于降解秸秆的纤维素酶产生菌的筛选研究[J].粮食与饲料工业,2001(12):21-23.
[6]宋志萍,蔡俊鹏,曹丽芳.香蕉及茶叶中纤维素酶产生菌的筛选[J].现代食品科技,2005(21):55-57.
[7]张秋卓,蔡伟民,冯玉杰.纤维素酶产生菌的筛选及产酶特性研究[J].酿酒科技,2008(4):54-57.
[8]武 峥,张迎君,周心智.降解秸秆的纤维素酶产生菌的筛选及产酶条件研究[J].纤维素科学与技术,2009,17(2):20-26.
[9]张纪忠.微生物分类学[M].上海:复旦大学出版社,1990:220-340.
