hnRNPA1在人胃癌细胞株BGC-823中的生物学功能*
2013-10-22廉亚美徐文娟王海星叶震世
廉亚美 徐文娟 王海星 叶震世
厦门大学附属中山医院消化内科(361004)
核不均一核糖核蛋白A1(heterogeneous-nuclear ribonucleoprotein A1,hnRNPA1)为hnRNP A/B亚家族成员之一,是体内重要的RNA结合蛋白,可在胞核与胞质间自由穿梭,通过调节pre-mRNA和mRNA参与转录和转录后调控过程,并能维持某些基因的稳定性,以及通过与不同基因结合激活不同信号通路,从而影响细胞生物学功能,在多种细胞分子、蛋白的成熟和生物学功能发挥以及肿瘤发生、发展过程中起重要作用[1~5]。目前对 hnRNPA1与胃癌的关系尚不十分清楚。本研究应用RNA干扰技术靶向抑制人胃癌细胞株BGC-823中的hnRNPA1表达,旨在探讨hnRNPA1在人胃癌细胞中的生物学功能,并明确其与胃癌的关系。
材料与方法
一、细胞株和主要试剂、仪器
正常人胃黏膜上皮细胞株GES-1和人胃癌细胞株MKN-28(高分化)、SGC-7901(中分化)、BGC-823(低分化)(中国科学院上海生命科学研究院细胞资源中心)。兔抗人 hnRNPA1多克隆抗体(Abcam plc.),兔抗人β-tubulin单克隆抗体、HRP标记的山羊抗兔 IgG(Cell Signaling Technology,Inc.),pU6质粒(厦门大学附属中山医院消化内科实验室保存),Lipofectamine®2000转染试剂(Life Technologies Corporation),CCK-8试剂盒(Dojindo Molecular Technologies,Inc.),Transwell®细胞小室(Costar®,Corning),Annexin V-FITC/PI双染细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司)。Leica DM2500显微镜(Leica Microsystems),BD Influx®流式细胞仪(BD Biosciences)。
二、方法
1.细胞培养:所有细胞均为贴壁细胞,接种于无菌细胞培养皿,于37℃、5%CO2培养箱内培养。GES-1细胞培养基为含10%FBS的DMEM培养基,MKN-28、SGC-7901、BGC-823细胞培养基为含10%FBS的RPMI1640培养基,两种培养基使用前均添加青霉素100 U/mL+链霉素100 μg/mL。0.02%EDTA/0.25%胰蛋白酶(1∶1)消化传代。
2.蛋白质印迹法检测hnRNPA1表达:于细胞中加入500 μL裂解液,置冰上30 min后吸出裂解液,4℃ 13523×g离心20 min,吸取上清液,加入等体积蛋白上样缓冲液(2×),100℃变性5 min,-20℃保存备用。制备12%SDS-PAGE凝胶,取蛋白样品上样并电泳,恒压冰浴电转移至PVDF膜,5%脱脂奶粉封闭1 h,加入一抗(1∶1000),室温孵育2 h或4℃摇床孵育过夜,TBST洗膜10 min×3次,加入HRP标记的二抗(1∶2000),室温孵育1 h,TBST洗膜10 min×3次,ECL法显色,摄片,观察结果。
3.靶向hnRNPA1基因的siRNA真核表达载体的构建和干扰效果验证:以pU6质粒(Amp抗性)为载体,将靶序列分别插入至相应位置,形成4条寡核苷酸链(见表1),构建siRNA hnRNPA1重组质粒。取对数生长期细胞,按3×105/孔接种于6孔板,待细胞达到85% ~90%融合,按质粒∶脂质体为4 μg∶10 μL加入 Lipofectamine®2000 与质粒复合物,4 h后更换为新鲜培养基。实验设置重组质粒(siRNA-1、siRNA-2)转染组、空质粒pU6转染组和空脂质体对照组。以含嘌呤霉素的完全培养基筛选,随机挑选克隆传代,经扩大培养,形成稳定转染细胞株。收集细胞提取总蛋白,以蛋白质印迹法检测hnRNPA1蛋白表达。

表1 siRNA hnRNPA1正义链和反义链序列
4.CCK-8实验:取对数生长期细胞,按1×103/mL、每孔 100 μL 接种于 96 孔板,分别于第 1、2、3、4、5、6 d,在每孔中加入 10 μL CCK-8 试剂,避光37℃培养箱内培养2 h,酶标仪450 nm波长处读取各孔A值。以培养时间为横坐标、各复孔平均A值为纵坐标绘制细胞生长曲线。细胞增殖抑制率=[(ApU6-A空白)-(AsiRNA-1hnRNPA1-A空白)]/(ApU6-A空白)×100%。
5.细胞划痕实验:取对数生长期细胞,按3×105/孔接种于6孔板,待细胞贴壁达到90%,以10 μL移液器枪头在每孔中间划出直线划痕,PBS洗涤3次以洗净划痕处脱落细胞,加入RPMI1640完全培养基分别培养24 h、48 h、72 h,弃去血清,PBS 洗涤2 ~3次,显微镜下观察、拍照。以0 h时细胞划痕为基线,测量72 h时细胞位移值,计算细胞迁移速率。
6.Transwell侵袭实验:细胞培养至良好状态,常规胰蛋白酶消化,计数1×104个细胞,铺于包被有鼠尾胶原蛋白的Transwell小室内,将小室放入含RPMI1640完全培养基的24孔板中,37℃、5%CO2培养箱内培养16 h,取出小室,PBS冲洗,以棉棒擦去小室底部基质膜上层细胞,预冷4%甲醇溶液固定10 min,0.2%结晶紫染色20 min,ddH2O冲洗,光学显微镜下随机选取5个20倍视野,计数穿膜细胞数,取均值。
7.细胞凋亡检测:取对数生长期细胞,按3×104/孔接种于6孔板,待细胞贴壁达到80% ~90%,以终浓度为300 mmol/L的 H2O2处理24 h,不含EDTA的胰蛋白酶消化,调整细胞密度为5×105~1×106/mL,取1 mL细胞,4℃ 94×g离心10 min,弃上清液,1 mL冷PBS洗涤2次(4℃ 94×g离心10 min),弃上清液,将细胞重悬于500 μL结合缓冲液中,加入10 μL Annexin V-FITC 和5 μL PI轻轻混匀,避光室温反应15 min或4℃反应30 min,于1 h内上流式细胞仪检测。
三、统计学分析
应用GraphPad Prism 5.0软件,所有实验均重复3次,结果以表示,两组间比较采用两独立样本t检验,P<0.05为差异有统计学意义。
结 果
一、hnRNPA1在正常人胃黏膜上皮细胞株和人胃癌细胞株中的表达
蛋白质印迹法检测显示,GES-1细胞和MKN-28、SGC-7901、BGC-823 细胞中均有 hnRNPA1 蛋白表达,胃癌细胞株表达水平明显高于正常胃黏膜上皮细胞株,BGC-823细胞表达水平最高(见图1),故选取BGC-823细胞进行后续实验。
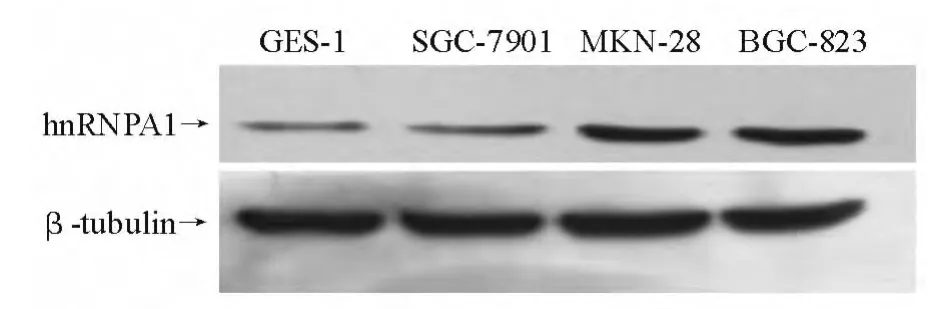
图1 正常人胃黏膜上皮细胞株和人胃癌细胞株hnRNPA1蛋白表达比较(蛋白质印迹法)
二、siRNA hnRNPA1重组质粒干扰效果验证
蛋白质印迹法检测显示,稳转siRNA-1 hnRNPA1、siRNA-2 hnRNPA1和pU6的BGC-823细胞中均有hnRNPA1蛋白表达,两组siRNA hnRNPA1稳转组表达水平明显低于pU6稳转组,表明siRNA hnRNPA1能有效抑制hnRNPA1表达,siRNA-1 hnRNPA1效果更为显著(见图2),故选取siRNA-1 hnRNPA1稳转细胞株进行后续实验。
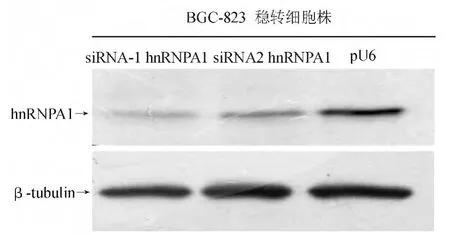
图2 siRNA hnRNPA1重组质粒干扰效果验证(蛋白质印迹法)
三、干扰hnRNPA1表达对BGC-823细胞增殖能力的影响
CCK-8实验显示,siRNA-1 hnRNPA1稳转组BGC-823细胞第1~6 d 450 nm波长处A值分别为0.24 ±0.02、0.21 ±0.01、0.30 ±0.02、0.39 ±0.03、0.59±0.03和0.67±0.02,pU6稳转组分别为0.25 ±0.03、0.33 ±0.01、0.44 ±0.02、0.62 ±0.04、0.85±0.04和 1.06±0.05(见图 3),siRNA-1 hnRNPA1稳转组第6 d细胞增殖抑制率为36.3%,表明干扰hnRNPA1表达能抑制BGC-823细胞的增殖能力。

图3 两株BGC-823细胞增殖能力比较(CCK-8实验)
四、干扰hnRNPA1表达对BGC-823细胞迁移能力的影响
细胞划痕实验显示,siRNA-1 hnRNPA1稳转组BGC-823细胞24 h、48 h、72 h迁移细胞数均明显少于pU6稳转组(见图4),两组间迁移速率差异有统计学意义[(5.44±0.25)μm/h对(9.37±0.49)μm/h,t=12.4,P <0.01],表明干扰 hnRNPA1 表达能抑制BGC-823细胞的迁移能力。
五、干扰hnRNPA1表达对BGC-823细胞侵袭能力的影响
Transwell侵袭实验显示,siRNA-1 hnRNPA1稳转组BGC-823细胞培养16 h后穿过基质膜的细胞数明显少于pU6稳转组(见图5),组间差异有统计学意义(146.30±12.56对312.51±9.62,t=18.15,P<0.01),表明干扰 hnRNPA1表达能抑制 BGC-823细胞的侵袭能力。

图4 两株BGC-823细胞迁移能力比较(细胞划痕实验,×20)
六、干扰hnRNPA1表达对BGC-823细胞凋亡的影响
流式细胞分析显示,经300 mmol/L H2O2处理24 h诱导凋亡后,siRNA-1 hnRNPA1稳转组BGC-823细胞凋亡率明显低于pU6稳转组(见图6),组间差异有统计学意义(3.6%±0.3%对12.7%±0.2%,t=25.74,P <0.01),表明干扰 hnRNPA1表达能抑制BGC-823细胞凋亡。

图5 两株BGC-823细胞侵袭能力比较(Transwell侵袭实验结晶紫染色,×20)
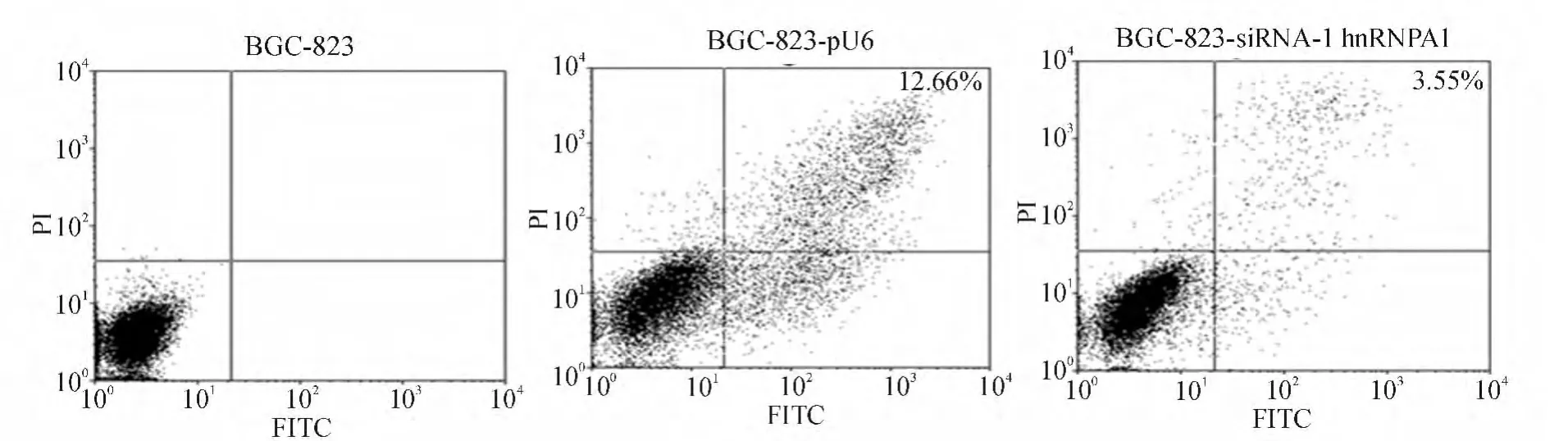
图6 两株BGC-823细胞凋亡情况比较(Annexin V-FITC/PI双染色流式细胞分析)
讨 论
研究表明hnRNPA1能通过与mRNA结合以及调节pre-mRNA的剪接位点影响细胞生物学功能,其突变或缺失与多种疾病以及肿瘤发生、发展密切相关。文献报道hnRNPA1在人散发性结直肠癌[6]、肝癌[7,8]、非小细胞肺癌[9]、乳腺癌[10]等多种恶性肿瘤中呈高表达。hnRNPA1可与含端粒重复序列的 RNA(telomeric repeat-containing RNA,TERRA)结合或与端粒DNA序列结合,既可减弱由TERRA介导的端粒酶抑制,又可在数量多于TERRA的情况下抑制端粒延长,与TERRA一起像开关一样调控端粒酶活性和端粒长度[11]。Ushigome 等[6]发现,结直肠癌细胞中hnRNPA1过表达可维持端粒重复序列长度,促进肿瘤细胞增殖。Hiyama等[12]对66例胃癌原发灶的分析显示其中85%存在端粒酶活性,而邻近正常胃黏膜仅6%显示端粒酶活性且均为弱阳性,绝大多数检出端粒酶活性的胃癌体积较大并处于进展期,端粒酶阳性者生存期显著短于端粒酶阴性者。该研究结果表明端粒酶激活是胃癌发生、发展中的关键环节,由此推测hnRNPA1可能与胃癌相关。本实验发现正常人胃黏膜上皮细胞株GES-1的hnRNPA1蛋白表达水平明显低于高、中、低分化人胃癌细胞株 MKN-28、SGC-7901和BGC-823,证实hnRNPA1在恶性肿瘤细胞中呈高表达。
已知肿瘤细胞的生长主要通过需氧糖酵解供能,同时肿瘤细胞可利用需氧糖酵解途径的中间产物进行合成代谢,促使细胞快速增殖,hnRNPA1在葡萄糖代谢氧化磷酸化与需氧糖酵解的转换过程中发挥关键调控作用[13]。David等[14]的研究表明,肿瘤细胞中过表达的原癌基因c-Myc可在转录水平上调hnRNPA1表达,hnRNPA1通过调控丙酮酸激酶M型同工酶(PKM)pre-mRNA的剪接位点以提高PKM2(胚胎型,促进需氧糖酵解)/PKM1(成人型,促进氧化磷酸化)比例,从而促进需氧糖酵解和肿瘤细胞增殖。除参与调节pre-mRNA和mRNA外,hnRNPA1对NF-κB依赖性转录活性亦具有调控作用。NF-κB作为转录因子参与了机体内多种生物学应答,如免疫应答和炎症反应的调节,并通过调节增殖、迁移、凋亡相关基因表达在肿瘤发生、发展中起重要作用,多种人类恶性肿瘤中存在NF-κB异常或组成性激活[15]。Hay 等[16]的研究中,体内外实验均证明NF-κB抑制蛋白 α(IκBα)在胞质内可直接与hnRNPA1特异性结合而降解,导致NF-κB依赖性转录活性增强,hnRNPA1缺失的细胞NF-κB依赖性转录活性亦缺失,而恢复hnRNPA1表达可恢复NF-κB对相关信号的有效应答。
Li等[7]发现以RNA干扰技术下调hnRNPA1表达,人肝癌细胞株HepG2的增殖和迁移能力均受抑,过表达hnRNPA1则能增强正常人肝细胞株HL-7702的增殖和迁移能力。本实验亦发现靶向干扰hnRNPA1表达可显著抑制hnRNPA1高表达人胃癌细胞株BGC-823的增殖和迁移能力,提示hnRNPA1能促进人胃癌细胞增殖和迁移。
Zhou等[8]对人肝癌细胞株和肝细胞癌组织的研究显示,敲除高转移性肝癌细胞株的hnRNPA1表达可显著降低其侵袭能力,上调低转移性肝癌细胞株的hnRNPA1表达则可显著增强其侵袭能力,hnRNPA1系通过调节CD44v6表达而发挥其促侵袭作用;hnRNPA1高表达的肝细胞癌患者总生存期短,复发率高。本实验亦发现以RNA干扰技术下调hnRNPA1表达可使BGC-823细胞的侵袭能力显著受抑,提示hnRNPA1能促进人胃癌细胞侵袭。
已知水泡性口炎病毒(VSV)基质蛋白可抑制mRNA 的核-质转运,然而 Pettit Kneller等[17]对 VSV感染HeLa细胞的研究却显示,VSV可通过mRNA输出因子Rae1使hnRNPA1从胞核转运至胞质,参与VSV诱导的细胞凋亡;hnRNPA1表达下调后,VSV诱导的细胞凋亡速度明显减慢。但Yao等[18]报道异位表达凋亡相关蛋白Bcl-xL mRNA的3’-非翻译区(3’-UTR)可干扰核仁蛋白B23定位至胞质并与hnRNPU、hnRNPA1形成复合体,从而增强mRNA合成抑制剂放线菌素D或有丝分裂阻滞诱导的细胞凋亡,提示B23/hnRNPU/hnRNPA1复合体能促进细胞存活。由此推测,在不同作用条件下和不同环境中,hnRNPA1在细胞凋亡中所起的作用不尽相同。本实验以凋亡诱导剂H2O2诱导细胞凋亡,发现hnRNPA1表达受抑的BGC-823细胞凋亡率较对照组显著降低,提示hnRNPA1对人胃癌细胞具有诱导凋亡作用,具体机制有待进一步研究。
综上所述,本实验发现hnRNPA1在人胃癌细胞中呈高表达;以RNA干扰技术构建靶向hnRNPA1基因的siRNA重组质粒并稳定转染人胃癌细胞株BGC-823,稳转细胞株hnRNPA1表达下调,细胞增殖、迁移、侵袭、凋亡均显著受抑。鉴于人类恶性肿瘤的侵袭、转移与肿瘤细胞的黏附、迁移、侵袭能力密切相关,推测hnRNPA1可能通过促进肿瘤细胞增殖、迁移、侵袭,在胃癌侵袭和转移过程中发挥作用。
1 Dreyfuss G,Kim VN,Kataoka N.Messenger-RNA-binding proteins and the messages they carry[J].Nat Rev Mol Cell Biol,2002,3(3):195-205.
2 Glisovic T,Söderberg M,Christian K,et al.Interplay between transcriptional and post-transcriptional regulation of Cyp2a5 expression[J].Biochem Pharmacol,2003,65(10):1653-1661.
3 Glisovic T,Ben-David Y,Lang MA,et al.Interplay between hnRNP A1 and a cis-acting element in the 3’UTR of CYP2A5 mRNA is central for high expression of the gene[J].FEBS Lett,2003,535(1-3):147-152.
4 Ji Y,Tulin AV.Poly(ADP-ribose)controls DE-cadherindependent stem cell maintenance and oocyte localization[J].Nat Commun,2012,3:760.
5 Kim HJ,Kim NC,Wang YD,et al.Mutations in prionlikedomainsin hnRNPA2B1 and hnRNPA1 cause multisystem proteinopathy and ALS[J].Nature,2013,495(7442):467-473.
6 Ushigome M,Ubagai T,Fukuda H,et al.Up-regulation of hnRNP A1 gene in sporadic human colorectal cancers[J].Int J Oncol,2005,26(3):635-640.
7 Li S,Wang W,Ding H,et al.Aptamer BC15 against heterogeneous nuclear ribonucleoprotein A1 has potential value in diagnosis and therapy of hepatocarcinoma[J].Nucleic Acid Ther,2012,22(6):391-398.
8 Zhou ZJ,Dai Z,Zhou SL,et al.Overexpression of HnRNP A1 promotes tumor invasion through regulating CD44v6 and indicates poor prognosis for hepatocellular carcinoma[J].Int J Cancer,2013,132(5):1080-1089.
9 Boukakis G,Patrinou-Georgoula M,Lekarakou M,et al.Deregulated expression of hnRNP A/B proteins in human non-small cell lung cancer:parallel assessment of protein and mRNA levels in paired tumour/non-tumour tissues[J].BMC Cancer,2010,10:434.
10 Li S,Xu H,Ding H,et al.Identification of an aptamer targeting hnRNP A1 by tissue slide-based SELEX[J].J Pathol,2009,218(3):327-336.
11 Redon S,Zemp I,Lingner J.A three-state model for the regulation of telomerase by TERRA and hnRNPA1[J].Nucleic Acids Res,2013,41(19):9117-9128.
12 Hiyama E,Yokoyama T,Tatsumoto N,et al.Telomerase activity in gastric cancer[J].Cancer Res,1995,55(15):3258-3262.
13 Chen M,Zhang J,Manley JL.Turning on a fuel switch of cancer:hnRNP proteins regulate alternative splicing of pyruvate kinase mRNA[J].Cancer Res,2010,70(22):8977-8980.
14 David CJ,Chen M,Assanah M,et al.HnRNP proteins controlled by c-Myc deregulate pyruvate kinase mRNA splicing in cancer[J].Nature,2010,463(7279):364-368.
15 Dolcet X,Llobet D,Pallares J,et al.NF-kB in development and progression of human cancer[J].Virchows Arch,2005,446(5):475-482.
16 Hay DC,Kemp GD,Dargemont C,et al.Interaction between hnRNPA1 and IkBa is required for maximal activation of NF-kB-dependent transcription[J].Mol Cell Biol,2001,21(10):3482-3490.
17 Pettit Kneller EL,Connor JH,Lyles DS.hnRNPs relocalize to the cytoplasm following infection with vesicular stomatitis virus[J].J Virol,2009,83(2):770-780.
18 Yao Z,Duan S,Hou D,et al.B23 acts as a nucleolar stress sensor and promotes cell survival through its dynamic interaction with hnRNPU and hnRNPA1[J].Oncogene,2010,29(12):1821-1834.
