siRNA沉默p28GANK对结肠癌细胞增殖的影响
2013-09-07蔡炜龙许洪宝汪伟民
蔡炜龙 许洪宝 汪伟民
浙江省湖州市中心医院普外科(313000)
结肠癌是消化道常见恶性肿瘤之一。全球范围内,结肠癌的发病率在恶性肿瘤中位居第三位,严重影响人类健康[1],其发病机制与年龄、环境、家族史、结肠疾病史、遗传易感性等因素有关,是一个多阶段、涉及多病程改变的逐渐积累的复杂过程。目前结肠癌的治疗以外科手术为主,尚缺乏疗效显著的内科药物治疗手段。本课题的前期研究[2]发现p28GANK在结肠癌组织中的表达水平显著高于癌旁非癌组织,且与肿瘤浸润深度、分化程度、淋巴结转移、Dukes分期相关,提示p28GANK可能在结肠癌恶性进展过程中起重要作用。RNA干扰(RNA interfering,RNAi)现象是一种序列特异性、转录后基因沉默的过程。在哺乳动物细胞中,小分子干扰RNA(small interfering RNA,siRNA)可有效诱导RNAi现象,从而抑制目的基因表达。本研究应用慢病毒携带siRNA表达载体沉默p28GANK在结肠癌细胞株HT29中的表达,探讨p28GANK在结肠癌发生、发展过程中的作用,以期为结肠癌的生物治疗提供新靶点。
材料与方法
一、细胞株、主要试剂
人结肠癌细胞株HT29(美国ATCC公司)传代培养于含10%胎牛血清以及1%青霉素-链霉素双抗(HyClone公司)的 RPMI1640培养基中;针对p28GANK基因的慢病毒携带的siRNA载体(目的序列:5’-CTG ACC AGG ACA GCA GAA C-3’)、不含siRNA的对照病毒(上海吉凯基因化学技术有限公司构建)[慢病毒均带有绿色荧光蛋白(GFP)编码基因];兔抗人p28GANK多克隆抗体(美国Santa Cruz公司);β-actin抗体(美国Sigma公司);辣根过氧化物酶(HRP)标记的羊抗兔、羊抗鼠IgG二抗、细胞裂解液、ECL发光试剂盒、甲基噻唑基四唑(MTT)、甲紫、碘化丙啶(PI)染液(北京中山生物技术有限公司)。
二、方法
1.慢病毒转染:取对数生长期的HT29细胞以胰酶消化,5×103/孔接种于96孔板,于培养箱中(5%CO2、37℃)培养24 h,去除上清液,以无血清培养基清洗一次,每孔再加入0.6 mL无血清培养基,将针对p28GANK基因的siRNA慢病毒、对照病毒、RPMI1640培养基5 μL/孔加入孔中,轻摇至均匀,于培养箱中培养6 h后去除上清液,加入含1%青霉素-链霉素双抗的10%胎牛血清培养基,待细胞融合度达到80%时,以胰酶消化细胞,采用流式细胞术分选带有绿色荧光细胞继续培养48 h,荧光显微镜下随机选取5个视野(×100)计数绿色荧光细胞,绿色荧光细胞数/总细胞数≥95%表明转染细胞株构建成功,将 siRNA慢病毒、对照病毒和RPMI1640培养基转染的细胞株分别命名为Si-HT29、Con-HT29、HT29 细胞株。
2.蛋白质印迹法:以细胞裂解液抽提 HT29、Con-HT29、Si-HT29 细胞总蛋白,取 200 μg蛋白质于95℃加热变性5 min,经12%聚丙烯酰胺凝胶电泳分离,依次进行转膜、封闭,加入兔抗人p28GANK多克隆抗体(1∶100)、β-actin 抗体(1∶300),4 ℃孵育过夜,室温下复温30 min后以PBS清洗3次,分别加入HRP标记的羊抗兔IgG二抗(1∶2000)、羊抗鼠IgG二抗(1∶3000)孵育60 min,PBS再次清洗2次,加入ECL发光液显色并定影,采用Bandscan 5.0软件行条带灰度分析,取p28GANK蛋白与内参的灰度比值表示其相对表达量。
3.MTT法:取对数生长期的 HT29、Con-HT29、Si-HT29细胞,以胰酶消化,制备细胞悬液,以1×103/孔接种于96孔板,每组细胞设3个复孔,分别培养1、2、3、4、5、6、7 d 后,每孔加入 5 mg/mL MTT 20 μL,常温静置4 h后去除上清液,加入二甲基亚砜(DMSO)150 μL,低速振荡10 min。以酶联检测仪测定490 nm波长处各孔吸光度(A)值,绘制细胞生长曲线。
4.平板克隆实验:取对数生长期的HT29、Con-HT29、Si-HT29细胞制备细胞悬液,以500/孔接种于6孔板,培养7 d后以PBS冲洗,4%甲醛固定10 min,甲紫染色10 min,以自来水冲洗。于光学显微镜下(×100)计数细胞克隆数量,每组细胞重复三次。
5.流式细胞术检测细胞周期:取对数生长期的HT29、Con-HT29、Si-HT29细胞,以胰酶消化,然后1000 r/min(离心半径10 cm)离心5 min后去除上清液,加入预冷的PBS重悬细胞,再次离心(参数同前),去除上清液,加入70%乙醇于4℃冰箱过夜,离心(参数同前)5 min,去除上清液,再次加入PBS清洗,加入PI染液于4℃冰箱避光孵育30 min,以流式细胞仪检测细胞周期。每组细胞重复三次。计算细胞增殖指数(PI),PI=(S+G2)/(S+G2+G0/G1)。
三、统计学分析
结 果
一、p28GANK蛋白表达水平
蛋白质印迹法检测结果显示,Si-HT29细胞中p28GANK蛋白表达水平显著低于HT29、Con-HT29细胞(P<0.05),HT29、Con-HT29细胞间差异无统计学意义(P>0.05)(见图1)。
二、细胞增殖能力变化
MTT法检测结果显示,培养第2 d时,HT29、Con-HT29、Si-HT29细胞增殖速度相比差异无统计学意义(P >0.05),培养第3~7 d时,Si-HT29细胞增殖速度较HT29、Con-HT29细胞显著减缓(P<0.05),HT29、Con-HT29 细胞间差异无统计学意义(P >0.05)(见图2)。
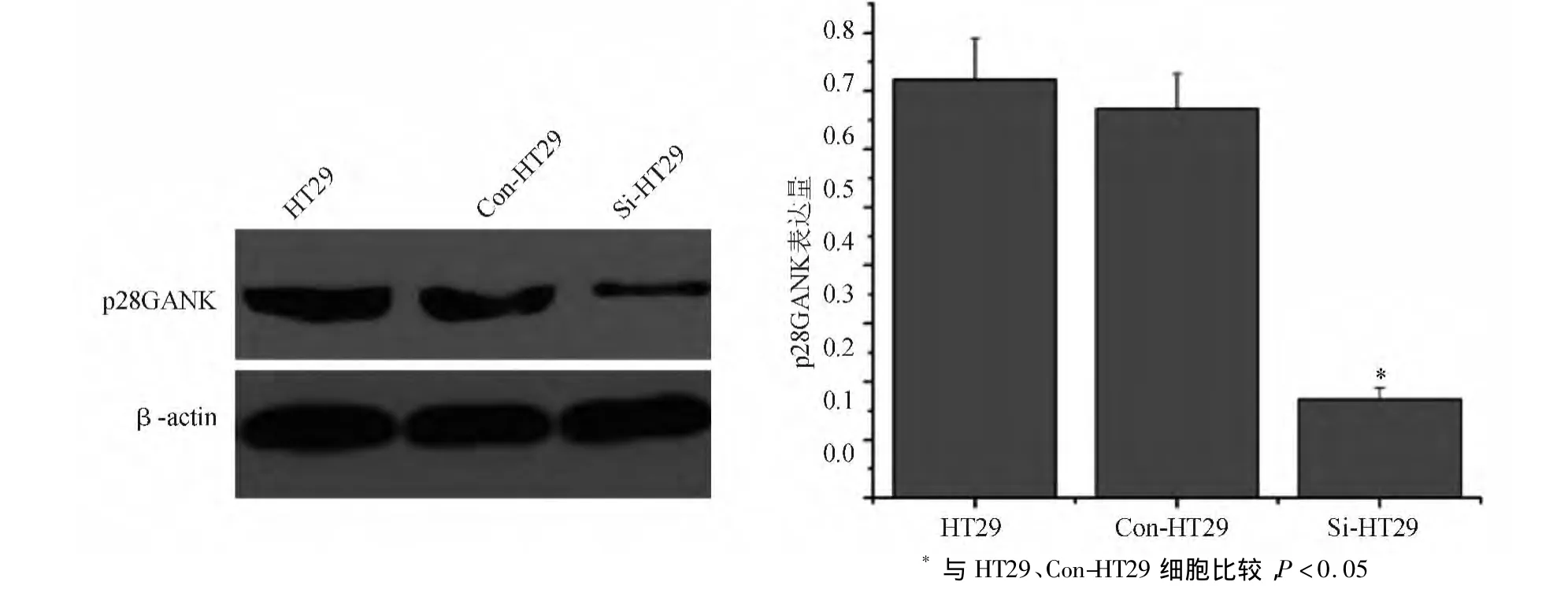
图1 HT29、Con-HT29、Si-HT29细胞的p28GANK蛋白表达情况(蛋白质印迹法)
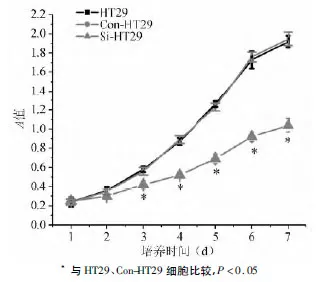
图2 HT29、Con-HT29、Si-HT29细胞生长曲线图
三、细胞克隆形成能力
平板克隆实验结果显示,培养7 d后,HT29、Con-HT29、Si-HT29细胞形成克隆的数量分别为110.31 ±12.52、109.92 ± 6.51、33.73 ± 9.75,Si-HT29细胞克隆数量较HT29、Con-HT29细胞显著减少(P <0.05),HT29、Con-HT29细胞间差异无统计学意义(P >0.05)(见图3)。
四、细胞周期变化
流式细胞术检测结果显示,与HT29、Con-HT29细胞相比,Si-HT29细胞中G0/G1期细胞比例显著增多,S期细胞比例显著减少,PI值显著降低(P<0.05)(见图4)。
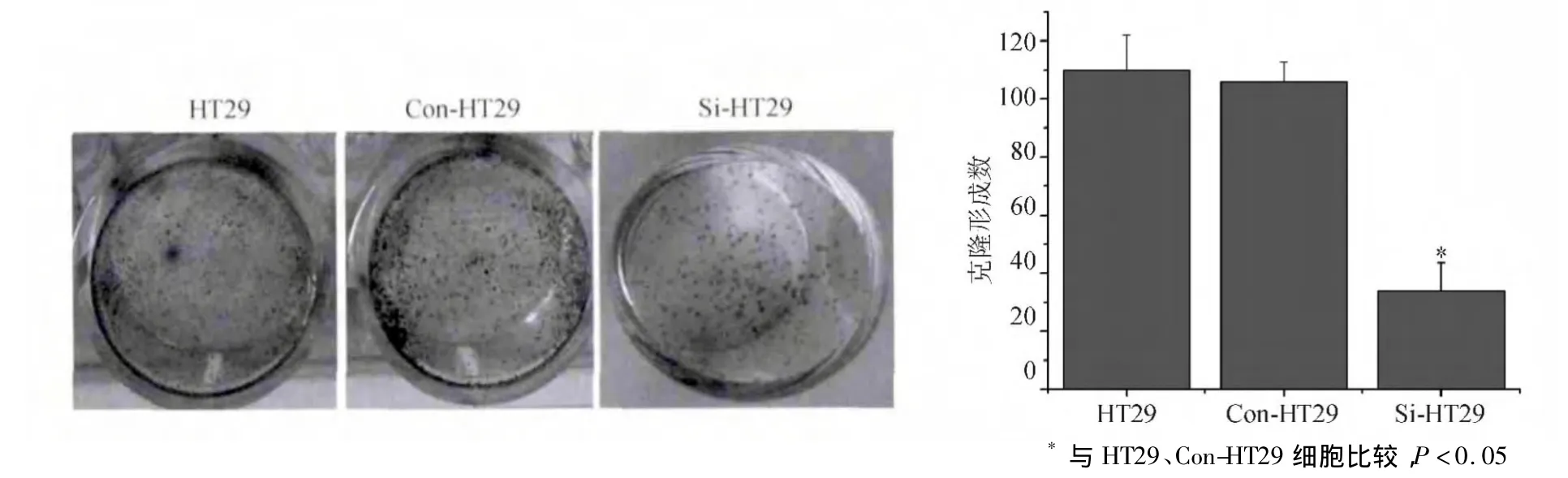
图3 HT29、Con-HT29、Si-HT29细胞平板克隆形成结果
讨 论

图4 流式细胞术检测细胞周期以及PI值
结肠癌的演变过程涉及多因素、多分子信号转导通路,一部分分子在其中发挥关键作用,针对这些关键分子采取生物靶向治疗,是提高结肠癌治疗效果的有效方法。p28GANK又名Gankyrin或PSMD10,定位于人类染色体Xq22.3,最早从肝细胞癌组织中由消减杂交技术分离得来,具有6个重复的ankyrin结构域蛋白,含226个氨基酸,在哺乳动物中高度保守[3~5]。除脑和心脏外,p28GANK 在人体正常组织中多为阴性表达。研究[6~8]表明,p28GANK 在肝癌、食管癌、胰腺癌中表达上调,在肿瘤恶性进展过程中发挥重要作用,下调p28GANK表达能抑制肿瘤细胞恶性进展过程。本课题的前期研究[2]显示,p28GANK表达与结肠癌恶性程度相关,其高表达提示患者预后不良。p28GANK可作为结肠癌诊断和预后判断的指标,是结肠癌潜在的治疗靶点。
siRNA技术可使目标基因转录后沉默,具有显著下调目的基因表达的作用,是目前研究基因的重要方法[9]。慢病毒作为表达载体具有无毒、转染效率高的特性[10]。本研究构建了慢病毒携带siRNA作为下调p28GANK表达的工具,该载体包含GFP编码基因,转染成功的细胞在荧光显微镜下显示绿色荧光,可有效判断转染效率,且本研究通过绿色荧光,应用流式细胞术进一步分选阳性转染细胞,使阳性转染率达95%以上。蛋白质印迹法检测发现,siRNA慢病毒显著抑制了p28GANK在结肠癌细胞株HT29中的表达水平,提示Si-HT29细胞株构建成功。以HT29细胞和Con-HT29细胞为对照,行MTT法检测发现,Si-HT29细胞增殖速度显著减缓;行平板克隆实验检测发现,Si-HT29细胞平板克隆形成能力显著降低;进一步应用流式细胞术检测细胞周期变化,结果显示Si-HT29细胞中G0/G1期细胞比例显著升高,而S期细胞比例显著降低,通过计算PI值证实Si-HT29细胞增殖能力显著降低。上述研究结果与在食管癌、胰腺癌等肿瘤细胞中下调p28GANK水平的效应一致,提示p28GANK可作为恶性肿瘤生物治疗的重要靶点。
多项研究[11,12]显示,p28GANK 能够通过激活周期素依赖性蛋白激酶4(CDK4),促进癌基因Rb编码蛋白磷酸化失活。Higashitsuji等[13]的研究发现,p28GANK可与癌基因MDM2结合,增强MDM2的生物活性,导致其对抑癌基因p53的降解能力增加。此外,Man等[14]的研究发现,在肺癌细胞中p28GANK可通过调节RhoA/ROCK信号转导通路促进Ras活化,后者在肿瘤发生过程中起重要作用。CDK4激活、Rb磷酸化以及抑癌基因p53降解均可导致细胞阻滞于G1期,降低细胞增殖能力[11]。此与本研究结果一致,下调p28GANK表达导致结肠癌HT29细胞增殖抑制、克隆形成能力降低,细胞发生G1期阻滞。Kim等[15]的研究发现,p28GANK在乳腺癌组织中表达上调,其表达水平与癌基因ErbB2呈正相关。下调p28GANK在乳腺癌细胞中的表达,可显著抑制肿瘤细胞增殖能力。此外,在肝癌细胞中下调p28GANK的表达可抑制上皮-间质细胞转化,从而抑制肝癌细胞转移能力[16]。Zhen等[16]的研究发现,p28GANK可通过激活Rac1促进乳腺癌细胞转移[17]。上述研究结果提示p28GANK在肿瘤转移中亦扮演重要角色。有关p28GANK在结肠恶性肿瘤增殖、侵袭以及转移中的作用机制有待进一步深入研究。
总之,本研究应用慢病毒携带siRNA表达载体有效下调了p28GANK在结肠癌细胞株HT29中的表达水平。下调p28GANK表达后,结肠癌细胞增殖能力降低,细胞周期阻滞,提示p28GANK可作为结肠癌生物治疗的新靶点。
1 Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
2 蔡伟龙,许洪宝,汪伟民.p28GANK在结肠癌中的表达及其意义[J].胃肠病学,2013,18(2):105-108.
3 Hori T,Kato S,Saeki M,et al.cDNA cloning and functional analysis of p28(Nas6p)and p40.5(Nas7p),two novel regulatory subunits of the 26S proteasome[J].Gene,1998,216(1):113-122.
4 Krzywda S,Brzozowski AM,Higashitsuji H,et al.The crystal structure of gankyrin,an oncoprotein found in complexes with cyclin-dependentkinase 4,a 19 S proteasomal ATPase regulator,and the tumor suppressors Rb and p53[J].J Biol Chem,2004,279(2):1541-1545.
5 Yuan C,Li J,Mahajan A,et al.Solution structure of the human oncogenic protein gankyrin containing seven ankyrin repeats and analysis of its structure--function relationship[J].Biochemistry,2004,43(38):12152-12161.
6 Fu XY,Wang HY,Tan L,et al.Overexpression of p28/gankyrin in human hepatocellular carcinoma and its clinical significance[J].World J Gastroenterol,2002,8(4):638-643.
7 Ortiz CM,Ito T,Tanaka E,et al.Gankyrin oncoprotein overexpression as a critical factor for tumor growth in human esophagealsquamouscellcarcinoma and itsclinical significance[J].Int J Cancer,2008,122(2):325-332.
8 Meng Y,He L,Guo X,et al.Gankyrin promotes the proliferation of human pancreatic cancer[J].Cancer Lett,2010,297(1):9-17.
9 童锦禄,郑青,徐锡涛,等.siRNA沉默PPARα减弱羟喜树碱诱导的人结肠癌细胞凋亡[J].胃肠病学,2010,15(5):275-279.
10 周艳艳,周南翔,霍继荣.siRNA靶向抑制HDGF基因对人肝癌细胞株增殖和侵袭力的影响[J].胃肠病学,2009,14(10):585-588.
11 Li J,Tsai MD.Novel insights into the INK4-CDK4/6-Rb pathway:counter action of gankyrin against INK4 proteins regulates the CDK4-mediated phosphorylation of Rb[J].Biochemistry,2002,41(12):3977-3983.
12 Higashitsuji H,Itoh K,Nagao T,et al.Reduced stability of retinoblastoma protein by gankyrin,an oncogenic ankyrin-repeat protein overexpressed in hepatomas[J].Nat Med,2000,6(1):96-99.
13 Higashitsuji H,Higashitsuji H,Itoh K,et al.The oncoprotein gankyrin bindsto MDM2/HDM2,enhancing ubiquitylation and degradation of p53[J].Cancer Cell,2005,8(1):75-87.
14 Man JH,Liang B,Gu YX,et al.Gankyrin plays an essential role in Ras-induced tumorigenesis through regulation of the RhoA/ROCK pathway in mammalian cells[J].J Clin Invest,2010,120(8):2829-2841.
15 Kim YH,Kim JH,Choi YW,et al.Gankyrin is frequently overexpressed in breast cancer and is associated with ErbB2 expression[J].Exp Mol Pathol,2013,94(2):360-365.
16 Fu J,Chen Y,Cao J,et al.p28GANK overexpression accelerates hepatocellular carcinoma invasiveness and metastasis via phosphoinositol 3-kinase/AKT/hypoxiainducible factor-1α pathways[J].Hepatology,2011,53(1):181-192.
17 Zhen C,Chen L,Zhao Q,et al.Gankyrin promotes breast cancer cell metastasis by regulating Rac1 activity[J].Oncogene,2013,32(29):3452-3460.
