HGF蛋白在前列腺癌患者肿瘤组织及血浆中的表达
2013-10-22冯香梅乔岭梅
王 勇,冯香梅,乔岭梅,岳 丹
(1.天津医科大学第二医院泌尿外科,天津市泌尿外科研究所,天津300211;2.天津医科大学医学检验学院,天津300203;3.中国人民解放军第二五四医院,天津300142)
在我国,近年随着人均寿命的延长,膳食结构的改变和诊断技术的提高,前列腺癌(prostate cancer,PC)发病率有明显增高的趋势。肝细胞生长因子(hepatocytegrowth factor,HGF)是由间质细胞衍生的细胞因子,通过自分泌或旁分泌的形式作用于数种上皮源性细胞。通过作用于细胞膜表面的特异性跨膜受体c-MET蛋白发挥生物学作用,具有强促分裂、组织形成、诱导上皮细胞迁移、侵袭、诱导血管形成以及抑制细胞凋亡等作用[1]。既往研究发现在胃癌、乳腺癌及肺癌等恶性肿瘤患者的肿瘤组织及血浆中HGF的浓度与肿瘤的进展相关[2-5]。本实验拟观察前列腺癌患者组织标本及血浆中HGF表达情况,为前列腺癌的诊治提供新的理论基础。
1 资料与方法
1.1 研究对象 收集天津医科大学第二医院2011年手术或穿刺活检的前列腺癌38例和良性前列腺增生(benign prostatic hyperplasia,BPH)组织标本 30例。病人年龄58~82岁。患者通过术后或穿刺活检标本病理确诊为前列腺癌,通过肛诊、骨扫描、CT、MRI及彩超来辅助进行前列腺癌的临床分期。前列腺癌病理类型为前列腺腺癌;良性前列腺增生作为对照。
1.2 方法
1.2.1 试剂及仪器 兔抗人HGF多克隆抗体(Abcam),β-actin抗体(Santa Cruz),SP染色试剂盒(福州迈新生物),HGF(h)ELISA试剂盒、DAB显色试剂盒(武汉博士德),RM2135组织切片机(LEICA),光学显微镜(OLYMPUS),酶标仪 550(Bio-Rad)。
1.2.2 免疫组化 采用链霉素抗生物素蛋白氧化物酶免疫组化法(streptavidin-peroxidase conjugated method,SP法),标本石蜡切片,HGF一抗4℃孵育过夜,磷酸盐缓冲液(phosphate buffer solution,PBS)代替一抗作为阴性对照。根据各标记物的反应强度按阳性细胞所占细胞数量百分比与阳性细胞的染色强度进行评分。两者分值相加最后得分:0~3分为阴性(-),3.5~6分为阳性(+),6.5~8分为强阳性(++)。见表 1。
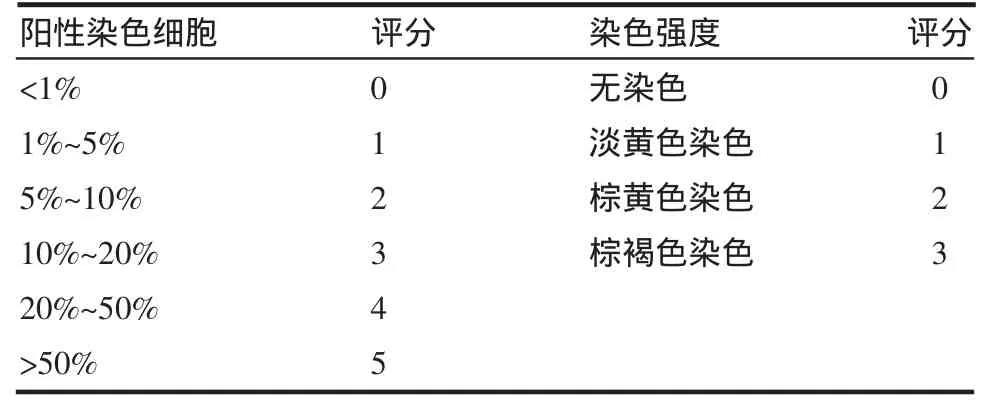
表1 免疫组化评分标准Tab1 Thestandard of immunohistochem istry score
1.2.3 ELISA 按照说明书配制检测所需的标准品及工作液,加入标准品及待测血清,反应后弃去板内液体,加入生物素抗人HGF抗体工作液,37℃反应60min,反复洗涤后加入亲和素-过氧化物酶复合物(avidin-peroxidase complex,ABC)工作液,反应后再次洗涤,先后加入TMB显色液及终止液,使用酶标仪在450 nm测定OD值,建立曲线,计算HGF浓度。
1.3 统计分析 采用SPSS11.5统计软件包对数据进行统计分析,具体分析统计方法见结果,以P<0.05为判断差异显著性标准。
2 结果
2.1 前列腺癌及前列腺增生组织中HGF的表达 前列腺增生及前列腺癌组织中HGF染色集中在间质的成纤维细胞及其周围,癌细胞中少量表达(图1)。前列腺增生及前列腺癌组织中HGF表达阳性率分别为43.33%(30例有13例表达)及78.95%(38例有30例表达),统计分析显示二者之间差异具有高度显著性(P<0.01)。HGF的表达与前列腺癌Gleason评分及T分期有关,Gleason评分大于7的癌组织中HGF表达高于Gleason评分小于7的癌组织(P<0.05);与T1/T2期肿瘤相比较,T3/T4期肿瘤中HGF表达增高,差异具有显著性(P<0.05);本实验中PSA≤10 ng/mL与>10 ng/mL的患者之间及年龄≤70岁与>70岁的前列腺癌患者之间相比较,癌组织中HGF表达差异无显著性(P>0.05),见表2。
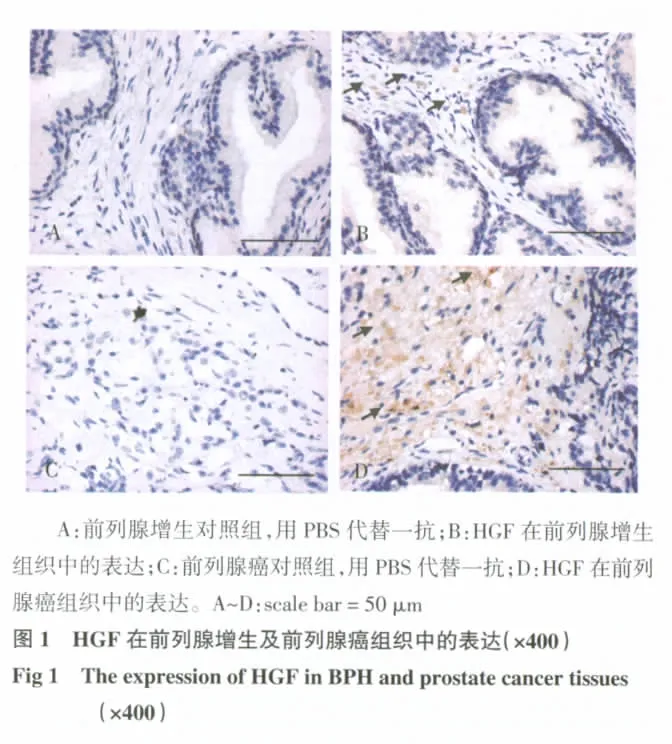

表2 前列腺癌组织中HGF的表达与各项临床参数的关系Tab2 Comparison ofHGF exp ression in the tissuesaccording to different patient characteristic
2.2 前列腺癌及前列腺增生患者血浆中HGF浓度 前列腺癌患者血浆中HGF浓度明显高于前列腺增生患者血浆中HGF浓度,二者比较差异具有高度显著性(P<0.01);与HGF在组织中表达相对应,患者血浆中的HGF浓度与前列腺癌Gleason评分及临床分期有关;Gleason评分>7及Gleason评分≤7的患者血浆中HGF浓度比较差异有显著性(P<0.05);与肿瘤局限于前列腺内的患者相比,肿瘤突破包膜的患者血浆中HGF水平升高,差异有显著性(P<0.05);前列腺癌患者的PSA水平及年龄不影响血浆中HGF的水平,见表3。

表3 前列腺癌患者血浆中HGF浓度与各项临床参数的关系Tab3 Comparison of HGF level in the serum according to different patient characteristic
2.3 HGF在前列腺癌组织及血浆表达的相关性分析 应用Spearman秩相关分析证实HGF在前列腺癌组织及血浆表达呈正相关(rs=0.49,P=0.025)。
3 讨论
本研究通过对前列腺增生及前列腺癌患者组织及血浆中的HGF表达进行检测发现:前列腺癌患者癌组织及血浆中HGF表达明显高于前列腺增生患者,HGF表达与前列腺癌临床分期和Gleason评分相关。
前列腺癌是一种极易发生侵袭和转移的男性泌尿生殖系统肿瘤。我国前列腺癌的发病率虽明显低于欧美国家,但近年来有增高的趋势。前列腺癌发病隐匿,很多患者就诊时即有淋巴结或骨转移,前列腺癌根治术后患者肿瘤的复发及转移,治疗过程中进展为激素非依赖性前列腺癌,这都是目前前列腺癌的治疗效果较差的原因。因此明确前列腺癌发生及进展的机制,寻找新的诊断及治疗靶点成为当务之急。
HGF是由间质细胞衍生的细胞因子,通过自分泌或旁分泌的形式作用于数种上皮源性细胞,包括肿瘤细胞。通过作用于细胞膜表面的特异性跨膜受体c-MET蛋白发挥生物学作用,具有强促分裂、组织形成、诱导上皮细胞迁移、侵袭、诱导血管形成以及抑制细胞凋亡等作用[1]。与前列腺增生患者相比,前列腺癌患者血液中HGF浓度升高,肿瘤发生淋巴结转移或者术后复发后,患者血液中HGF会进一步增高[6-7]。本研究同时对前列腺癌患者癌组织及血浆中HGF进行检测发现前列腺癌患者癌组织及血浆中HGF明显高于前列腺增生患者,且与前列腺癌临床分期和Gleason评分相关,进一步研究发现前列腺癌组织及血浆中HGF的表达呈正相关,因此我们认为组织及血浆中的HGF可能成为前列腺癌筛查及预测肿瘤转移的重要标志物。
Tsuka[8]研究组认为前列腺癌可能通过自分泌和旁分泌的形式来调节HGF的合成,这是前列腺癌患者血浆中HGF升高的重要原因。体外实验证实前列腺癌可以通过旁分泌的方式分泌一些因子来刺激间质的成纤维细胞分泌HGF,但是前列腺癌中HGF合成的自分泌调节机制尚不清楚。Nakashiro[9-10]研究组发现前列腺基质细胞分泌HGF,作为旁分泌生长因子刺激激素非依赖性前列腺癌细胞生长,促进激素依赖性前列腺癌发生表型转换。本研究中免疫组化结果发现HGF染色主要位于前列腺癌间质的成纤维细胞浆中及其周围,癌细胞中只有少量表达,因此认为前列腺癌中HGF主要由间质细胞分泌,而后可能作用于癌细胞,发挥其生物学作用。我们在既往的研究中也发现NK4可以抑制HGF诱导的c-Met及其下游的ERK和Akt1/2蛋白的活化,从而调节肿瘤细胞的增殖、迁移和侵袭[11]。HGF/c-Met可以作为前列腺癌治疗的一个潜在的靶点。
总之,本实验证实前列腺癌患者HGF表达明显高于前列腺增生患者,且与前列腺癌临床分期和Gleason评分相关,HGF可能是前列腺癌诊疗的潜在的靶点。
[1]Matsumoto K,Nakamura T.NK4 gene therapy targeting HGF-Met and angiogenesis[J].FrontBiosci,2008,13:1943
[2]Han SU,Lee JH,Kim W H,etal.Significant correlation between serum level of hepatocyte growth factor and progression of gastric carcinoma[J].World JSurg,1999,23(11):1176
[3]UjiieH,TomidaM,Akiyama H,etal.Serum hepatocytegrowth factorand interleukin-6 areeffective prognosticmarkers for non-small cell lung cancer[J].Anticancer Res,2012,32(8):3251
[4]Ahmed H H,Metwally F M,Mahdy E S,etal.Clinical value of serum hepatocyte growth factor,B-cell lymphoma-2 and nitric ox ide in primarybreastcancer patients[J].EurRevMed PharmacolSci,2012,16(7):958
[5]Jung K H,Park BH,Hong SS.Progress in cancer therapy targeting c-Metsignalingpathway[J].Arch Pharm Res,2012,35(4):595
[6]Gupta A,Karakiewicz P I,Roehrborn CG,etal.Predictive value of plasmahepatocytegrowth factor/scatter factor levels in patientswith clinically localized prostate cancer[J].Clin Cancer Res,2008,14(22):7385
[7]Yasuda K,Nagakawa O,Akashi T,etal.Serum active hepatocyte growth factor(AHGF)in benign prostatic diseaseand prostate cancer[J].Prostate,2009,69(4):346
[8]Tsuka H,MoriM H,Li B,etal.Enhanced hepatocytegrowth factor levelin human prostate cancer treated with endocrine therapy[J].Int JOncol,1998,13(1):169
[9]Nakashiro K,Hara S,Shinohara Y,etal.Phenotypic switch from paracrine to autocrine role of hepatocyte growth factor in an androgen-independenthuman prostatic carcinoma cell line,CWR22R[J].Am JPathol,2004,165(2):533
[10]Nakashiro K,OkamotoM,HayashiY,etal.Hepatocytegrowth factor secreted by prostate-derived stromal cells stimulates growth of androgen-inde pendenthu manprostatic carcinomacells[J].Am JPathol,2000,157(3):795
[11]Yue D,Wang Y,Ma P,etal.Effects of transferred NK4 gene on proliferation,migration,invasion and apoptosis of human prostate cancer DU145 cells[J].Asian JAndrol,2010,12(3):381
