TOX和SMAD3基因多态性与中国汉族人群2型糖尿病患者微血管病变的易感性相关
2013-10-22蔡春友魏凤江林静娜韩鸿玲陈莉明李卫东
吕 佳,蔡春友,魏凤江,张 红,林静娜,韩鸿玲,陈莉明,李卫东
(1.天津医科大学基础医学研究中心,天津300070;2.天津医科大学眼科医院,天津300384;3.天津市人民医院,天津300121;4.天津医科大学总医院,天津300052;5.天津医科大学代谢病医院,天津300070)
糖尿病微血管病变(microvascular complications of diabetes,MVCD)主要包括糖尿病肾病(diabetic nephropathy,DN)和糖尿病视网膜病变(diabetic retinopathy,DR),是糖尿病最常见的并发症,其致死率和致盲率呈逐年上升的趋势。先前的研究证实,糖尿病病程的长短和血糖的控制情况是MVCD发病的危险因素[1-2],然而,有些患者MVCD的发生与血糖控制的程度并不相关[3]。另外有大量的研究表明MVCD在不同种族中患病率具有明显的差异,而且其家族聚集现象也很明显,这些都提示遗传因素在MVCD的发生发展中起重要作用[4]。本研究以1 090名久居于天津地区的中国汉族2型糖尿病患者为研究对象,选取MVCD候选基因的SNP位点进行基因分型,旨在探讨在中国汉族人群2型糖尿病患者中MVCD的遗传背景和风险基因。
1 资料与方法
1.1 研究对象 本研究共收集了1 090名天津地区的2型糖尿病患者,均为汉族,相互之间没有血缘关系,其中男性571人,女性519人,年龄在23~87岁之间,平均为(60.75±11.11)岁,患者均参照2010年美国糖尿病协会公布的糖尿病诊断标准确诊[5]。其中DN患者共615人(DN诊断标准为:有糖尿病史且微白蛋白/肌酐>300mg/g,除外原发肾小球病和其他继发肾小球疾病)。非DN糖尿病患者475人;非增殖性糖尿病视网膜病变患者(DR)共290人,增殖性糖尿病视网膜病变(PDR)患者共87人,非DR糖尿病患者713人;同时罹患DN和DR的糖尿病患者共157人;糖尿病病程超过10年,非DN非DR患者共165人。糖尿病视网膜病变患者均经眼底镜或眼底照相检查,经天津医科大学眼科医院两名专家确诊。调查和取样均征得受试者本人同意并签署了知情同意书。
1.2 方法
1.2.1 DNA提取 采用高盐法(原平皓公司试剂盒)用来提取外周血白细胞基因组DNA,应用Nanodrop 2000/2000c分光光度计测定样品浓度及其在230 nm、260 nm及280 nm波长处的光密度(OD)值,记录样品浓度(μg/μL)和纯度后置于-80℃保存备用。
1.2.2 候选基因及SNP的选择 此次研究的候选基因一部分来自于2007年对2型糖尿病全基因组关联研究(genome-wide association study,GWAS)的结果[6-7],以及先前本实验室对糖尿病、肥胖候选基因SNP位点基因分型(genotyping)的结果(李卫东等,待发表资料),另一部分来自于以往的相关报道和MVCD发生有关的生物学途径。依据SNP数据库(The Single Nucleotide Polymorphism Database,db-SNP)中每个基因SNP位点的连锁不平衡状态和中国汉族人群的等位基因频率,选择了与糖尿病微血管病变有关的14个基因的23个SNP位点,并对这些SNP位点进行基因分型(表1)。
1.2.3 基因分型 1 090例2型糖尿病患者基因分型由IlluminaSNP芯片技术平台进行。在进行基因分型时设重复对照,以便对基因分型结果进行监测和质量控制。基因分型的结果录入Filemaker Pro数据库中。
1.3 数据分析 数据分析应用PLINK软件对病例对照样品进行二分变量的关联分析,PLINK比较病例和对照组等位基因频率,进行Chi方检验。在对照组的选择上,我们采取两种方案:(1)采用某种疾病(DN,DR,PDR和MVCD)的所有非患病个体作为对照;(2)以2型糖尿病病程超过10年,非DN非DR者作为对照 (n=165)。因为此次进行基因分型的SNP位点较少,并且相同基因SNP位点间存在连锁不平衡,所以未对二分变量关联分析进行多重检验的调整。
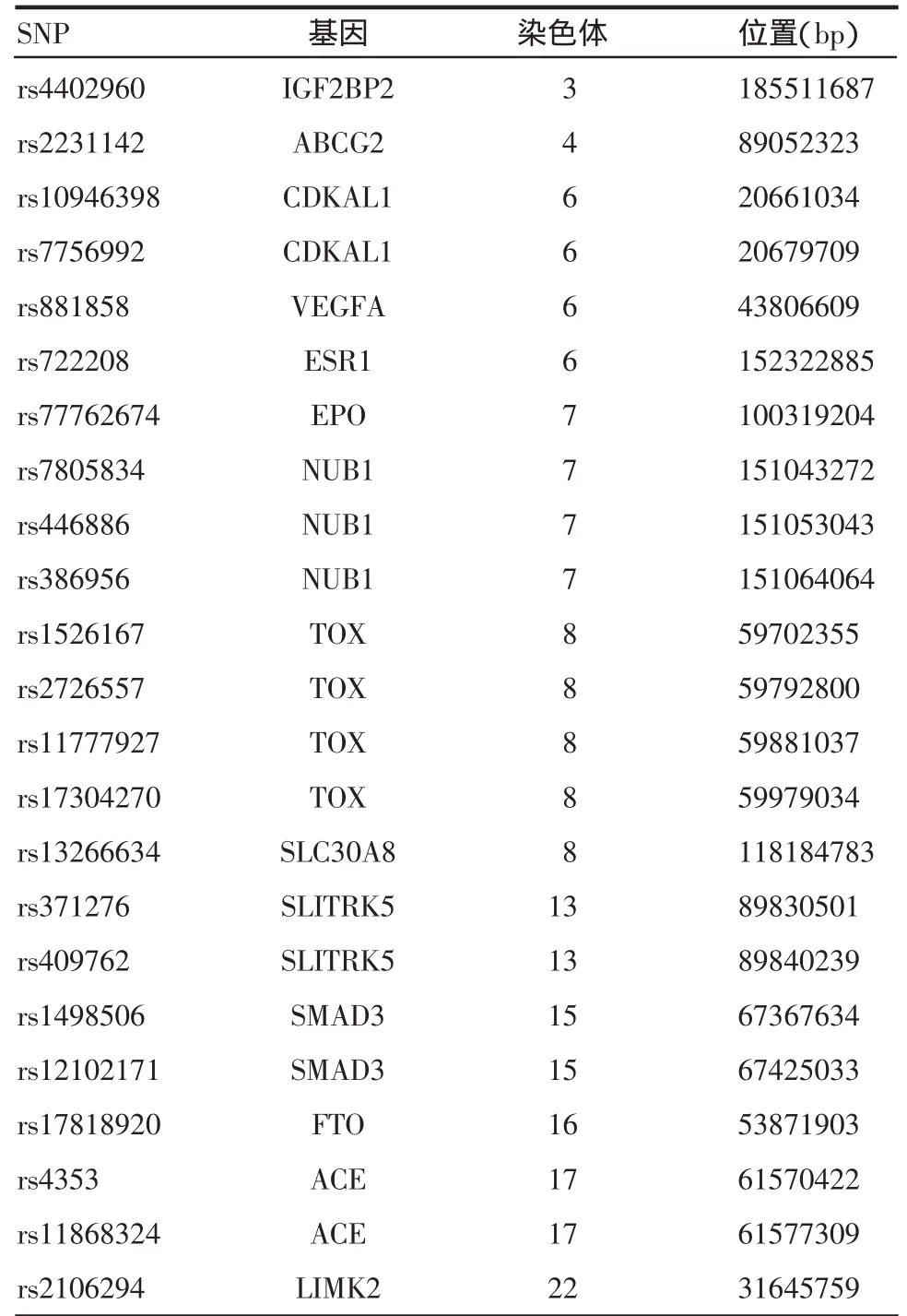
表1 糖尿病微血管病变候选基因SNP位点选择Tab1 SNP selection ofMVCD candidategenes
2 结果
在1 090例糖尿病患者中,针对DN、DR、PDR和MVCD,对候选基因SNP位点进行了病例-对照的二分变量关联分析,结果见表2、表3。
以病程大于10年,无DN无DR糖尿病患者为对照,得到的关联更加显著:发现TOX基因的rs1526167位 点 与 DN(P=0.002,OR=0.60)、DR(P=0.011,OR=0.635)、PDR(P=0.044,OR=0.587)和MVCD(P=0.001,OR=0.596) 均存在显著关联,SMAD3基因的 rs12102171位点与 DN(P=0.042,OR=1.453)、DR(P=0.010,OR=1.656)、PDR(P=0.017,OR=1.947)和 MVCD(P=0.024,OR=1.507)均存在显著关联。而另一些基因(IGF2BP2、CDKAL1、ESR1)SNP位点则与DN或PDR有关联(表2)。

表2 候选基因SNP位点与糖尿病微血管病变的关联分析(P值)Tab2 Association analyses for candidategene SNPs and diabeticm icrovascular complications(P values)

表3 TOX和SMAD3基因SNP位点与糖尿病微血管病变的关联分析Tab3 Associationsam ong TOX,SMAD3 gene SNPsand diabeticm icrovascu lar comp lications
3 讨论
MVCD是糖尿病最常见的并发症,是导致慢性肾功能不全和非外伤性致盲的主要原因,严重危害着糖尿病患者的健康。由于MVCD在不同人种中的患病率差异和明显的家族聚集现象,人们对基因在MVCD发病中的作用日益重视。目前已有许多关于MVCD易感基因的研究报道,这些基因可以分为7类,分别是 VEGF[8]、EPO[9]、ACE[10]、IL1RN、PON1[11]、SOD2[12]和HFE,这些基因及其作用与糖尿病相关基因并不完全相同,表明MVCD遗传性可能独立于糖尿病自身的遗传性。
此次研究采用大样本、多基因的研究方法,探讨MVCD在2型糖尿病患者中的易感基因,以揭示MVCD的遗传背景。本实验共收集了1 090名2型糖尿病患者,按照MVCD患病情况进行分组(DN、DR、PDR、MVCD),采用病例对照的方法进行二分变量的关联分析。以往的MVCD遗传学研究,均以健康人群为对照,忽略了血糖、病程等因素对实验的影响。因此本次研究对照组选取165名病程大于10年非DR非DN的糖尿病患者,尽量避免上述因素对实验造成的影响。从结果可以看出,如果以病程大于10年非DR非DN的糖尿病患者作为对照,尽管对照组人数较少(n=165),但SMAD3、TOX基因SNP位点与DN、DR、PDR、MVCD的关联更加显著,提示SMAD3、TOX基因是MVCD的易感基因,且MVCD的遗传背景与糖尿的遗传背景不同。应当指出,有些2型糖尿病患者虽未发现微血管病变,但其已具备发生MVCD的遗传学基础,只是病程较短尚未发病,以这部分人作为对照来寻找MVCD的易感基因显然值得商榷。我们采用病程>10年非DN非DR的T2D患者作为对照,可有效地检出与MVCD相关(而不是与T2D有关)的基因,诚然,本实验这部分对照的人数尚少,在一定程度上影响了检验效能(power)。
目前对MVCD发病机制的研究已经深入到了细胞因子信号转导通路的层面,其中TGF-β/Smad信号转导通路在MVCD发生和发展中的作用(特别是与器官纤维化的关系)已经得到了肯定[13]。SMAD3作为细胞膜受体和靶基因之间的关键桥梁,在TGF-β信号通路中发挥了核心作用,是TGF-β信号转导通路中不可或缺的重要介质[14]。SMAD3基因具有多个SNP位点,这次我们选取rs1498506和rs12102171两个位点。从本研究的PLINK结果中可以看出,SMAD3基因的 rs12102171与 DN、DR、PDR、MVCD均相关,与以往的研究结果相一致。
大量的研究表明,肥胖(尤其是内脏型肥胖)是产生胰岛素抵抗的重要因素,而胰岛素抵抗又是2型糖尿病发生的基础。在先前的研究中发现TOX基因与肥胖相关,这就提示我们TOX基因可能是MVCD的易感基因。TOX基因是位于人类第8号染色体上的蛋白质编码基因。在此次研究中发现,该基因的 rs1526167位点与 DN、DR、PDR、MVCD均有相关性。本研究为进一步了解和探讨MVCD的遗传背景提供了有意义的线索,但由于MVCD的发生发展是多种遗传因素和环境因素的共同作用所决定的,所以还需进一步进行更大样本量的、全基因组水平的研究。
[1]Freeman M S,Mansfield MW,Barrett JH,etal.Heritability of features of the insulin resistance syndrome in a community-based studyofhealthy families[J].DiabetMed,2002,19(12):944
[2]KhazaiM H,Zargaran Z,Moosavi Z,etal.Diabetic complications and risk factors in recently diagnosed type 2 diabetes[J].ARYA,2010,2(2):79
[3]Hietala K,Forsblom C,Summanen P,etal.Heritability ofproliferativediabetic retinopathy[J].Dlabetes,2008(8):2176
[4]Wong TY,Klein R,Islam FM,etal.Diabetic retinopathy in amul ti-ethnic cohortin theUnited States[J].Am JOphthalmol,2006,141(3):446
[5]American Diabetes Association.Standards ofmedical care in diabetes--2010[J].DiabetesCare,2010,33(Suppl1):11
[6]Frayling TM.A new era in findings type 2 diabetesgenes:theunusualsuspects[J].DiabetMed,2007,24(7):696
[7]Zeggini E.A new era for type 2 diabetes genetics[J].DiabetMed,2007,24(11):1181
[8]Fouad H,Hamid A A,Azeem AAA,etal.Vascular endothelial growth factor(VEGF)gene insertion/deletion polymorphism and diabetic retinopathy in patientswith Type 2 Diabetes[J].Am Sci,2011,7(3):199
[9]Tong Z,Aiello L P,Pollak M R,etal.Promoter polymorphism of the erythropoietin gene in severe diabetic eye and kidney complications[J].Proc NatlAcad SciUSA,2008,105(19):6998
[10]Patel H V,Kalia K,Mannari J.Angiotensin converting enzyme(ACE)gene polymorphism increases the susceptibility of diabetic nephropathy in Western Indian Type 2 diabetic patients[J].Diabet Med,2011,31(4):223
[11]Kao Y,Donaghue K C,Chan A,etal.Gene cluster is a genetic marker for earlymicrovascular complications in type 1 diabetes[J].DiabetMed,2002,19(3):212
[12]Nomiyama T,Tanaka Y,Piao L.The polymorphism of manganese superoxide dismutase is associated with diabetic nephropathy in Japanese type2 diabetic patients[J].Hum Genet,2003,48(3):138
[13]Nakamura S,IwasakiN,Funatsu H,etal.Impactof variants in the VEGF gene on progression of proliferative diabetic retinopathy[J].Graefes Arch Clin Exp Ophthalmol,2009,247(1):21
[14]Roberts A B,Russo A,FeliciA,etal.Smad 3 a key player in patho genesismechanisms dependent on TGF-beta[J].Ann N Y Acad Sci,2003,995:1
