鸭坦布苏病毒病的流行特点及诊断技术
2013-10-19黄建
,,, , ,黄建,
(余姚市禽畜病防治研究所, 浙江余姚 315400)
2010年以来,我国部分省市的蛋鸭群突然出现了一种新的产蛋下降病,大量研究表明该病由黄病毒科黄病毒属的一种新病毒引起[1-3],由于该病毒的核苷酸序列与黄病毒属恩他耶病毒群的蚊媒坦布苏病毒印尼株和泰国株的同源性达87%~91%[2],因此将其命名为鸭坦布苏病毒。由于该病是近年来新发的一种传染病,本文将鸭坦布苏病毒病的流行特点及诊断要点简要介绍如下,供参考。
1 流行特点
1.1传播速度快 笔者在临床诊断过程中发现鸭坦布苏病毒在1~2 d内能感染鸭场的所有鸭子,一般1周左右即可感染一个养殖小区或聚养区的所有鸭群。一户养鸭一旦发病,随后以点为中心,快速向周边区域扩散,数天内即可传播周边区域,特别是鸭棚密集区传播更迅速,发病更严重。
1.2发病率高,死亡率较低 鸭场一旦发生该病,即可引起鸭群中的所有个体感染发病;发病率几近100%,但死亡率较低,产蛋鸭通常低于15%,多数在5%以下[4];发病率和死亡率多与发病季节和养殖场的管理和继发感染有关;部分养殖场的青年鸭和雏鸭发病后,死亡率可达20%左右。
1.3鸭为主要宿主 该病主要危害各种蛋鸭、肉用种鸭(樱桃谷鸭、北京鸭等)和野鸭种鸭,也有少量20~30日龄幼鸭、种鹅和蛋鸡发病的报道[1,5,6]。
2 临床诊断要点
2.1采食量突然下降 该病发病后,2~3 d内鸭群采食量可突然降至原来的20%~30%,部分患鸭停食,一般需2周左右采食量才能逐渐恢复[7]。
2.2产蛋率急剧下降 伴随着采食量的骤降,1周内产蛋率可从高峰期的90%~95%下降到5%~10%,甚至停止产蛋。一般在发病后20~30 d产蛋量开始恢复,大部分蛋鸭产蛋率可恢复到原来的90%左右[7,8]。
2.3病鸭体温升高 患鸭排绿色稀粪,体温升高,后期部分发病鸭可能出现脑炎样神经症状,表现为行走、站立不稳,头颈抽搐,倒地不起,个别患鸭瘫痪、共济失调。肉鸭发病以神经症状为主。
2.4种蛋受精率下降 患鸭发病期间种蛋受精率下降,病程1个月左右即可自行恢复,恢复程度与鸭群状态、日龄相关,但不能达到产蛋高峰[8]。
3 病理诊断要点
病变特点之一 卵巢病变,表现为卵泡膜严重充血、出血,卵泡变形、液化、坏死,卵巢萎缩等(图1 A、B),后期卵泡破裂,出现卵黄性腹膜炎。
病变特点之二 肝脏肿大,表面有出血点或出血块(图1 C、D)。
病变特点之三 脾脏斑驳呈大理石状,部分极度肿大出血并破裂(图1 E、F);胰腺有出血和坏死,心肌外观苍白,有白色条纹状坏死,内膜出血。
4 实验室诊断
鸭坦布苏病毒的实验室诊断主要有病毒分离、RT-PCR检测、ELISA检测等。
4.1病毒分离培养 这是检测病鸭组织中鸭坦布苏病毒最为准确的一种病原学诊断方法。采集病死鸭的出血卵泡膜和卵巢病料,按常规匀浆后反复冻融3次,经尿囊腔无菌接种9日龄SPF鸡胚或10日龄鸭胚,接胚后4 d左右胚胎死亡,部分需连续传代3代以上胚胎才出现死亡。死胚胚胎充血、出血,肝脏出血,肾脏有尿酸盐沉积,尿囊液粘稠,并含有大量尿酸盐[9]。
对分离病毒进行血凝试验,鸭坦布苏病毒无血凝活性;流感病毒、鸭副粘病毒、EDS则均有血凝活性。对分离病毒还可采用RT-PCR、血清中和试验、免疫荧光等技术进行鉴定。
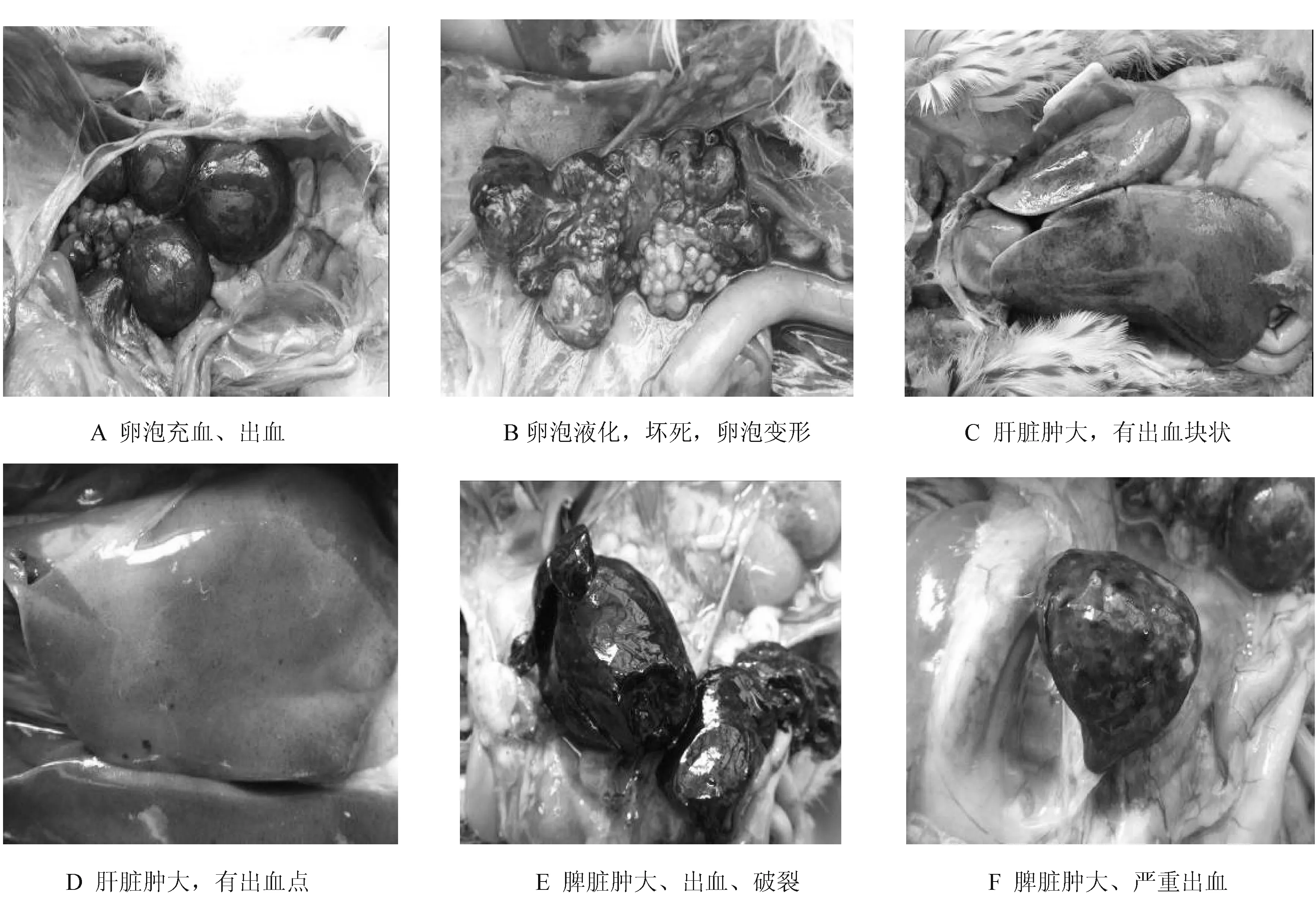
图1 鸭坦布苏病毒感染引起的卵巢、肝脏、脾脏病变
4.2RT-PCR技术 聚合酶链式反应(PCR)是一种体外基因扩增技术,该技术具有高度敏感性和特异性,为鸭坦布苏病毒的快速诊断提供了敏感、快速、直观的检测方法,是目前最为实用的一种检测方法。实验室诊断可根据鸭坦布苏病毒E基因设计的一对引物,目的片段大小为450 bp,应用该法可对临床病例进行检测,发现该法具有很好的特异性和敏感性。
Yan L等(2011)[10]针对鸭坦布苏病毒Fengxian株E基因序列设计引物与TaqMan荧光探针,建立了鸭坦布苏病毒的一种快速,准确和定量的TaqMan荧光探针实时定量PCR检测方法,该法比常规PCR的灵敏度高100倍。Yun T(2012)[11]针对3 端非编码区设计的MGB探针,建立了单步实时RT-PCR检测方法,该法能检测出20拷贝/μL的核酸,且与其他病原无交叉反应,检测只需2 h左右,该法具有快速、敏感、特异的特点。
4.3酶联免疫吸附试验(ELISA)诊断技术 采用鸭坦布苏病毒的全病毒和E基因原核表达蛋白作为包被抗原,建立检测鸭坦布苏病毒血清抗体的间接 ELISA 检测方法。
笔者采用该法对宁波地区的多个发病鸭场发病后15~60 d的患鸭进行检测,发现发病后15 d开始各鸭场患鸭的血清阳性率均达100%。经大量临床检测应用表明该法具有较好的特异性、敏感性和稳定性。
5 鉴别诊断
5.1鸭流感的鉴别 鸭流感是由正粘病毒科的A型流感病毒引起的一种急性传染病。该病可引起不同品种、不同日龄鸭群感染发病,但不同毒株的致病力差异较大,有的毒株自然感染时发病率和死亡率高达100%。患鸭主要表现为食欲减退或废绝,喜饮水,排白色或带淡黄色水样稀粪。患鸭精神沉郁,不能站立,迅速脱水、消瘦,发病后2~3 d鸭群大批死亡,蛋鸭产蛋率大幅下降。急性死亡患鸭全身皮肤充血、出血,腹部皮下脂肪有散在性出血点。肝脏肿大,呈淡黄色,有出血斑,脾脏肿大、出血,表面有灰白色坏死点。胰充血、出血,且有点状坏死、液化,心冠脂肪出血等特征性病变。
对鸭流感病毒分离后进行血凝试验和血凝抑制试验,有血凝活性,可被阳性血清抑制,据此可作出初步鉴别诊断,采用禽流感通用引物对分离病毒进行RT-PCR扩增[12],可确诊鸭流感。
5.2鸭产蛋下降综合征的鉴别 鸭产蛋下降综合征是由鸭腺病毒感染引起的一种疾病,该病主要引起蛋(种)鸭发病,一般病鸭无明显症状,采食量稍有减少,主要表现为产蛋下降,蛋鸭产蛋率可降至产蛋高峰期的50%左右,期间软壳蛋、薄壳蛋和畸形蛋大量增加,一般不引起患鸭死亡。病鸭主要病变在卵巢,表现为卵泡充血、出血、萎缩、坏死,其他组织脏器则无明显病变。
对鸭腺病毒的鉴别诊断可采集病鸭血清进行血凝抑制试验或采集病料进行病毒分离试验,发病鸭血清抗体效价很高,分离的鸭腺病毒有血凝活性;鸭坦布苏病毒则无血凝活性,据此可作出鉴别诊断,也可直接提取发病鸭病变卵巢或分离病毒的DNA,用产蛋下降综合征引物进行PCR扩增,鉴定出鸭腺病毒。
5.3禽霍乱的鉴别 禽霍乱是由禽多杀性巴氏杆菌引起的一种细菌性传染疾病,多发于青年鸭及成年鸭,发病率较低,但死亡率较高。患鸭多呈心肌出血,肝脏肿大,表面散布灰白色、针尖大小的坏死点等特征性病变,为禽霍乱与其他疾病的主要鉴别要点。
实验室诊断,可采集患鸭肝脏涂片,进行瑞氏染色,镜检可见两极着色的蓝色杆菌,对患鸭用敏感抗生素治疗有较好疗效。
5.4鸭卵黄性腹膜炎的鉴别 鸭卵黄性腹膜炎是由大肠杆菌引起的一种细菌性疾病,是产蛋鸭群特别是高产期蛋鸭的一种常见多发性疾病。该病发病率较低,病鸭临床表现为排绿色稀粪,严重者脚软不能站立而伏卧于地面,驱动时能勉强爬动,常废食死亡。
主要病变为腹膜增厚,有大量黄白色渗出物附着于腹膜,卵泡充血、出血,绝大部分病例输卵管中有大小不一、像煮熟样的蛋白团块滞留,部分卵泡破裂充满整个腹腔。卵黄性腹膜炎引起的产蛋率较低,用敏感的抗菌药物治疗有较好的疗效。
鸭坦布苏病毒病是我国近年来出现的一种新发鸭病,目前通过临床症状、剖检病变和实验室诊断能基本确诊该病,基层兽医工作者在家禽门诊诊断时,应注意与鸭流感、产蛋下降综合征等进行鉴别诊断,以有效制定合理的防控方案。
目前对该病尚无有效的防治措施。对发病鸭主要通过加强饲养管理,减少应激,合理应用抗生素防止继发感染,鸭群可在发病后20~30 d左右自行恢复产蛋,产蛋率可恢复到原来的90%左右。
[1] 曹贞贞,张存,黄瑜,等.鸭出血性卵巢炎的初步研究[J].中国兽医杂志,2010,46(12):3-6.
[2] Su Jing-liang,Li Shuang,Hu Xu-dong,et al.Duck egg-drop syndrome caused by BYD virus,a new tembusu-related flavivirus [J].PLoS ONE,2011,6(3):el8106.
[3] Yan Pi-xi,Zhao You-shu,Zhang Xu,et al.An infectious disease of ducks caused by a newly emerged Tembusu virus strain in mainland China[J].Virology,201l,417(1):1-8.
[4] 万春和,施少华,黄瑜等.一种引起种(蛋)鸭产蛋骤降新病毒的分离与初步鉴定[J].福建农业学报,2010,25(6):663-666.
[5] 黄欣梅,李银,赵冬敏等.新型鹅黄病毒JS804毒株的分离与鉴定[J].江苏农业学报,2011,27( 2):354-360.
[6] 陈仕龙,陈少莺,王劭等.一种引起蛋鸡产蛋下降的新型黄病毒的分离与初步鉴定[J].福建农业学报,2011,26(2):170-174.
[7] 苏敬良.鸭的新型黄病毒BYD引起的产蛋下降综合征[J].兽医导刊,2011,4,27-29.
[8] 李玉峰,马秀丽,于可响等.一种从鸭新分离的黄病毒研究初报[J].畜牧兽医学报,2011,42(6):885-891.
[9] 廖敏,牟小东,耿阳等.鸭传染性产蛋减少症 (暂定名)的病原分离初报[J].中国动物传染病学报,2011,19(1):22-26.
[10] Yan L, Yan P, Zhou J, et al. Establishing a TaqMan-Based Real-Time PCR Assay for the rapid detection and quantification of the newly emerged duck tembusu virus[J]. Virology Journal, 2011, 8: 464.
[11] Yun T, Ni Z, Hua J, et al. Development of a one-step real-time RT-PCR assay using a minor groove-binding probe for the detection of duck Tembusu virus[J].Virol Methods, 2012 , 5; 181(2):148-154.
[12] NYT 772-2004[S]. 国家农业行业标准“禽流感病毒RT-PCR试验方法”.
