650例慢性乙肝患者HBV-M、HBV-DNA同步检测分析
2013-10-17姜伟超
姜伟超
华中科技大学同济医学院附属协和医院检验科,湖北 武汉 430023
乙肝是乙型病毒性肝炎的简称,是由乙型肝炎病毒(HBV)引起以肝脏炎性病变为主的、可引发多种器官损害的一种传染性疾病。发病区域多集中在一些亚洲国家[1]。目前中国乙型肝炎病毒感染率较高,可达10%左右,部分经济较为落后的地区感染率可高达10%~20%。检测和防治乙型肝炎仍是急需解决的问题[2]。乙肝两对半又称乙肝5项,为国内常用的乙肝病毒(HBV)感染的检测血清标志物,包括:HBsAg(乙肝病毒表面抗原)和HBsAb(乙肝病毒表面抗体)、HBeAg(乙肝病毒 e抗原)和HBeAb(乙肝病毒e抗体)、和HBcAb(乙肝病毒核心抗体),可检测患者是否感染乙肝及感染的具体情况[3]。HBV DNA是反应HBV复制直接、最可靠的指标,在评价治疗乙型肝炎药物的疗效与预后判定方面,HBV DNA的检测具有重要的作用[4]。联合两者检测,可能提高诊断准确率,有助于慢性乙肝患者病程的综合管理。关于两者同步检测,且两对半采用CMIA方法的报道并不多见,既往报道中也未见特别对慢性乙肝患者这一人群进行针对性研究。本研究回顾性分析了2011年5月-2012年5月我院收治的650例慢性乙肝患者同时进行的HBV血清学检测(采用CMIA方法,化学发光微粒免疫测定)和DNA检测(采用PCR方法,聚合酶链反应)的结果,期望能为相关临床实践和科学研究提供依据。
1 材料与方法
1.1 标本 将患者静脉血样离心,分离出血清待测。
1.2 仪器和试剂 微量荧光检测仪(FX990)和配套乙肝DNA试剂盒,上海复星实业股份有限公司生产。Architecti2000分析仪和原装乙肝定量检测试剂盒,美国雅培生产。
1.3 方法 同时进行HBV-M和HBV-DNA检测。FX990采用PCR法,设置阴性和3个定量阳性对照(分别为 4.2 ×106copy/mL、4.2 ×105copy/mL、4.2 ×104copy/mL)。ARCHITECT i2000分析仪采用CMIA原理,可定量检测HBsAg和HBsAb,定性检测HBeAg、HBeAb和HBcAb。HBsAg和HBsAb的阳性阈值分别为90.05和≥10 IU/L,其检测上限分别为250和1000 IU/L,以样品相对光单位(RLU)与RLU阈值的比值(s/co)解释HBeAg、HBeAb和HBcAb的定性结果。
2 结果
慢性乙肝血清学标志物常见模式8种,占总体的98.5%;罕见模式3种,合计占总体的1.5%。所有血清学模式对应的PCR阳性率为0~100%不等,以HB-sAg、HBeAg和HBsAg 2种模式对应的阳性率为最高,均为100%。阳性PCR患者中,DNA拷贝数最高的2种血清学模式为 HBsAg、HBeAb、HBcAb(7.36 × 107,cope/mL)和 HBsAg、HBeAg(5.49 × 107,cope/mL)(见表1)。HBeAg与DNA复制情况联系最为紧密,2种检测一致率超过81.4%(见表2)。

表1 650例慢性乙肝患者HBV血清学和DNA检测结果Tab1 Serology detection results of HBV and DNA in 650 cases of patients with chronic hepatitis B
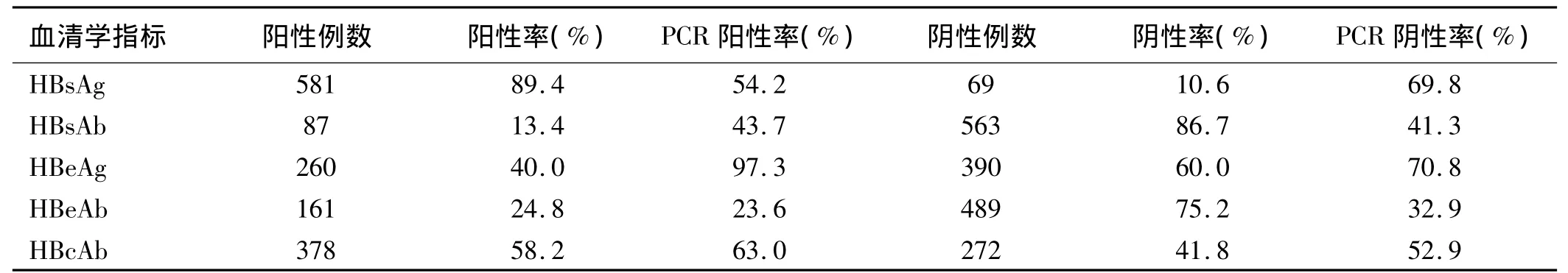
表2 650例慢性乙肝患者HBV血清学和DNA检测结果Tab2 Serology detection results of HBV and DNA in 650 cases of patients with chronic hepatiti B
3 讨论
免疫学检验已从手工检测部分进入了自动化微量分析时代。ARCHITECT i2000全自动免疫分析仪以CMIA技术为基本原理,可进行自动、随机、连续和优先运行模式等操作,大大改善了工作环境和效率。于肝炎测定而言,ARCHITECT i2000化学发光免疫分析仪通过化学发光技术能够达到对HBV部分标志物进行定量检测,顺应临床免疫检验量化的发展方向。根据邹麟等[5]研究评价,该检测系统各项性能达到仪器说明书规定,满足设计要求和临床需要。而根据罗维民[6]研究,罗氏E170和雅培i2000检测一致率较高,达97.3%。因此,选用ARCHITECT i2000全自动免疫分析仪检测乙肝血清学标志物是目前灵敏度、准确性和普适性较高的方式。
血清学检测包括了目前常用的5个指标,即HB-sAg、HBsAb、HBeAg、HBeAb 和 HBcAb。其中,HBsAg为病毒外膜蛋白的重要组成成分,为HBV感染的最主要的血清学检测指标,在患者感染早期就会出现在血液中,并会持续数月或终生,是判断患者是否感染乙肝病毒最常用的依据[7-8]。根据本次研究结果,其阳性率相对其他标志物是最高的(89.4%)。HBsAb由HBsAg诱导产生,为保护性抗体。若是乙肝患者检测为阴性,往往说明体内还含有乙肝病毒[9]。本研究显示入组人群HBsAb阴性率为86.7%,为所有指标中阴性率最高的,并且其中有近60%的患者PCR结果为阳性,提示活跃的病毒复制。HBeAg是乙型肝炎病毒核心颗粒中的一种可溶性蛋白质,阳性表明乙型肝炎病毒处于活动期,并有较强的传染性;持续阳性,表明肝细胞损害较重,并有可能转为慢性乙型肝炎或肝硬化。一般情况下,HBsAg与HBsAb,HBeAg与HBeAb同时阳性少见。本次研究共检测出8种常见模式和3种罕见模式,占总体比例分别为98.5%和1.5%。有文献报道乙肝标志物一共有32个模式,周丽敏[10]研究发现24个模式。本次研究与两者相比还有一定差距,分析主要是由于研究设计为回顾性分析,要求患者当时是同步进行了HBV-M和HBV-DNA的检测,最终入组患者为650例,样本量较少,且为本医院单点研究,入组患者与总体患者存在偏倚,另外,疾病状态、免疫水平差异以及检测手段创新等均可能是其影响因素。
本次研究考查了血清学标志物和DNA检测在CMIA和PCR方法下的一致性。历史多采用ELISA方法进行血清标志物阴阳性的定性判别,笔者根据实践,认为CMIA方法对肝炎检测的首要贡献是进一步提高了检测灵敏度,尤其是有助于对一些病毒变异株和亚型的识别,在明确患者病情方面具有重要作用。由于HBsAg定量目前在临床指导药物治疗方面检测结果的线性变化并非特别明确,而HBsAb主要用于指导乙肝预防工作的开展,其他3项尚不能进行完全定量,为了保障研究的方便性,故本研究仍然通过CMIA定性关联DNA的定性结果和定量结果。表1中显示所有血清学模式对应的PCR阳性率为0~100%不等,以HBsAg、HBeAg和HBsAg 2种模式对应的阳性率最高,均为100%。阳性PCR患者中,DNA拷贝数最高的2种血清学模式为 HBsAg、HBeAb、HBcAb(7.36 ×107,cope/mL)和 HBsAg、HBeAg(5.49 × 107,cope/mL)。经过表2进一步分析,发现HBsAg、HBcAb和HBeAg的阳性率和阳性患者的PCR阳性率均为最高,且在3者中,HBeAg检测与DNA检测一致率又最高,超过80%。提示HBeAg与DNA复制可能存在较大关联,是指导临床用药实践的可靠指标,这与乙肝治疗指南中对该指标的利用情况保持一致。同时不同指标、模式与PCR结果又存在差异,提示患者肝脏免疫状态与血液中病毒DNA复制情况并不平行。尤其是在HB-sAg、HBcAb模式下,DNA复制表现为静止;而在大三阳模式下,DNA复制却并非为最高水平。
综上,DNA阴性并不完全代表体内病毒已被清除,联合HBV-M和HBV-DNA测定可以直接反映血液中病毒复制状态以及间接反映病毒复制静息期肝细胞内病毒状态,适用于乙肝患者的慢性病程管理。此外,CMIA具有灵敏度高,对突变株的检测能力强等优点,可检出人群中的特殊模式,应尽量开展,以提高诊断准确率。鉴于特殊模式本身发生率不高,应该通过前瞻性动态观察,有效识别应用CMIA同时可能带来的假阳性问题。
[1]Jiang YQ.Analysis and evaluation of enzyme-linked immune response acceleration instrument detecting hepatitis B three[J].Jiangxi J Med Lab Sci,2007,25(2):147-148.蒋永清.应用酶联免疫反应加速仪检测乙肝三对的结果分析与评价[J].江西医学检验,2007,25(2):147-148.
[2]Wang Y.Investigation of clinical two level evaluation scheme of Hepatitis B five EIA kits[J].Nei Mongol Journal of Traditional Chinese Medicine,2010,32(13):128-129.王勇.关于乙肝五项酶免试剂临床二级评价方案的探讨[J].内蒙古中医药,2010,32(13):128-129.
[3]Gu ZD,Wu QW,Feng XJ,et al.An improved me thod for home made one step HBsAg ELISA reagents and its conf irmatory test reagents[J].Laboratory Medicine,2011,26(1):32-35.顾志冬,吴倩文,冯晓静,等.用于国产一步法HBsAgELISA试剂及确认试验试剂的改进方法[J].检验医学,2011,26(1):32-35.
[4]Liu B,Hu R,Yang LY,et al.Analysis and clinical significance of Hepatitis B virus DNA quantitative[J].Chinese Journal of Medicinal Guide,2012,14(4):673-674.刘兵,胡蓉,杨联云,等.乙型肝炎病毒DNA定量分析的临床意义[J].中国医药导刊,2012,14(4):673-674.
[5]Zou L,Zhang LP,Xia JR.Efficiency evaluation of detecting HBV serum markers by ARCHITECT i2000 Chemoluminescence Analyzer[J].Chongqing Medicine,2010,39(24):3353-3354.邹麟,张莉萍,夏吉荣.全自动免疫分析仪ARCHITECT i2000检测HBV血清标志物性能评价[J].重庆医学,2010,39(24):3353-3354.
[6]Luo WM.Abbott Architect i2000,Roche E170 module analysis comparison of serum hepatitis B virus markers[J].China Foreign Medical Treatment,2010,29(8):163-164.罗维民.雅培Architect i2000,罗氏E170模块分析对血清乙型肝炎病毒标志物检测的比较[J].中外研究,2010,29(8):163-164.
[7]Zhao LQ.Clinical application of ELISA in the detection of hepatitis B markers[J].China Medical Herald,2012,9(3):89-90.赵辽群.ELISA法检测乙肝标志物的临床应用[J].中国医药导报,2012,9(3):89-90.
[8]Si DQ.Enzyme immunoassay for hepatitis B surface antigen diagnostic reagents used for the quantitative discussion [J].J Mod Lab Med,2002,17(2):38.司端勤.酶免疫检测乙肝表面抗原诊断试剂用做定量的探讨[J].现代检验医学杂,2002,17(2):38.
[9]Sun LH.Analysis of 86 cases of hepatitis B test results[J].Guide of China Medicine,2012,10(13):166-167.孙利红.86例乙肝三对检测结果分析[J].中国医药指南,2012,10(13):166-167.
[10]Zhou LM.Summary and analysis of the markers in 2431 cases of hepatitis B virus detection mode[J].Journal of Clinical and Experimental Medicine,2012,11(1):65,67.周丽敏.乙肝病毒标志物2431例检测模式汇总及分析[J].临床和实验医学杂志,2012,11(1):65,67.
