细胞外信号调节激酶-2在结肠癌中的表达及临床意义
2013-10-17赵光忠侯利涛李增军
王 斌 夏 博 赵光忠 侯利涛 李增军
1.山东省临朐县人民医院普外科,山东临朐 262600;2.山东省肿瘤医院外四科,山东济南 250117
结肠癌是世界上最常见的恶性肿瘤之一,仅2000年全球即有945 000例新发病例,仅次于肺癌、乳腺癌,居恶性肿瘤发病率的第3位[1]。结肠癌病因不明,预后较差,5年存活率不超过40%。目前结肠癌的病因尚不清楚,早期诊断成为改善患者预后的关键[2-3]。在结肠癌的生物学行为中,侵袭和转移是影响结肠癌患者疗效和预后的重要因素。寻找有关控制侵袭、防止浸润的因素是目前结肠癌防治研究的重要课题之一。因此,本研究应用免疫组织化学方法,研究细胞外信号调节激酶(ERK)在结肠癌与癌旁组织中的表达情况,分析ERK蛋白与结肠癌病理因素的关系,探讨ERK在结肠癌发生中的作用。
1 资料与方法
1.1 一般资料
收集山东省临朐县人民医院2008年1月~2010年12月经手术病理证实的结肠癌79例患者的结肠癌组织及癌旁组织标本,所有患者的年龄、性别、肿瘤部位、组织学类型、肿瘤直径、浸润深度、淋巴结或远处转移情况、Dukes分期等病理资料完整、可查。在79例结肠癌患者中,男41例,女38例;<60岁者40例,≥60岁者39例;结肠癌位于右半结肠35例,位于左半结肠49例;肿瘤直径<5 cm者36例,≥5 cm者43例;Dukes A期14例,B期31例,C期22例,D期12例;高中分化腺癌58例,低分化腺癌21例;无淋巴结转移45例,有淋巴结转移34例;浸润深度:未穿透肌层者13例,浸润至浆膜或浆膜外者66例;癌胚抗原(CEA)水平<5 μg/L 者 22 例,≥5 μg/L 者 57 例。 另选择同期行结肠切除的79例非肿瘤患者组织标本作为正常组织对照,其中,溃疡性结肠炎39例,肠结核11例,外伤29例。本研究经医院伦理委员会通过,患者知情同意,并签署知情同意书。
1.2 ERK-2蛋白表达检测方法
采用免疫组化链霉菌抗生物素蛋白-过氧化酶(streptavidin-peroxidase,SP)法检测 ERK-2 蛋白表达情况。对石蜡切片常规脱蜡脱水处理,放置于3%过氧化氢(H2O2)溶液中,室温孵育约 30 min,给予磷酸盐缓冲液(PBS)洗涤5 min×2遍,滴加正常山羊血清封片40 min,而后滴加1∶30稀释的ERK-2抗体,置于4℃条件下孵育过夜;第2天取出切片,PBS冲洗,依次滴加生物素标记羊抗鼠二抗及链霉卵白素,37℃条件孵育30 min;采用二氨基联苯胺(DAB)显色,复染采用苏木精,乙醇脱水、二甲苯透明化,最后采用中性树胶封片保存。采用HPLAS-1000彩色病理图像免疫组化测量系统7.0版对图像进行分析,判断ERK-2表达情况。
1.3 结果判定
ERK-2蛋白免疫组化阳性表达于细胞质和(或)细胞核,呈黄色或棕黄色颗粒。每张切片在光镜下随机选取5个高倍视野,每个视野计数100个瘤细胞,根据阳性细胞总数计算阳性细胞百分率。按着色强度不同分别给予计分:无色为0分,浅黄色或黄色为1分,棕黄色为2分。阳性细胞数评分分别为:<10%为0分,10%~50%为1分,>50%为2 分。 两项合计乘积 0 分为阴性(-),1~2 分为弱阳性(+),4分为强阳性(++)。
1.4 统计学方法
采用统计软件SPSS 15.0对数据进行分析,正态分布的计量资料以均数±标准差(±s)表示,两独立样本的计量资料采用t检验;计数资料以率表示,采用χ2检验;生存率分析采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 正常结肠组织、癌旁组织和结肠癌组织中ERK-2蛋白阳性表达率比较
结肠癌组织中ERK-2蛋白阳性表达率[75.9%(60/79)]高于癌旁组织[51.9%(41/79)]及正常组织[13.9%(11/79)],差异均有统计学意义(P < 0.05或 P < 0.01)。见表1、图1、2。

表1 细胞外信号调节激酶-2蛋白在结肠癌组织、癌旁组织及正常组织中阳性表达分布[n(%)]

2.2 ERK-2蛋白表达与结肠癌临床病理特征的关系
ERK-2蛋白阳性表达率在不同年龄(<60岁、≥60岁)[77.5%(31/40)、74.4%(29/39)]、性别(男/女)[70.7%(29/41)、68.4%(26/38)]、Dukes分期(A、B、C、D 期)[73.3%(11/15)、76.7%(23/30)、71.4%(10/14)、70.0%(14/20)]、CEA 水 平(<5 μg/L、≥5 μg/L)[68.2%(15/22)、64.9%(37/57)]患者间比较,差异均无统计学意义(P>0.05);ERK-2蛋白阳性表达率在不同分化程度(高中分化/低分化)[82.8%(48/58)、57.1%(12/21)]、 浸润深度(未穿透肌层/浆膜或浆膜外)[46.2%(6/13)、72.7%(48/66)]和淋巴结转移(阳性/阴性)[76.5%(26/34)、53.3%(24/45)]患者间比较,差异有统计学意义(P<0.05)。 见表2。
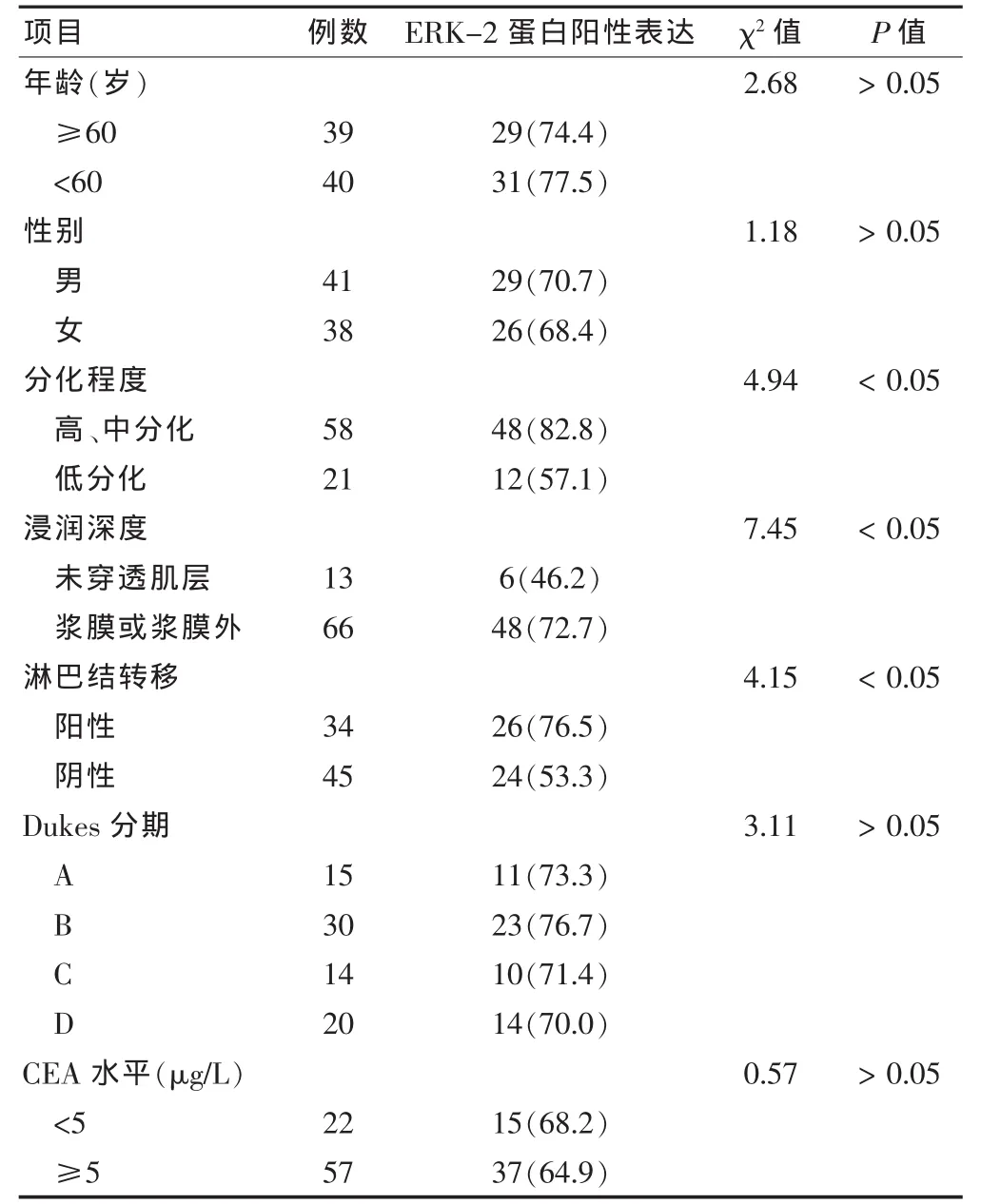
表2 细胞外信号调节激酶-2蛋白阳性表达与结肠癌临床病理特征的关系[n(%)]
2.3 细胞外信号调节激酶-2蛋白阳性表达与预后的关系
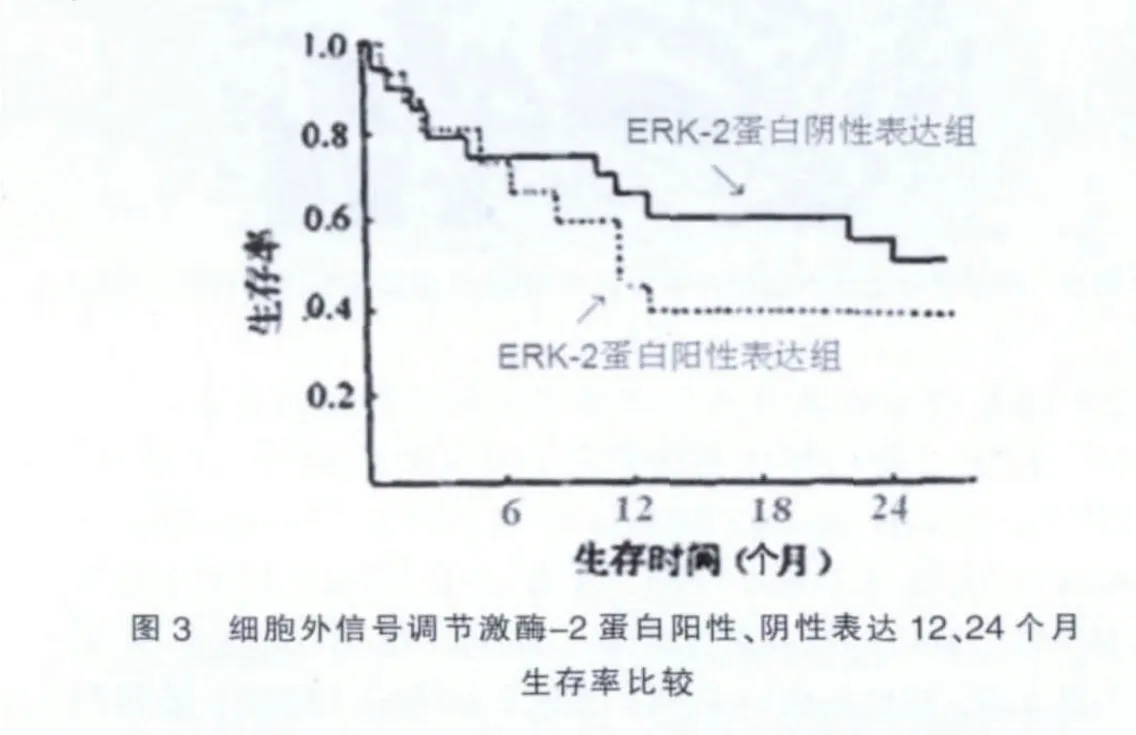
ERK-2蛋白阳性表达患者12个月生存率为58.2%,ERK-2蛋白阴性表达患者12个月生存率为60.4%,两者比较差异无统计学意义(P>0.05);ERK-2蛋白阳性表达患者24个月生存率为38.7%,低于ERK-2蛋白阴性表达患者24个月生存率(58.6%),差异有统计学意义(P<0.05)。见图3。
3 讨论
通常来讲,欧美发达国家结肠癌的发病率较高,我国发病率目前虽仍低于发达国家,但随着我国现代化程度和居民生活水平的不断提高,饮食结构发生较大变化,结肠癌发病率亦随之增加[4]。目前的研究已经证实,恶性肿瘤的发生与发展是在多种因素参与并作用下,经过多阶段演进最终形成的复杂生物学现象。恶性肿瘤细胞最明显的特征就是增殖的失控性,而与生长、分化有关的细胞信号转导失调或障碍则是增殖失控的关键因素。其中丝裂原活化蛋白激酶(MAPK)级联反应是已发现并明确细胞信号转导途径之一。在哺乳动物细胞,MAPK转导途径的胞外信号已经明确了4条通路:ERK通路、JNK通路、p38通路和ERK-5通路。已证实这些通路的关键调节酶在生长因子类蛋白信号刺激引起的细胞反应中起着重要的调控作用。经典的MAPK信号转导途径信号蛋白包括:酪氨酸激酶受体和配体蛋白→Ras→Raf→MEK→ERK-1/ERK-2→转录因子→细胞增殖、分化等相关基因表达。这条途径参与了包括细胞增殖、分化、分泌及运动等多种生命活动形式的调节[5],且在细胞恶性转化和肿瘤浸润转移过程中起着重要作用[6]。MAPK/ERK信号转导通路在生长因子介导的细胞增殖、分化过程中发挥着重要作用,ERK通路的上、下游调节元件,如位于上游的 c-src、Ras、Raf、v-mos,下游的 c-jun、c-fos、c-myc、c-myb 等均被证明是病毒癌基因,这就提示ERK通路具有恶性转化细胞的功能。Kawada等[7]研究发现,血管内皮生长因子(VEGF)水平在ERK-2激活后可显著提高,通过调节结肠癌组织中微血管的生成促进结肠癌组织的生成和发展。Karna等[8]发现ERK传导通路过度激活可增加成纤维细胞恶性转化后在裸鼠体内的成瘤及转移性。Massa等[9]发现成纤维细胞中尿激酶的蛋白水解活性可被ERK激活并诱导。Miyata等[10]发现cos细胞和FG细胞(一种来源于胰腺癌的细胞系)穿过基底膜发生迁移的过程与ERK激活有关。Wang等[11]发现,乳腺癌细胞 MDA-MB-231 中 ERK-2 的活性被MEK的抑制剂PD098059抑制后,其细胞中尿激酶纤维蛋白溶酶原激活剂(u-PA)的表达受到抑制。Guo等[12]则发现,细胞内ERK-2的活性增高的同时,表皮生长因子(EGF)刺激MCF-7细胞具有侵袭性。这些结果均提示ERK-2可能与肿瘤细胞的增殖、转移、侵袭等活动密切相关。
本组实验结果显示,结肠癌组织中ERK-2蛋白阳性表达率[75.9%(60/79)]高于癌旁组织[51.9%(41/79)]及正常组织[13.9%(11/79)],差异均有统计学意义(P < 0.05或P<0.01),提示ERK与结肠癌的发生、演进有关。ERK-2蛋白阳性表达率在不同年龄(<60岁、≥60岁)[77.5%(31/40)、74.4%(29/39)]、性 别(男/女)[70.7%(29/41)、68.4%(26/38)]、Dukes 分期(A、B、C、D 期)[73.3%(11/15)、76.7%(23/30)、71.4%(10/14)、70.0%(14/20)]、CEA 水平(<5 μg/L、≥5 μg/L)[68.2%(15/22)、64.9%(37/57)]因素间进行比较,差异均无统计学意义(P>0.05);ERK-2蛋白阳性表达率在不同分化程度(高中分化/低分化)[82.8%(48/58)、57.1%(12/21)]、浸润深度(未穿透肌层/浆膜或浆膜外)[46.2%(6/13)、72.7%(48/66)]和淋巴结转移(阳性/阴性)[76.5%(26/34)、53.3%(24/45)]因素间进行比较,差异有统计学意义(P < 0.05)。
ERK-2蛋白阳性表达还与患者预后有关[13]。本研究中,ERK-2蛋白阳性表达组患者12个月生存率为58.2%,ERK-2蛋白阴性表达组患者12个月生存率为60.4%,两组比较差异无统计学意义(P>0.05);ERK-2蛋白阳性表达组患者24个月生存率为38.7%,低于ERK-2蛋白阴性表达组患者24个月生存率(58.6%),差异有统计学意义(P< 0.05)。
本课题通过研究ERK-2蛋白表达与结肠癌临床病理及预后关系,发现ERK-2在结肠癌的诊断、治疗及预后判断中具有重要的临床意义,在蛋白分子水平上分析研究结肠癌复发、转移相关的生物学因素[14-16],掌握其复发、转移规律,对改善结肠癌的预后提供了基础。
[1]Parikh N,Shuck RL,Nguyen TA,et al.Mouse tissues that undergo neoplastic progression after K-Ras activation are distinguished by nuclear translocation of phospho-Erk1/2 and robust tumor suppressor responses[J].Mol Cancer Res,2012,10(6):845-55.
[2]Kilanczyk,Wasik U,Filipek A.CacyBP/SIP phosphatase activity in neuroblastoma NB2a and colon cancer HCT116 cells[J].Biochem Cell Biol,2012,90(4):558-564.
[3]Liu J,Shen M,Yue Z,et al.Triptolide inhibits colon-rectal cancer cells proliferation by induction of G1 phase arrest through upregulation of p21[J].Phytomedicine,2012,19(8-9):756-762.
[4]赵烨宏.结肠癌患者手术治疗的疗效分析 [J].中国医药指南,2012,10(34):437-438.
[5]Amsterdam A,Shezen E,Raanan C,et al.Two initiation sites of early detection of colon cancer,revealed by localization of pERK1/2 in the nuclei or in aggregates at the perinuclear region of tumor cells[J].Int J Oncol,2012,40(3):782-788.
[6]Silva M,Jaggers GK,Verstraeten SV,et al.Large procyanidins prevent bile-acid-induced oxidant production and membrane-initiated ERK1/2,p38,and Akt activation in Caco-2 cells[J].Free Radic Biol Med,2012,52(1):151-159.
[7]KawadaM,SenoH,KandaK,etal.Chitinase3-like1promotesmacrophage recruitment and angiogenesis in colorectal cancer[J].Oncogene,2012,31(26):3111-3123.
[8]Karna E,Szoka L,Palka J.Thrombin-dependent modulation of β1-integrin-mediated signaling up-regulates prolidase and HIF-1α through p-FAK in colorectal cancer cells[J].Mol Cell Biochem,2012,361(1-2):235-241.
[9]Massa F,Tormo A,Béraud-Dufour S,et al.Neurotensin-induced Erk1/2 phosphorylation and growth of human colonic cancer cells are independent from growth factors receptors activation[J].Biochem Biophys Res Commun,2011,414(1):118-122.
[10]Miyata M,Kambe M,Tajima O,et al.Membrane sialidase NEU3 is highly expressed in human melanoma cells promoting cell growth with minimal changes in the composition of gangliosides[J].Cancer Sci,2011,102(12):2139-2149.
[11]Wang J,Wu J,Hong J,et al.PKC promotes the migration of colon cancer cells by regulating the internalization and recycling of integrin αvβ6[J].Cancer Lett,2011,311(1):38-47.
[12]Guo D,Zhou H,Wu Y,et al.Involvement of ERK1/2/NF-κB signal transduction pathway in TF/FVⅡa/PAR2-induced proliferation and migration of colon cancer cell SW620[J].Tumour Biol,2011,32(5):921-930.
[13]Tong QY,Qing Y,Shu D,et al.Deltonin,a steroidal saponin,inhibits colon cancer cell growth in vitro and tumor growth in vivo via induction of apoptosis and antiangiogenesis[J].Cell Physiol Biochem,2011,27(3-4):233-242.
[14]Slattery ML,Lundgreen A,Herrick JS,et al.Genetic variation in the transforming growth factor-β signaling pathway and survival after diagnosis with colon and rectal cancer[J].Cancer,2011,117(18):4175-4183.
[15]杨波,高建飞,饶智国,等.原位杂交法检测结肠癌组织MMP-7 mRNA 的表达及其临床意义[J].临床误诊误治,2012,25(4):56-58.
[16]Duhamel S,Hébert J,Gaboury L,et al.Sef downregulation by Ras causes MEK1/2 to become aberrantly nuclear localized leading to polyploidy and neoplastic transformation[J].Cancer Res,2012,72(3):626-635.
