肿瘤干细胞在人结肠癌细胞株HT29耐奥沙利铂中的作用探讨
2013-10-17王怀志赵国强石献洲李怀洲
王怀志 赵国强 石献洲 汪 海 张 建 李怀洲
1.武警河南省总队医院普通外科,河南郑州 450052;2.郑州大学基础医学院,河南郑州 450052
在我国,结肠癌的发病率和死亡率均较高[1-2],因此,结肠癌的治疗对于民生具有重要的意义。奥沙利铂(Oxaliplatin,L-OHP)是一种铂类化疗药物,是治疗结肠癌的一线化疗药物。但是结肠癌细胞容易对L-OHP产生耐药性,这是结肠癌化疗失败的主要原因之一[3]。许多研究对这一现象及其机制进行了探讨[4-5],但是肿瘤干细胞(cancer stem cell,CSC)是否参与了这一过程并不清楚。本研究以L-OHP为诱导剂,建立了人结肠癌L-OHP耐药细胞株,观察了肿瘤干细胞标志物的表达,以探讨CSC在结肠癌细胞对L-OHP产生获得性耐药中的作用。
1 材料与方法
1.1 材料
人结肠癌细胞株HT29购自南京凯基科技生物发展有限公司;MTT试剂盒购自美国Sigma公司;L-OHP购自江苏恒瑞医药股份有限公司;TRIzol试剂购自美国Invitrogen公司;RPMI 1640培养基和小牛血清购自美国Gibico公司;As2O3购自哈尔滨伊达药业有限公司;RNA提取试剂盒购自德国QIAGEN公司;逆转录酶和Taq酶购自美国Promega公司。
1.2 实验方法
1.2.1 细胞培养
HT29的耐药株和亲本株均采用RPMI 1640(含10%的小牛血清)培养,于恒温37℃且含有5%体积CO2的细胞培养箱中培养。
1.2.2 人结肠癌耐L-OHP细胞株的诱导
采用药物浓度递增和间歇诱导相结合的方法诱导人结肠癌耐L-OHP细胞株。L-OHP浓度从4 μmol/L开始最终增加到 16 μmol/L,最终获得可耐受 16 μmol/L L-OHP的细胞HT29细胞株,命名为HT29/L-OHP,维持培养于含4 μmol/L L-OHP的正常培养液中,后续实验前1周撤药。
1.2.3 MTT法
MTT是一种染料,在活细胞的作用下,外源性的MTT被线粒体中的琥珀酸脱氢酶转变为蓝紫色结晶物,采用二甲基亚砜溶解此结晶物后,在540 nm波长处测定光密度值,可以根据此光密度值间接推算活细胞的数量。
1.2.4 生长曲线测定
将对数生长期的HT29及HT29/L-OHP细胞制成细胞悬液,细胞密度调整为1.5×104/mL,接种于96孔板中,MTT法测定每孔的吸光度(OD值),连续测定7 d,绘制生长曲线。 倍增时间计算公式如下:TD=T×lg2/lg(Nt/N0),其中,TD为倍增时间(h),T为细胞数目由N0增殖到至Nt所用的时间。 整个实验分为三组:HT29/L-OHP+L-OHP 组(12 μmol/L L-OHP 处理 的 HT29/L-OHP 细 胞 ),HT29+L-OHP 组(12 μmol/L L-OHP 处理的 HT29 细胞),HT29 组(无 L-OHP的HT29细胞)。
1.2.5 HT29和HT29/L-OHP细胞对L-OHP敏感性的测定
将HT29及HT29/L-OHP细胞接种于96孔板中,采用不同浓度的 L-OHP 处理,所用浓度分别为 0.1、1、10、100、1000 μmol/L。培养72 h后测定每孔的吸光度,计算细胞存活率、半数抑制浓度(IC50)和耐药指数(resistance index,RI)。细胞存活率=实验组OD值/对照组OD值×100%。RI=耐药细胞IC50/亲本细胞IC50。
1.2.6 As2O3细胞毒性实验
将HT29及HT29/L-OHP细胞接种于96孔板中,采用不同浓度的As2O3处理细胞,所用浓度分别为0.25、0.5、1.0、2.0、4.0 mg/L。培养72 h后测定每孔的吸光度,计算细胞抑制率。 细胞抑制率=[1-(AX-A)/(A0-A)]×100%,其中,AX为加药组的OD值,A0为空白对照组的OD值,A为单纯培养液组的OD值。
1.2.7 As2O3对HT29/L-OHP细胞耐药性的逆转
根据细胞毒性实验结果,选取无细胞毒剂量的As2O3进行实验。加入As2O372 h后测定HT29/L-OHP细胞对L-OHP的敏感性,计算IC50,并计算逆转倍数和相对逆转效率。逆转倍数=HT29/L-OHP的IC50/加入As2O3后HT29/L-OHP 的 IC50。 相对逆转效率=(HT29/L-OHP 逆转前IC50- HT29/L-OHP逆转后 IC50)/( HT29/L-OHP逆转前IC50- HT 的 IC50)。
1.2.8 实时荧光定量PCR
1.2.8.1 引物设计 采用引物在线软件设计引物并检测分析(blast.ncbi.nlm.nih.gov),最后由上海生物工程有限公司合成,引物序列(5'→3')见表1。

表1 扩增引物及扩增片段长度
1.2.8.2 总RNA的提取和逆转录 取对数生长期的耐药株和亲本株HT29细胞,采用RNA提取试剂盒提取总RNA并进行逆转录反应,得到的cDNA用于实时荧光定量PCR。
1.2.8.3 实时荧光定量PCR反应 反应体系:SYBR Premix Ex TaqTM(2×) 10 μL,Forword primer 0.4 μL,Reverse primer 0.4 μL,ROX Reference Dye(50×)0.4 μL,cDNA 2 μL,dH2O 6.4 μL。 反应条件:95℃变性 15 min,扩增 40循环,每循环变性 15 s,60℃退火 30 s,72℃ 30 s。 采用△△Ct法进行相对定量分析。
1.3 统计学方法
采用SPSS 10.0统计软件包进行数据处理,计量资料进行方差齐性分析和正态分布检验,方差齐且呈正态分布的数据,组间比较采用单因素方差分析;方差不齐或者非正态分布数据均进行变量变换,变换后再进行方差齐性分析和正态分布检验,若变换后仍方差不齐或者非正态分布的数据,对其进行非参数检验。以P<0.05为差异有统计学意义。
2 结果
2.1 人结肠癌耐药细胞株HT29/L-OHP的鉴定
MTT 结果显示,L-OHP(12 μmol/L)存在的情况下,在第1、2天时,HT29/L-OHP和HT29细胞的增殖速度差异无统计学意义(P > 0.05),但是在第 3~7 天,HT29/L-OHP细胞增殖速度显著高于HT29细胞(P<0.01)(图1)。HT29/L-OHP细胞的倍增时间为28.7 h,低于HT29细胞(45.1 h)。同无L-OHP作用的HT29细胞相比,HT29/L-OHP细胞的增殖速度无显著改变(P > 0.05)(图1),HT29/L-OHP 细胞的倍增时间接近于无L-OHP作用的HT29细胞(26.3 h)。MTT结果显示,HT29/L-OHP 细胞的 IC50为 138.4 μmol/L,HT29细胞的 IC50为 12.1 μmol/L,RI为 11.44。
2.2 As2O3细胞毒性实验结果
结果表明,0.25 mg/L的As2O3对HT29细胞无毒性反应,但是当浓度超过0.25 mg/L时,As2O3呈现出剂量依赖性的毒性效应(表2),可以认为0.20 mg/L的As2O3为无细胞毒性剂量。
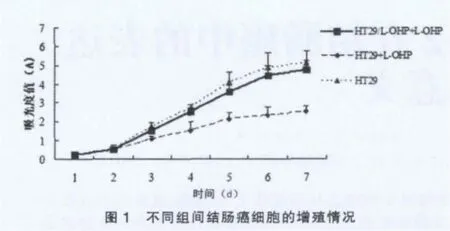
表2 不同浓度As2O3的细胞毒性测定(±s)
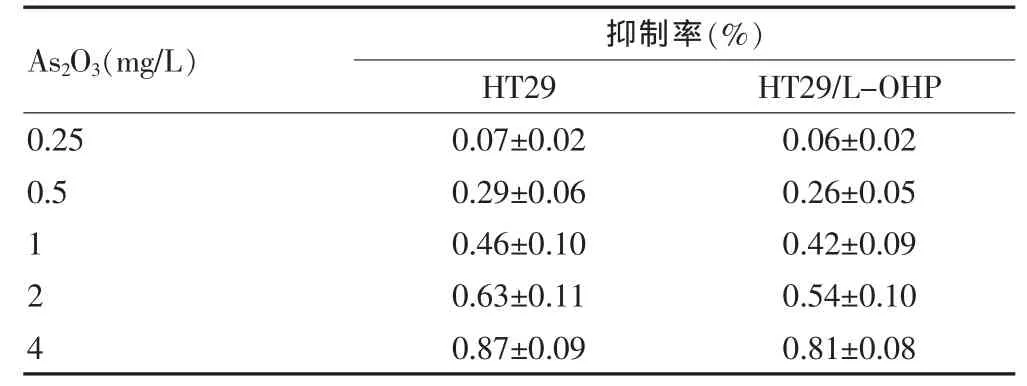
表2 不同浓度As2O3的细胞毒性测定(±s)
As2O3(mg/L)0.25抑制率(%)HT29 HT29/L-OHP 0.5 124 0.07±0.02 0.29±0.06 0.46±0.10 0.63±0.11 0.87±0.09 0.06±0.02 0.26±0.05 0.42±0.09 0.54±0.10 0.81±0.08
2.3 As2O3对HT29/L-OHP细胞耐药性的逆转
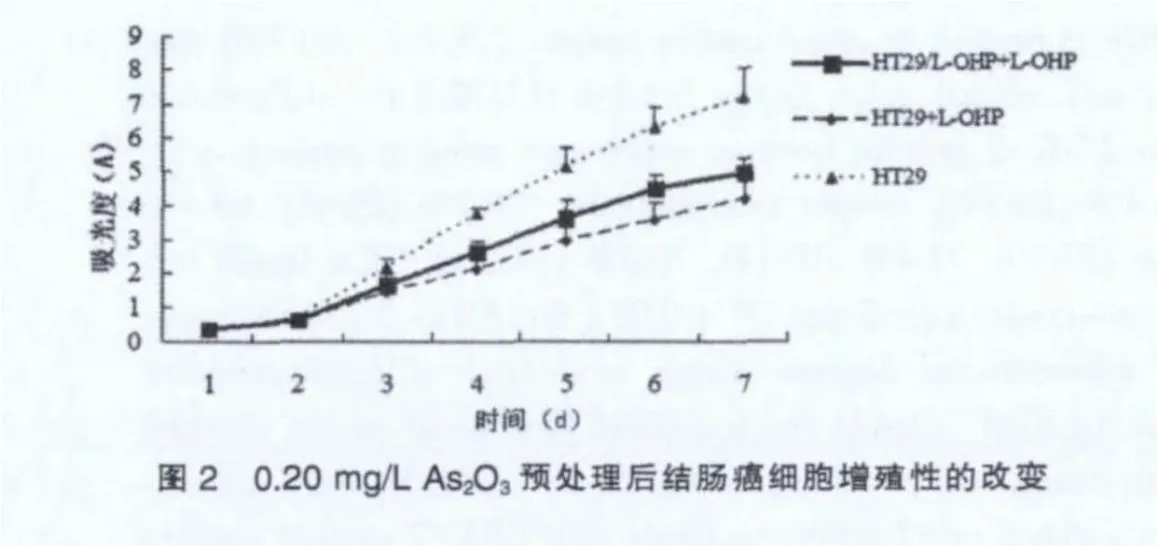
As2O3(0.20 mg/L)预处理后,MTT 结果显示,在 L-OHP(12 μmol/L) 存在的情况下,在第 1~5 天时,HT29/L-OHP 和HT29细胞的增殖速度差异无统计学意义(P>0.05,图2),但是在第6、7天,HT29/L-OHP细胞增殖速度显著高于HT29细胞(P < 0.05,图2);统计结果表明,HT29/L-OHP 细胞的倍增时间为39.8 h,与HT29细胞倍增时间的差距减小(46.3 h)。结果还表明,同无L-OHP作用的HT29细胞相比,在第1、2天时,HT29/L-OHP细胞的增殖速度无显著改变(P > 0.05,图2),但是在第 3~7 天,HT29/L-OHP 细胞的增殖速度降低(P<0.05,图2),其倍增时间高于无L-OHP作用的HT29细胞(28.6 h)。MTT结果还表明,As2O3(0.20 mg/L)预处理后,HT29/L-OHP 细胞的 IC50为 36.8 μmol/L,逆转倍数为3.76,相对逆转效率为80.4%。
2.4 Sox-2、miR-200c和 let-7的表达
实时荧光定量PCR结果表明,相对于HT29细胞,HT29/L-OHP细胞的Sox-2的表达显著增强(P<0.01),但是mir-200c 和 let-7 的表达显著下降(P < 0.05);As2O3(0.20 mg/L)预处理后,相对于逆转之前的HT29/L-OHP细胞,HT29/L-OHP细胞中 Sox-2的表达显著降低(P<0.05),mir-200c和 let-7 的表达显著升高(P < 0.05)。 见表3。
表3 各组间Sox-2、miR-200c和let-7基因表达情况(±s)

表3 各组间Sox-2、miR-200c和let-7基因表达情况(±s)
注:与 HT29组比较,*P < 0.05,**P < 0.01;与 HT29/L-OHP 组比较,#P<0.05
组别 Sox-2 miR-200c let-7 HT29组HT29/L-OHP 组As2O3+HT29/L-OHP 组0.019±0.010 0.072±0.038**0.032±0.012#0.726±0.289 0.262±0.136*0.367±0.256#0.642±0.268 0.213±0.145*0.3869±0.253#
3 讨论
本研究首先采用药物浓度递增和间歇诱导相结合的方法诱导产生了人结肠癌HT29/L-OHP耐药细胞株。生长曲线分析表明,在L-OHP的作用下,HT29/L-OHP细胞的增殖速度显著高于HT29细胞,说明HT29/L-OHP细胞对L-OHP的耐受性显著高于HT29细胞。结果还发现,同未经L-OHP作用的HT29细胞相比,L-OHP作用下的HT29/L-OHP细胞的增殖速度未见显著降低,说明经过长时间诱导后,HT29/L-OHP细胞恢复了增殖能力。L-OHP敏感性测定结果表明,HT29/L-OHP细胞的IC50高于HT29细胞,RI为 11.44,说明 HT29/L-OHP 细胞对 L-OHP 高度耐药[6]。综合以上结果,本研究成功建立了能够在L-OHP作用下稳定生长的HT29/L-OHP耐药细胞株。
多项研究表明,CSC是多种肿瘤细胞产生化疗药物耐药性的重要机制之一[7-8],但是CSC在结肠癌细胞对L-OHP耐药中的作用并不清楚。为了探讨CSC是否参与了结肠癌细胞的耐药过程,本研究采用实时荧光定量PCR观察了与干细胞相关的标记物的表达。Sox-2是一种具有很强特异性的胚胎干细胞标记物,在干细胞中的表达较强[9-10]。miR-200c和let-7是两种微小RNA,与肿瘤的发生发展、侵袭和分化等过程密切相关,在CSC中表现为低表达[11-12]。本研究中,相对于HT29细胞,HT29/L-OHP细胞Sox-2的表达显著增加,而miR-200c和let-7的表达显著下降,说明诱导HT29细胞获得对L-OHP的耐药性后,HT29/LOHP细胞的干细胞特性增强。
为了进一步研究CSC的作用,本研究采用As2O3逆转了HT29/L-OHP细胞的耐药性,观察了干细胞相关的标记物的表达。细胞毒性实验表明,在剂量超过0.25 mg/L时,As2O3对结肠癌细胞系表现出剂量依赖性的毒性效应,笔者预实验表明,0.20 mg/L的As2O3对HT29细胞和HT29/L-OHP细胞均无毒性效应。因此,可以认为0.20 mg/L的As2O3为无细胞毒性剂量,与文献报道一致[13]。0.20 mg/L As2O3处理72 h后,HT29/L-OHP细胞的增殖速度和 IC50均显著降低,表明成功逆转了HT29/L-OHP细胞的耐药性。实时荧光定量PCR表明,As2O3处理后,同未处理前相比,HT29/L-OHP 细胞 Sox-2的表达显著下降,而 miR-200c和let-7的表达显著增加,说明随着耐药性的下降,HT29/LOHP细胞的干细胞特性减弱。
综上所述,本研究认为CSC有可能是HT29细胞对L-OHP产生耐药性的重要机制之一。
[1]吕强,邢沈阳,赵志辉,等.结肠癌的研究现状及展望[J].中国实验诊断学,2009,13(8):1134-1137.
[2]苏华冠,刘特彬,王锦祥.2002~2011年揭阳地区结直肠癌流行病学研究[J].消化肿瘤杂志:电子版,2012,21(1):98-100.
[3]Ametller E,García-Recio S,Pastor-Arroyo EM,et al.Differential regulation of MMP7 in colon cancer cells resistant and sensitive to oxaliplatin-induced cell death[J].Cancer Biol Ther,2011,11(1):4-13.
[4]Ekblad L,Johnsson A.Cetuximab sensitivity associated with oxaliplatin resistance in colorectal cancer[J].Anticancer Res,2012,32(3):783-786.
[5]Sartore-Bianchi A,Bencardino K,Cassingena A,et al.Therapeutic implications of resistance to molecular therapies in metastatic colorectal cancer[J].Cancer Treat Rev,2010,36(Suppl 3):1-5.
[6]Snow K,Judd W.Characterisation of adriamycin-and amsacrine-resistanthumanleukaemicTcelllines[J].BrJCancer,1991,63(1):17-28.
[7]Gottschling S,Schnabel PA,Herth FJ,et al.Are we missing the target Cancer stem cells and drug resistance in non-small cell lung cancer[J].Cancer Genomics Proteomics,2012,9(5):275-286.
[8]Malik B,Nie D.Cancer stem cells and resistance to chemo and radio therapy[J].Front Biosci(Elite Ed),2012,4:2142-2149.
[9]Yang J,Liao D,Chen C,et al.Tumor-associated macrophages regulate murine breast cancer stem cells through a novel paracrine EGFR/Stat3/Sox-2 signaling pathway[J].Stem Cells,2013,31(2):248-258.
[10]Wojakowski W,Kucia M,Zuba-Surma E,et al.Very small embryoniclike stem cells in cardiovascular repair[J].Pharmacol Ther,2011,129(1):21-28.
[11]Shimono Y,Zabala M,Cho RW,et al.Downregulation of miRNA-200c links breast cancer stem cells with normal stem cells[J].Cell,2009,138(3):592-603.
[12]Kong D,Heath E,Chen W,et al.Loss of let-7 up-regulates EZH2 in prostate cancer consistent with the acquisition of cancer stem cell signatures that are attenuated by BR-DIM[J].PLoS One,2012,7(3):e33729.
[13]王秀丽,孔力,赵瑾瑶,等.三氧化二砷逆转人乳腺癌MCF-7/ADM细胞耐药的机制研究[J].中华肿瘤杂志,2011,13(3):38-40.
