3,4-二羟基苯甲酸乙酯合成工艺研究
2013-10-16周石洋黄坤林
周石洋,陈 玲,黄坤林
(1.重庆牧哥食品有限公司,重庆 401520;2.重庆师范大学 化学学院,重庆 401331;3.西南大学 育才学院,重庆 401524)
0 引言
3,4-二羟基苯甲酸乙酯又名儿茶酸乙酯,常温常压下比较稳定,无臭或微有酚臭味,味微苦[1-5]。3,4-二羟基苯甲酸乙酯具有抗氧化作用,通常用作食品添加剂中的抗氧化剂[4]。它是一种重要的医药中间体,可用于合成3,4-二羟基苯甲酸甲酯等药品。国内外有关合成3,4-二羟基苯甲酸乙酯的文献很少,目前合成3,4-二羟基苯甲酸乙酯的方法是用3,4-二羟基苯甲酸和乙醇反应合成,其产率为84.5%。其中3,4-二羟基苯甲酸本身就是一种重要的中间体,直接用它来合成3,4-二羟基苯甲酸乙酯不经济,应当寻求廉价的合成原料来合成3,4-二羟基苯甲酸乙酯。4-甲基邻苯二酚是一种比较低廉的合成原料,国内都有生产销售。本文采用4-甲基邻苯二酚为原料,通过氧化[6]、酯化[9]两步来合成3,4-二羟基苯甲酸乙酯。4-甲基邻苯二酚先与高锰酸钾在催化剂TBAB(四叔丁基溴化铵)作用下发生反应,生成3,4-二羟基苯甲酸;再在催化剂TsOH(对甲基苯磺酸)作用下与乙醇反应,最后合成目标3,4-二羟基苯甲酸乙酯。实验证明,本合成方法提高了产率[7],在最优条件下产率可达90.5%,降低了成本,具有较好的工业应用前景[8]。目标产物的合成路线如下:

1 实验部分
1.1 仪器与试剂
SMP40全自动熔点测定仪(英国STUART公司);IR200傅立叶红外光谱仪(美国赛默飞世尔公司);AVANCE-II 500 MHz核磁共振仪(德国Bruker公司)。
4-甲基邻苯二酚、高锰酸钾、无水乙醇、苯、TBAB、TsOH、盐酸、碳酸钠等试剂均为分析纯。
1.2 3,4-二羟基苯甲酸的合成
在250mL圆底烧瓶中放入12.41g(0.10mol)4-甲基邻苯二酚和100mL蒸馏水,然后加入34.33 g高锰酸钾(0.22mol)和一定量催化剂TBAB(四叔丁基溴化铵),投入3~4粒沸石,在回流温度下反应一定时间。当回流不再出现油珠时,停止加热。将反应混合物趁热抽滤,用少量热蒸馏水洗涤滤渣3次,合并滤液并倒入400mL的干净烧杯中,烧杯放在冷水浴中冷却,然后用过量的浓盐酸酸化[9]。将酸化后的溶液减压蒸馏,收集250~252℃的馏分。得到3,4-二羟基苯甲酸14.75g,产率95.7%(GC),熔点198~200℃(197~200℃[4]。IR(KBr,ν/cm-1):3 218(羧基中的-OH),2 945((苯环中的=C-H),1 685(羧基中-C=O),1 613(苯环中的C=C),1 295(苯环中对位的-OH),1 236(苯环中邻位的-OH);1H NMR(CDCl3),δ:9.49(s,2H,-OH),7.35(s,1H,Ph-H),7.34(d,1H,Ph-H),6.82(m,1H,Ph-H);13C NMR(CD3OD),δ:167.6,150.1,144.9,122.3,121.8,116.5,115.2。
1.3 3,4-二羟基苯甲酸乙酯的合成
在250mL三颈瓶中,加入6.70mL无水乙醇(0.115 mol),摇动下慢慢加入一定量的TsOH(对甲基苯磺酸)作为催化剂,使其混合均匀,并加入3~4粒沸石。加热进行回流,在回流温度下反应一定时间,直至分水器中的水量不再增加[10]。再延长10~15 min,加入25 mL 苯,搅拌,趁热过滤出催化剂(TsOH),将滤液迅速倒入冷水中。固体粗产品从水中析出,过滤,用5% Na2CO3和蒸馏水洗涤滤渣[11],干燥滤渣,得粗产品17.55g。将干燥好的粗3,4-二羟基苯甲酸乙酯倾入100 mL 的蒸馏瓶中进行蒸馏,收集133~135℃的馏分。得纯产品3,4-二羟基苯甲酸乙酯16.49g,产率94.6%(GC;整体产率90.5%),熔点132~135℃(131~136℃[5]。IR(KBr,ν/cm-1):3 380((苯环中的=C-H),2 954(甲基中的-CH3),2 875(亚甲基中的-CH2-),1 687(羰基中的-C=O),1 604(苯环中的C=C),1 295(苯环中对位的-OH),1 221(苯环中邻位的-OH);1H NMR(CDCl3),δ:9.81(s,1H,-OH),9.40(s,1H,-OH),7.40(s,1H,Ph-H),7.34(d,1H,Ph-H),6.82(m,1H,Ph-H),4.24(d,2H,-CH2-),1.30(d,3H,-CH3);13C NMR(CD3OD),δ:165.7,150.2,145.1,121.7,121.1,116.6,115.2,60.0,14.2。
2 结果与讨论
2.1 3,4-二羟基苯甲酸合成
2.1.1 催化剂TBAB 用量对3,4-二羟基苯甲酸合成的影响
催化剂TBAB(四叔丁基溴化铵)的用量[12]关系到3,4-二羟基苯甲酸合成反应的产率,实验中以反应物的摩尔比的1%~10%催化剂用量来考察其对合成反应的影响,其它反应条件不变。催化剂TBAB用量对3,4-二羟基苯甲酸合成的影响见图1。

图1 催化剂TBAB用量对3,4-二羟基苯甲酸合成的影响Fig.1 Effect of the amount of the catalyst TBAB on the yield of 3,4-dihydroxybenzoic acid
由图1 可见,当催化剂TBAB 用量为反应物的5%时,其3,4-二羟基苯甲酸合成的产率最高。催化剂用量不足,降低了反应速率,反应物不能完全发生反应,3,4-二羟基苯甲酸合成的产率低;当催化剂过量,催化剂跟产物结合在一起,不易分离开来,使合成产率缓慢下降。因此在合成3,4-二羟基苯甲酸时要控制好催化剂TBAB 的用量,控制在反应物的5%最宜。
2.1.2 高锰酸钾用量对3,4-二羟基苯甲酸合成的影响
高锰酸钾在催化剂作用下氧化4-甲基邻苯二酚中的甲基,生成3,4-二羟基苯甲酸。在实验中选取了高锰酸钾和4-甲基邻苯二酚的摩尔比分别为2.0∶1.0、2.1∶1.0、2.2∶1.0、2.3∶1.0、2.4∶1.0进行实验,其它反应条件不变。其高锰酸钾用量对3,4-二羟基苯甲酸合成的影响见表1。

表1 高锰酸钾用量对3,4-二羟基苯甲酸合成的影响Table 1 Effect of the potassium permanganate on the yield of 3,4-dihydroxybenzoic acid
由表1可见,随着高锰酸钾用量的增加其合成产率增大,当高锰酸钾和4-甲基邻苯二酚摩尔比为2.2∶1.0以后,其合成产率几乎不增长。为了尽可能降低合成成本,提高经济效益,控制其摩尔比为2.2∶1.0即可。
2.1.3 反应时间对3,4-二羟基苯甲酸合成的影响
反应时间分别为1、1.5、2、2.5、3、3.5、4、4.5、5、5.5h,其它反应条件不变,其反应时间对3,4-二羟基苯甲酸合成的影响见图2。
由图2可见,随着反应时间的增加,3,4-二羟基苯甲酸产率不断提高,当反应进行到3h后,反应产率几乎不增长。反应进行到3h时,其反应物已经反应得比较充分了,延长反应时间对其产率影响较小。故在合成3,4-二羟基苯甲酸时控制合成时间在3h左右。
2.1.4 反应温度对3,4-二羟基苯甲酸合成的影响
分别选择了80、90、100、110、120、130、140、150、160℃反应温度,其它反应条件不变。得出反应温度对3,4-二羟基苯甲酸合成的影响见图3。

图2 反应时间对3,4-二羟基苯甲酸合成的影响Fig.2 Effect of the reaction time on the yield of 3,4-dihydroxybenzoic acid
由图3可见,随着反应温度的升高,3,4-二羟基苯甲酸产率不断提高,当反应温度达到120℃时产率达到最高值,之后反应温度升高,其产率降低。因为随温度的升高,催化剂活性不断提高,温度过高催化剂效果降低,高温还能发生脱羧等一系列副反应,因而产率降低。在合成3,4-二羟基苯甲酸时控制反应温度在120℃。

图3 反应温度对对3,4-二羟基苯甲酸合成的影响Fig.3 Effect of the reaction temperatures on the yield of 3,4-dihydroxybenzoic acid
2.2 3,4-二羟基苯甲酸乙酯的合成
2.2.1 催化剂TsOH 用量对3,4-二羟基苯甲酸乙酯合成的影响
考察催化剂TsOH(对甲基苯磺酸)用量对3,4-二羟基苯甲酸合成反应的产率的影响时[13],选择了催化剂TsOH 用量为反应物摩尔比的1%~10%进行探讨,其它反应条件不变。催化剂TsOH用量对3,4-二羟基苯甲酸乙酯合成的影响见图4。
由图4可见,当催化剂TsOH 用量为反应物摩尔比的6%时,其3,4-二羟基苯甲酸乙酯合成的产率最高。催化剂用量不足,降低了反应速率,反应物不能完全发生反应,3,4-二羟基苯甲酸乙酯合成的产率低;当催化剂过量,会发生生成酸酐等一系列副反应,也能导致其合成产率低。因此在合成3,4-二羟基苯甲酸乙酯时要控制好催化剂TsOH 的用量,控制在反应物摩尔比的6%最宜。

图4 催化剂TsOH 用量对3,4-二羟基苯甲酸乙酯合成的影响Fig.4 Effect of the amount of the catalyst TsOH on the yield of 3,4-dihydroxybenzoate
2.2.2 乙醇用量对3,4-二羟基苯甲酸乙酯合成的影响
选取乙醇与3,4-二羟基苯甲酸的摩尔比分别为1.0∶1.0、1.1∶1.0、1.2∶1.0、1.3∶1.0、1.4∶1.0、1.5∶1.0 进行实验,其它反应条件不变。其乙醇用量对3,4-二羟基苯甲酸乙酯合成的影响见表2。

表2 乙醇用量对3,4-二羟基苯甲酸乙酯合成的影响Table 2 Effect of the ethanol on the yield of 3,4-dihydroxybenzoate
由表2可见,随着乙醇用量的增加其合成产率也相应增加[14],当乙醇与3,4-二羟基苯甲酸的摩尔比为1.2∶1.0时,其产物产率最高,之后随乙醇用量增加,其产物产率降低。因为过量的乙醇能发生一系列副反应,如产生乙醚等,故降低了3,4-二羟基苯甲酸乙酯的产率,并且浪费了乙醇。因此在合成3,4-二羟基苯甲酸乙酯时,控制其摩尔比为1.2∶1.0即可。
2.2.3 反应时间对3,4-二羟基苯甲酸乙酯合成的影响
探讨反应时间对3,4-二羟基苯甲酸乙酯的影响时,选取了1、1.5、2、2.5、3、3.5、4、4.5、5、5.5h反应时间进行研究,其它反应条件不变,其反应时间对3,4-二羟基苯甲酸乙酯合成的影响见图5。
由图5可见,随着反应时间的增加,3,4-二羟基苯甲酸乙酯产率不断提高,当反应进行到3h后,达到最高值,之后随着时间延长,产物产率下降。因为随着时间的延长,反应物发生了分解等一系列副反应,因此降低了产物产率。故在合成3,4-二羟基苯甲酸乙酯时控制合成时间在3h左右。
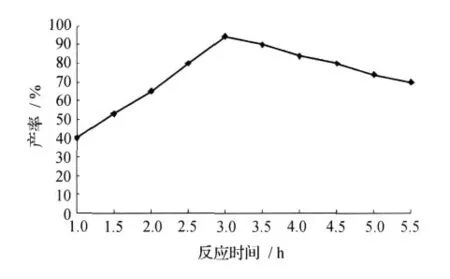
图5 反应时间对3,4-二羟基苯甲酸乙酯合成的影响Fig.5 Effect of the reaction time on the yield of 3,4-dihydroxybenzoate
2.2.4 反应温度对3,4-二羟基苯甲酸乙酯合成的影响
分别选择了50、60、70、80、90、100、110、120、130、140℃反应温度进行探讨,其它反应条件不变。得出反应温度对3,4-二羟基苯甲酸乙酯合成的影响见图6。

图6 反应温度对对3,4-二羟基苯甲酸乙酯合成的影响Fig.6 Effect of the reaction temperatures on the yield of 3,4-dihydroxybenzoate
由图6可见,随着反应温度的升高,3,4-二羟基苯甲酸乙酯产率不断提高,当反应温度达到90℃时产率达到最高值,之后反应温度升高,其产率降低。因为随温度的升高,催化剂活性不断提高,温度过高催化剂效果降低,高温还能发生一系列副反应,如乙醚、乙烯等生成,因而产率降低。在合成3,4-二羟基苯甲酸乙酯控制反应温度在90℃。
2.3 3,4-二羟基苯甲酸和3,4-二羟基苯甲酸乙酯的红外谱图分析
采用IR200傅立叶红外光谱仪,通过KBr压片法对中间产物和目标产物进行红外光谱表征,扫描范围4 000~500cm-1。其中间产物3,4-二羟基苯甲酸的红外光谱图见图7;目标产物3,4-二羟基苯甲酸乙酯的红外光谱图见图8。由图7 可见,中间产物在3 218cm-1处的吸收峰是羟基-OH 的伸缩振动的特征吸收峰;2 945cm-1处的吸收峰是苯环中的氢=C-H 的面外弯曲振动,表明中间产物中有苯环结构的存在;1 685cm-1处吸收峰是羰基-C=O 的伸缩振动的特征吸收峰;1 613cm-1处的吸收峰是苯环C=C 的伸缩振动的特征吸收峰;1 295cm-1处苯环对位羟基-OH 伸缩振动的特征吸收峰;1 236cm-1处苯环邻位羟基-OH 的伸缩振动的特征吸收峰。中间产物的红外光谱表征结果与3,4-二羟基苯甲酸结构一致。由图8可见,目标产物在3 380cm-1处吸收峰是苯环中的氢=C-H,同样也表明目标产物中有苯环结构的存在;在2 954cm-1处吸收峰是甲基-CH3的面外弯曲振动;2 875cm-1处吸收峰是亚甲基-CH2-的收缩振动特征吸收峰;1 687cm-1处吸收峰是羰基-C=O 的伸缩振动的特性吸收峰;1 604cm-1处吸收峰是苯环C=C的伸缩振动的特性吸收峰;1 295cm-1处苯环对位羟基-OH 伸缩振动的特征吸收峰;1 221cm-1处苯环邻位羟基-OH 伸缩振动的特征吸收峰,表明目标产物中有羧酸的存在。目标产物的红外光谱表征结果与3,4-二羟基苯甲酸乙酯结构一致。
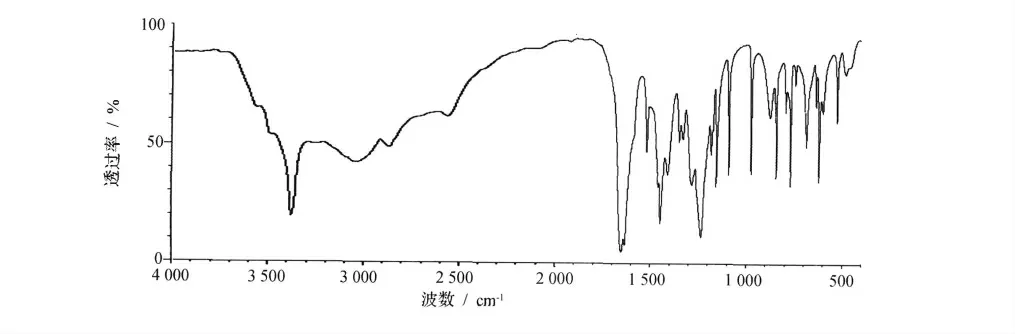
图7 3,4-二羟基苯甲酸红外光谱图Fig.7 IR spectra of 3,4-dihydroxybenzoic acid

图8 3,4-二羟基苯甲酸乙酯红外光谱图Fig.8 IR spectra of 3,4-dihydroxybenzoate
3 结论
以4-甲基邻苯二酚为原料,经过高锰酸钾氧化、乙醇酯化两步反应合成产物3,4-二羟基苯甲酸乙酯。氧化的最佳条件为:催化剂TBAB 用量为反应物摩尔比的5%、高锰酸钾与4-甲基邻苯二酚摩尔比为2.2∶1.0、反应时间为3h、反应温度为120℃;酯化的最佳条件为:催化剂TsOH 用量为反应物摩尔比的6%、乙醇与3,4-二羟基苯甲酸摩尔比为1.2∶1.0、反应时间3h、反应温度90℃。在最佳条件下,3,4-二羟基苯甲酸乙酯的产率可达90.5%。
[1]徐克勋.精细有机化工原料及中间体手册[K].北京:化学工业出版社,1998:133-135.
[2]程铸生,朱乘炎.精细化学品化学[M].上海:华东化工学院出版社,1990:126-129.
[3]Aldrich Chemical Company.Aldrich[M].Milwaukee:Sigma-Aldrich Co,2007-2008:367-369.
[4]陈业荣.有机合成工艺及优化[M].北京:化学工业出版社,2005:181-195.
[5]章思规,章 伟.精细化学品及中间体手册[K].北京:化学工业出版社,2004:960-961.
[6]周石洋,陈 玲.2,4,6-三溴-4′-硝基二苯醚合成的研究[J].化工中间体,2012,9(3):28-30.
[7]Pizzio L,Vazquez P.Tungstophosphoric and molybdophosphoric acids supported on zirconia as esterification catalysts[J].CatalLett,2001,77(4):233-239.
[8]Anastas P T,Bartlett L B,Kirchhoff M M,et a1.The role of catalysis in the design,development,and implementation of Green Chemistry[J].Catalysis Today,2000,55:11-22.
[9]周石洋,陈 玲.2,4,6-三溴-3-羟基苯甲酸的合成[J].西南民族大学:自然科学版,2012,38(5):797-802.
[10]张 睿,刘秀杰,胡 涛,等.3-氨基苯甲酸的合成[J].天津理工大学学报:自然科学版,2010,26(3):38-39.
[11]严 兵,章亚峰,梁子军,等.对羟基苯甲酸在有机合成中的应用[J].精细化工中间体,2010,37(12):42-44.
[12]闫慧丽,张立新,张慧芳,等.3-溴-4-羟基-5-甲氧基苯甲酸甲酯的合成[J].科学技术与工程,2011,28(5):1 109-1 109.
[13]周石洋,陈 玲,袁月华.4-氨基苯甲酸的合成工艺研究[J].天津师范大学学报:自然科学版,2013,33(1):93-96.
[14]田志高,安 昌,谭珍友,等.3-硝基-2-氨基苯甲酸的合成[J].合成化学,2009,17(1):106-108.
