盐胁迫下甜菜M14品系膜蛋白的提取和检验
2013-10-16李金娜陈思学李海英
潘 钰,李金娜,陈思学,李海英
(黑龙江大学a.生命科学学院;b.黑龙江省普通高等学校分子生物学重点实验室;c.农业微生物技术教育部工程研究中心,哈尔滨 150080)
0 引言
植物在生长发育过程中会遭遇各种不利环境因子,如高温、低温、干旱和高盐等。植物感受这些胁迫信号后通过信号转导过程调节细胞内抗胁迫相关蛋白的表达,进而调节自身的生理状态或形态来适应不利环境。因此,寻找抗胁迫相关蛋白(或基因)对了解植物抗胁迫机制以及提高植物抗胁迫性能有着十分重要的意义[1-3]。土地盐碱化是当今世界普遍关注的问题之一,盐胁迫是限制植物生长、降低植物产量的主要非生物胁迫之一[4-6]。
植物在受到盐胁迫时会形成一些蛋白质或使某些蛋白质合成增强,称为盐胁迫蛋白,膜蛋白质组是指在特定条件和特定时间细胞中的全部膜蛋白[7]。盐胁迫作用于植物往往是直接使生物膜受到伤害,膜结构完整性及膜功能受到破坏,细胞膜系统是植物盐害的主要部位,其结构和功能遭到破坏或损伤,进而引起一系列生理生化功能的改变,因此深入揭示膜蛋白在响应高盐胁迫信号转导过程中的作用是非常重要的[8]。
甜菜M14 品系是在栽培甜菜(BetavulgarisL.)染色体基础上附加野生白花甜菜(B.corollifloraZoss.)第9号染色体的单体附加系,具有野生白花甜菜的一些优良性状,如抗逆、无融合生殖等,同时克服了野生白花甜菜复杂的遗传背景,并且甜菜是典型的盐生植物,因此它是挖掘野生白花甜菜耐盐基因及蛋白的良好材料[9-12]。植物抗逆性的研究一直是生物学研究领域的热点,是农业生产可持续发展的基础。膜蛋白的功能决定了膜的功能,膜蛋白在不同细胞的生理过程中发挥重要作用。但由于溶解、分离和鉴定的困难性,各种膜蛋白研究方法很难完全解决膜蛋白研究所面临的问题[13]。获得盐胁迫下甜菜M14品系差异表达膜蛋白,不仅可以研究膜蛋白在响应高盐胁迫信号转导过程中的作用,还能推动甜菜抗逆性的研究,而且可广泛应用于其它农作物以提高其抗逆性,从而为培育出更优良的作物品种奠定坚实的基础,这对改良松嫩盐碱地、扩大甜菜在东北地区的种植面积具有重要意义。
本研究以甜菜M14品系为试验材料,利用水培法种植甜菜,以不进行盐胁迫的甜菜为对照,分别以不同浓度氯化钠进行盐胁迫处理。提取甜菜叶片及根膜蛋白,进行定量并采用Western Blot进行膜蛋白的检验,为后续利用同位素标记相对和绝对定量(iTRAQ)技术研究甜菜M14品系盐胁迫下差异表达膜蛋白奠定基础。
1 材料和方法
1.1 植物材料
甜菜M14 品系(Chromosome 9 monosomic addition line ofBetacorollifloraZoss.inBetavulgarisL.,VV+C9,2n=18+1),其染色体组成中除了包含18条栽培甜菜染色体外,还附加有白花甜菜第9号染色体,种植于黑龙江大学植物园。
1.2 植物材料的种植和NaCl处理
甜菜M14品系的种子经乙醇、升汞和福美双消毒后,播种在蛭石中,保持蛭石湿润。7d 后,将甜菜M14品系幼苗移至含有Hoagland营养液的水培槽中,在光照培养室进行培养,培养条件为:温度25℃/20℃day/night,光照强度450μMol/(m2·s),相对湿度70%,光周期13h/11hlight/dark。播种21d后,将甜菜M14品系幼苗分成3组,分别用含有0(对照)、200、400 mMol/L NaCl的Hoagland营养液对甜菜M14品系幼苗进行盐处理,每个处理组3次重复。盐胁迫7d后,甜菜M14品系对照组和盐处理组的叶片和根样品经过液氮速冻后,存放于-80℃冰箱。
1.3 膜蛋白的分离
膜蛋白的提取采用Pang[14]的方法稍作改动,将甜菜M14品系对照组和盐处理组的叶片及根约10g分别放入液氮预冷的研钵中,用研棒在液氮中快速磨成粉末,加入适量液氮,反复研磨,至叶片完全变成白色的细微粉末即可;将粉末用3倍体积预冷的匀浆液(2mMol/L EDTA,50mMol/L Tris,pH8.0,250 mMol/L 蔗糖,2 mMol/L DTT,0.2 mMol/L PMSF,0.6%聚乙烯比咯烷酮)溶解,转移至50mL的离心管中,充分匀浆;4℃,8 000g 离心15 min,取上清,重复2 次;取上清,4℃,100 000g 离心,弃上清;用100 mMol/L预冷碳酸钠重悬浮沉淀,用玻璃匀浆器彻底匀浆,冰上保持20min;4℃,100 000g离心,弃上清;用半浓度匀浆液重悬浮沉淀,玻璃匀浆器匀浆,4℃,100 000 g 离心;沉淀重悬浮于50mMol/L Tris中,玻璃匀浆器匀浆,分装后存于-20℃。
1.4 蛋白质定量
使用GE 公司的2D-Quant试剂盒进行蛋白质定量分析,步骤如下:首先制备工作比色剂,即将100∶1的比色剂A 与比色剂B 相混合,每次测定时需要1 mL 工作比色剂;使用2 mg/mL 浓度的BSA 标准溶液制备标准曲线(0~50μg);制备含1~50μL待测样品的微型离心管,每个微型离心管(包括含BSA 标准溶液的离心管)加入500μL沉淀剂,振荡并在室温下培育2~3 min;加入500μL共沉淀剂,短暂混匀,离心(至少10 000g离心力)5 min;弃去上清液,简单离心,将残余的上清液收集至管底,用移液器吸去残余的上清液;每个管中加入100μL铜溶液和400μL蒸馏水(应彻底震荡混匀,确保沉淀完全溶解),然后每个管中加入1mL工作比色剂,应确保以最快的速度加入,使之与样本立即混合,室温下静置15~20min;采用分光光度计测定样本和标准溶液的480nm 波长的吸光率,根据标准溶液蛋白质含量的吸光率,绘制标准曲线。将样本与标准曲线比较,得到样本蛋白质浓度。
1.5 蛋白质样品的Western Blot检验
蛋白质经定量之后,取10 μg 的蛋白进行SDS-PAGE;将电泳结束后的凝胶浸泡于转移缓冲液中10min;剪切1 张与凝胶大小一致的PVDF膜于甲醇中浸泡2min;将膜与6张与膜同大小的Whatman(3mm)滤纸浸入转移缓冲液中20min;组装转移装置:阳极-海绵-3张3 mm 滤纸-PVDF膜-凝胶-3张3mm 滤纸-海绵-阴极,排除气泡之后封闭转移装置,146 mA 恒流转膜2.5h;将转好的膜用PBST 洗3 次后,放于封闭液(TBST+5%脱脂奶粉)中,4℃封闭过夜;将封闭好的膜与稀释后的一抗(阳性:Aquaporins,1∶1 000,对照:RbcL,1∶5 000)室温杂交90min后,用TBST 室温洗膜3次,每次10min;将膜与稀释后的二抗(辣根酶标记山羊抗兔IgG,1∶5 000)室温杂交1h 后,用TBST 室温洗膜4 次,每次10min;用TBS洗膜2 次,每次8 min;用DAB显色试剂盒避光处显色20 min,用去离子水洗膜数分钟以终止显色反应,拍照。每次跑2个重复样品,一块胶进行考马斯亮蓝染色,一块胶进行转膜杂交。
2 结果与分析
2.1 盐胁迫下甜菜M14品系膜蛋白质的定量分析
按照GE 公司的2D-Quant试剂盒的步骤进行蛋白质定量分析,根据标准蛋白样品浓度和吸光度绘制蛋白浓度标准曲线,结果见图1。
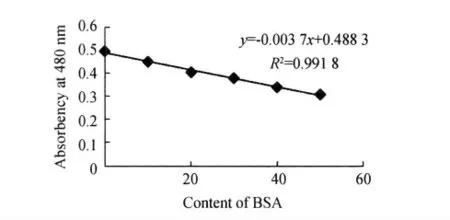
图1 蛋白质标准曲线Fig.1 Standard curve of protein
根据标准曲线和待测蛋白样品的OD 值,可得出甜菜M14 品系对照组叶片蛋白浓度分别为1.036、0.595、0.798μg/μL,甜菜M14品系200 mMol/L NaCl处理叶片蛋白浓度分别为2.293 6、1.659 6、1.729 8μg/μL,400mMol/L NaCl处理叶片蛋白浓度分别为1.155 3、1.059 6、1.489 4 μg/μL,处理甜菜M14品系对照组根蛋白浓度分别为0.761 4、0.715 9、0.545 5 μg/μL,甜 菜M14品系200mMol/L NaCl盐处理根蛋白浓度分别为1.056 8、1、1.171 2μg/μL。400 mMol/L NaCl处理根蛋白浓度分别为0.956 4、0.568 2、0.853 8μg/μL。
2.2 盐胁迫下甜菜M14品系膜蛋白质的Western Blot检验
以甜菜M14品系叶片可溶性蛋白为对照,将不同盐浓度处理甜菜M14品系膜蛋白等量上样进行Western Blot杂交,Aquaporins抗体为质膜水通道蛋白,为膜蛋白阳性抗体;RbcL 抗体为Rubisco大亚基,为叶片中含量最多的可溶性蛋白,因此可以作为膜蛋白提取纯度的检验。叶片及根膜蛋白SDS-PAGE 凝胶考马斯亮蓝染色图谱见图2,Western Blot鉴定结果见图3。
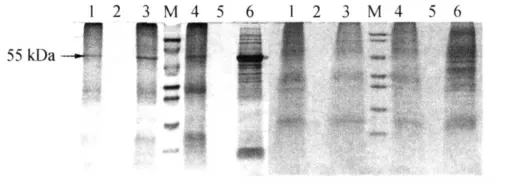
图2 蛋白质SDS-PAGE考马斯亮蓝染色凝胶图谱Fig.2 Coomassie Brilliant blue gel map of protein SDS-PAGE
由图2和图3 可见,RbcL 理论分子量为55kDa,在SDS-PAGE考马斯亮蓝染色凝胶图谱中及Western Blot印迹结果中均能看到此条带,说明叶片可溶性蛋白与膜蛋白提取物中均存在Rubisco大亚基蛋白,且可溶性蛋白中此蛋白含量最高,在提取膜蛋白过程中,通过用碳酸钠反复匀浆可减少膜蛋白中可溶性蛋白的含量,但是要将可溶性蛋白完全除去,目前还比较困难。Aquaporins为水通道蛋白,分为很多种,有PIP1;1,PIP1;2,PIP1;3,其理论分子量为28kDa,由叶片和根的膜蛋白的Western Blot鉴定结果可见,可溶性蛋白都没有得到杂交条带,主要是因为可溶性蛋白中并没有大量富集膜蛋白,膜蛋白含量极少,不能被检测到;而不同盐浓度处理的甜菜M14品系叶片和根的膜蛋白均出现阳性杂交结果,说明提取的膜蛋白浓度较高。根中不存在叶绿体,因此没有Rubisco大亚基蛋白,不能进行此蛋白的Western Blot检验。
总之,甜菜M14品系叶片及根的膜蛋白提取较为成功,膜蛋白浓度较高,但是纯度不能达到100%,存在可溶性蛋白污染,可进行同位素标记相对和绝对定量(iTRAQ)技术研究。

图3 膜蛋白Western Blot鉴定Fig.3 Western Blotting of membrane protein
3 讨论
3.1 甜菜M14品系膜蛋白的分离
由于膜蛋白的疏水性以及在植物组织中的含量相对较少,提取有着很大的困难,本试验采取超速离心的方法提取甜菜M14品系膜蛋白,获得的为微粒体膜蛋白,其中包含质膜及各个细胞器(主要为叶绿体、线粒体、液泡)的膜蛋白,提取膜蛋白所用匀浆液中加入聚乙烯比咯烷酮,可有效去除酚类物质;而PMSF 是一种蛋白酶抑制剂,可防止蛋白质降解。
3.2 甜菜M14品系膜蛋白的Western Blot检验
Western Blot是目前检验膜蛋白的比较可行的办法,本试验所用Aquaporins抗体来源于萝卜,RbcL抗体来源于拟南芥,均非来源于本试验材料甜菜,说明异源抗体也能起到相应作用。其中Aquaporins抗体Western Blot鉴定结果发现分子量较小的部位也有杂交结果,可能是由于本试验提取的为微粒体膜蛋白包含多种类似的水通道蛋白,因此均能与抗体结合出现阳性结果。
[1]刘 春,曹丽敏,李玉中,等.利用转基因途径提高植物非生物胁迫耐受性的研究进展[J].生物技术通报,2013,(1):16-24.
[2]刘晓颖,陈丽媛,张竞秋,等.白菜脱水应答转录因子BpDREB1基因的克隆及功能研究[J].作物学报,2013,39(2):230-237.
[3]Tuteja N.Mechanisms of high salinity tolerance in plants[J].Methods in Enzymology,2007,428:419-438.
[4]付 畅,孙玉刚,傅桂荣.盐生植物耐盐分子机制的研究进展[J].生物技术通报,2013,(1):1-7.
[5]Malakshah S N,Rezaei M H,Heidari M,et al.Proteomics reveals new salt responsive proteins associated with rice plasma membrane[J].Biotechnology and Biochemistry,2007,71:2 144-2 154.
[6]陈 捷.农业生物蛋白质组学[M].北京:科学出版社,2009:340-341.
[7]李永春,张春艳,张 宁,等.小麦质膜蛋白基因TaPM19-1的克隆及其对非生物胁迫的响应[J].中国农业科学,2012,45(12):2 502-2 509.
[8]庞秋颖.盐胁迫盐芥和拟南芥的芥子油苷和蛋白质组比较[D].哈尔滨:东北林业大学,2010.
[9]Ma C Q,Wang Y G,Wang Y T,et al.Identification of a sugar beetBvM14-MADSbox gene through differential gene expression analysis of monosomic addition line M14[J].Journal of Plant Physiology,2011,168(16):1 980-1 986.
[10]Yang L,Ma C Q,Wang L L,et al.Salt stress induced proteome and transcriptome changes in sugar beet monosomic addition line M14[J].Journal of plant physiology,2012,169(9):839-850.
[11]郭德栋,康传红,刘丽萍,等.异源三倍体甜菜(VVC)无融合生殖的研究[J].中国农业科学,1999,32(4):1-5.
[12]Haiying Li,Lin Ji,Chunquan Ma,et al.Molecular cloning and characterization of a rat sarcoma-like protein from brain(Rab)gene in sugar beet monosomic additional line M14[J].Australin Journal of Crop Science,2013,7(3):374-380.
[13]Wakeela A,Asif A R,Pitanna B,et al.Proteome analysis of sugar beet(BetavulgarisL.)elucidates constitutive adaptation during the first phase of salt stress[J].Journal of Plant Physiology,2011,68:519-526.
[14]Pang Q Y,Chen S X,Dai S J,et al.Comparative proteomics of salt tolerance in Arabidopsis thaliana and Thellungiella halophila[J].Journal of Proteome Research,2010,9:2 584-2 599.
