黄芪对喉癌细胞增殖和凋亡的影响
2013-10-16刘秀萍白伟良季文樾
宋 岩,刘秀萍,白伟良,季文樾
随着分子生物学、细胞生物学、肿瘤学等相关生命学科的迅猛发展,喉癌的化疗药物研究也进入了一个新阶段[1]。近年来国内外研究表明,清热类中药黄芪可通过调节花生四烯酸系统的代谢,诱导肿瘤细胞周期停滞及细胞凋亡,抑制肿瘤新生血管生成,抗肿瘤侵袭和转移,增强肿瘤细胞对化疗药物的敏感性等发挥其抗肿瘤作用[2]。文献报道其在膀胱癌、胃癌治疗方面作用显著,但在喉癌治疗中的研究甚少,本文就黄芪对喉癌细胞增殖和凋亡的影响进行了研究,现报道如下。
1 材料和方法
1.1 实验材料 细胞株:喉鳞状细胞癌Hep-2细胞株购自中国科学院细胞库。试剂:黄芪注射液购自正大青春宝集团;Annexin V凋亡检测试剂盒购自凯基公司;MTT、碘化丙啶(Proidum iodide,PI)、二甲基亚枫(DimethyI sulfoxide,DMSO)等购自北京鼎国生物公司;TMPI-1640培养液购于美国Gibco公司;RnaseA购于碧云天;标准胎牛血清购自杭州四季青公司;青链霉素、磷酸盐缓冲溶液(Phophate buffered saline,PBS)购自上海生工生物有限公司。
1.2 实验方法
1.2.1 细胞培养 喉鳞状细胞癌Hep-2细胞用含10%胎牛血清的 RPMI-1640培养基培养,加100 U/mL青霉素,100 U/mL链霉素37℃,5%CO2饱和湿度培养,48 h传一代,取对数生长期用于实验。
1.2.2 MTT比色法检测细胞增殖抑制率 取对数生长期Hep-2细胞,常规胰酶消化,调节细胞浓度为1×105个/L,接种于96孔板,贴壁24 h后,换成含有不同浓度黄芪(20、100、200 μg/mL)的培养液,每组3个复孔,作用24 h后,加入MTT,继续培养4 h后弃上清,每孔加入DMSO 150 μL,震荡10 min,待紫色结晶完全溶解后,用酶标试仪测定490 nm处吸光度(A)值绘制生长曲线,观察药物抑制细胞生长情况。细胞增殖抑制率=(1-加药孔细胞A值/对照孔细胞A值)×100%。
1.2.3 流式细胞术检测细胞凋亡率 将适当浓度的对数生长期Hep-2细胞接种于100 mL培养瓶中,培养24 h,吸出培养基,加入含有不同浓度黄芪(20、100、200 μg/mL)的培养液,分别作用24 h,收集 1×106个细胞,1 000 r/min离心10 min,PBS洗1次,4℃、75%冰乙醇固定24 h,PBS洗3次,上机前加入PI冰浴避光放置1 h,调整细胞浓度到1×106个/L,上流式细胞仪检测细胞凋亡率,如此重复3次。
1.2.4 细胞形态学观察 取对数生长期细胞,每瓶4×105接种于25 mL培养瓶中,置37℃、5%CO2及饱和湿度的条件下培养过夜,待细胞贴壁后,按“1.2.3”项方法分组处理各组细胞,继续孵育培养24 h后,应用光学倒置显微镜观察细胞生长形态,并随机拍照。
1.2.5 Hoechst 33258染色观察细胞核形态变化将预处理过的盖玻片置于6孔板内,Hep-2细胞密度调整为5×105/mL,各取1 mL种入6孔板培养过夜,使细胞长至60%~80%。给药组加入200 μg/mL的黄芪培养液培养24 h,吸尽培养液,加入固定液0.5 mL固定15 min,PBS洗2次,加1 mL Hoechst 33258荧光染液,避光10 min,封片后荧光显微镜观察,照相,见图1。

图1 Hoechst 33258荧光染色法观察黄芪作用前后细胞形态学变化
1.3 统计学分析 采用Excel统计数据,SPSS 12.0统计软件分析。数据用表示,两组之间比较采用t检验,多组间比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 MTT检测黄芪对Hep-2细胞生长的抑制作用 通过绘制细胞生长曲线发现,黄芪可抑制Hep-2细胞生长,并且随着药物浓度增加其生长抑制率也增加,两者存在浓度相关性。见表1。
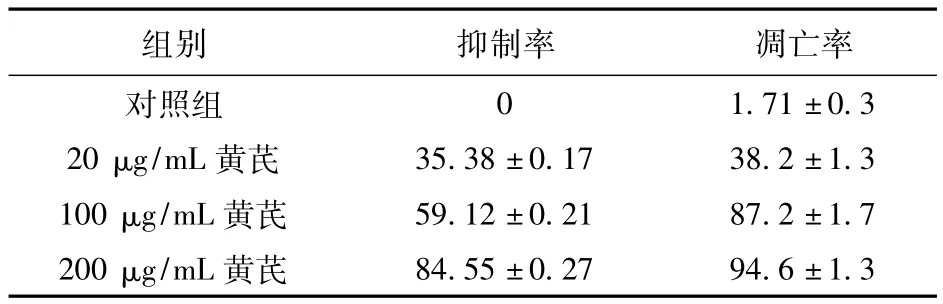
表1 不同浓度黄芪作用24 h后抑制率、凋亡率比较(%)
2.2 黄芪对喉癌Hep-2细胞凋亡的影响 流式细胞仪检测发现,黄芪具有诱导喉癌Hep-2细胞凋亡的作用,细胞凋亡发生率随黄芪浓度增加而明显增加。结果见表2。
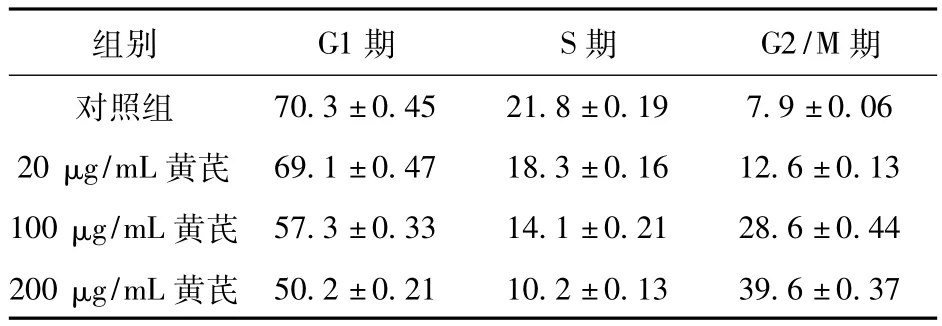
表2 不同浓度黄芪作用24 h后细胞各周期分布(%)
2.3 光镜观察 由倒置相差显微镜可以观察到,与未经处理的对照组相比,干预组都有不同程度的形态改变,见图2。
2.4 Hoechst 33258染色荧光显微镜观察 200 μg/mL黄芪作用于Hep-2细胞24 h后,细胞发生显著性形态学改变,出现大量染色质边聚,细胞核固缩,甚至可见核碎裂、核溶解特征性表现。凋亡的细胞随着黄芪浓度的增加明显增多,最后大片细胞脱落,可观察到细胞脱失区,结果见图2。
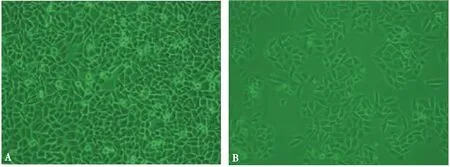
图2 光镜下观察黄芪作用前后Hep-2细胞形态学变化
3 讨论
喉癌是常见的头颈部恶性肿瘤,在中国东北发病率较高,近年来发病率在世界范围内也呈上升趋势。目前,在放化疗和外科手术联合治疗的情况下,Tis、T1及T2期喉癌治疗有效率为80%~90%,而T3、T4期喉癌只有40%~50%。尽管外科手术和放化疗技术有了明显进步,但患者的5年生存率仍没有提高,原因是多方面的,其中对发病机制研究不够完善、没有明确的治疗靶点是最关键的原因。
本研究表明,黄芪具有诱导肿瘤细胞凋亡的作用。MTT检测结果表明,黄芪可抑制Hep-2细胞,且随着药物浓度增加其生长抑制率也增加,两者存在浓度依赖关系。浓度为20、100、200 μg/mL时,抑瘤率分别为35.38% ±0.17%、59.12% ±0.21%、84.55% ±0.27%,与对照组比较差异有统计学意义(P<0.01)。抑制率随浓度增加而逐渐上升,到 200 μg/mL时,其抑制率达84.55% ±0.27%,抑瘤作用显著,由此推断黄芪可以在体内外发挥对喉癌的抑制作用。笔者用流式细胞仪检测不同浓度黄芪作用Hep-2细胞后引起的细胞凋亡率的变化,发现20 μg/mL时凋亡率为38.2% ±1.3%,100 μg/mL时凋亡率为 87.2% ±1.7%,200 μg/mL浓度时凋亡率为94.6% ±1.3%,与对照组相比,差异有统计学意义,并呈现明显的剂量依赖性,说明黄芪可有效促进喉癌Hep-2细胞凋亡。
笔者采用光镜与免疫荧光染色对给药前后喉癌Hep-2细胞进行微观对比,发现光镜下黄芪作用细胞24 h后,随着黄芪浓度的增加,细胞变圆,不规则,细胞数目明显减少,细胞间隙变大;荧光染色下,细胞出现核碎裂,核仁消失,染色质固缩,可见凋亡细胞,严重时成片细胞脱落。对照组喉癌Hep-2细胞生长良好,细胞形态圆,胞膜表面光滑,无凋亡发生。
黄芪为多年生草本植物,主要成分为黄酮,如黄芪素。研究发现,黄芪素可下调bcl-2表达,上调Bax表达,通过细胞色素C-线粒体-Caspase-3途径诱导乳腺癌细胞凋亡[3]。Roy等[4]发现,小剂量黄芪素(10或20 mol/L)使人白血病HL-60细胞大量停滞于S或G2/M期,而大剂量黄芪素则诱导细胞凋亡。黄芪具有诱导多种肿瘤细胞凋亡、影响细胞周期、抑制肿瘤侵袭转移等特点,但其抗肿瘤机制复杂多样,尚未完全明确[5]。笔者用不同浓度的黄芪进行体外抑癌实验,应用不同方式检测不同浓度黄芪对喉鳞状细胞癌Hep-2细胞的促凋亡作用,发现黄芪体外作用人喉癌Hep-2细胞后,可抑制肿瘤细胞生长,促进其凋亡以达到抗癌作用,但具体机制有待进一步研究。
[1]Tsai YS,Lee KW,Huang JL,et al.Arecoline,a major alkaloid of areca nut,inhibits p53,represses DNA repair,and triggers DNA damage response in human epithelial cells[J].Toxicology,2008,249(2-3):230-237.
[2]毛捷,徐善水,盛莉莉,等.黄芪素的抗肿瘤作用及机制的研究进展[J].中国临床药理学与治疗学,2009,14(10):1178-1182.
[3]Lee JH,Li YC,Ip SW,et al.The role of Ca2+in baicalein induced apoptosis in human breast MDA-MB-231 cancer cells through mitochondria and caspase-3-dependent pathway[J].Anticancer Res,2007,27(1A):117-125.
[4]Roy MK,Nakahara K,Na TV,et al.Baicalein,a flavonoid extracted from a methanolic extract of Oroxylum indicum inhibits proliferation of a cancer cell line in vitro via induction of apoptosis[J].Pharmazie,2007,62(2):149-153.
[5]王晓瑜,龙汉安.黄芪及黄酮类成分防治肿瘤作用的研究进展[J].华西医学,2011,26(2):297-300.
