拉曼光谱对血红蛋白浓度的定量分析
2013-10-16吴正洁林正春
吴正洁, 王 成, 林正春
(1.北京理工大学珠海学院化工与材料学院,广东珠海519088;2.仲恺农业工程学院计算机科学与工程学院,广东广州510225;3.佛山市技术标准研究院,广东佛山528000)
拉曼光谱是研究化合物分子受光照射后所产生的拉曼散射信号,能提供分子中原子振动的信息,具有制样简单、分析快速、无损、水干扰小,以及所检测的样品仅需微量即可满足测量要求等诸多优点[1].到目前为止,激光拉曼光谱分析技术多用于样品的定性分析[2-4],仍较少应用于定量分析上[5-7],已有的定量分析的研究也都存在分析精确度不高的问题[8-9].我们曾提出以拉曼光谱中的谱强最高点作为归一化参照的定量分析方法,并利用该方法对甲醇、乙醇进行定量分析,其相对误差率分别为4.7%和3.5%,具有较高的定量分析精度[10-11].本实验将进一步拓展拉曼光谱定量分析的应用范围,将其用于生物样品-血红蛋白的定量分析上,探讨拉曼光谱定量分析在生物医学检测上的适用性,并将对检测分析过程的定量标准化进行讨论.
1 材料与方法
1.1 人红细胞的无菌分离
无菌抽取健康成人的静脉血,肝素锂抗凝,即刻以1 500 r/min速度离心10 min,去除上层血浆和脂质体,加入3倍以上体积的细胞缓冲液,1 500 r/min的速度离心5 min,去除上清液.如此重复洗涤红细胞3次,再将红细胞重悬于缓冲液中.
1.2 血红蛋白的提取
通过洗涤前面提取的正常人红细胞、低渗使红细胞破裂释放血红蛋白、高速离心去除脂质体、凝胶过滤层析等操作收集到血红蛋白溶液.
将提取到的血红蛋白,用PBS缓冲液配置成5个浓度梯度:1.489 5、1.821 3、2.808 8、2.978 8、3.448 4 mmol/L(heme).
血红蛋白浓度的测量采用氰化高铁血红蛋白法,该方法是国际血液学标准化委员会及世界卫生组织认可的测量血红蛋白浓度的标准方法.血红蛋白的浓度统一用血红素的摩尔浓度表示.
1.3 检验样品的制备
为了检验血红蛋白浓度定量分析的相对误差,实验配置离体血红蛋白检验样的浓度分别为:1.845 3、2.598 4、1.889 8、2.444 6、3.081 6 mmol/L.
1.4 仪器和测量条件
显微共焦激光拉曼光谱仪为JY LabRam INV,实验测定条件设置为60倍物镜、200 μm共焦孔径.照射的激光功率选择1.5 mW,以保证激光不会对蛋白产生光致损伤[12].测量波谱范围:600~1 800 cm-1;波数分辨率为1~2 cm-1;信号采集的曝光时间5 s.对仪器波数及激光功率的校准均采用标准硅片进行.
1.5 实验方法
将血红蛋白置于玻片上,采集拉曼谱.血红蛋白样品每个样品测量5次,对各个拉曼谱进行去噪、去背景、基线校准后,取其平均谱.
实验选取每组该物质最高浓度下拉曼谱中谱强最高点作为此组所有数据归一化的参照,对血红蛋白的拉曼谱进行归一化处理[10-11].
选取血红蛋白的 4 个特征谱峰[13-15],1 356、1 471、1 546、1 608 cm-1,分别对这 4 个特征峰的峰强与血红蛋白浓度作线性回归分析,获得各自的线性回归方程.对比分析中采用各线性回归方程的相关系数R和决定系数R2值,以及检验样在各线性回归方程下的平均相对误差评价各回归方程的优劣.从实验结果分析,拉曼特征峰的峰强与血红蛋白浓度在1.45~3.5 mmol/L有很好的线性相关,按3倍标准偏差时的检出限为0.461%.
2 结果与分析
波数轴的校准采用标准硅片进行,即每次测量样品之前,将硅片特征峰校准至520.7 cm-1,如图1所示.

图1 校准前后标准硅片的特征峰图Fig.1 Calibration of wave number from 519.6 cm-1to 520.7 cm-1by the silicon
仪器激光功率的稳定性通过检测标准样品(如标准硅片)的特征峰强度来衡量判断.通过测量单位时间内标准硅片特征峰强度的变化曲线能更直观地反映出拉曼光谱定量分析的准确性.
图2示出标准硅片的特征峰强度随时间的变化值,从图中可见,在1 h内,标准硅片的特征峰强度在116.38±1.19波动,变异系数CV为1.02%,数据波动范围小,激光功率稳定性优,适用于对检测样品进行拉曼光谱定量分析.

图2 0~1 h内测出的标准硅片的特征峰(520.7 cm-1)强度变化曲线Fig.2 The intensity of silicon Raman band at 520.7 cm -1(S)as function of time
拉曼仪经波束轴和激光功率的校准之后,可直接用于血红蛋白样品的检测.血红蛋白的拉曼原始谱图经去噪、去背景、基线校准之后得到拉曼处理谱图,再经前述归一化方法处理后,得到血红蛋白的拉曼结果谱图,如图3所示,血红蛋白浓度从下到上分别为 1.489 5、1.821 3、2.808 8 mmol/L(heme).该谱图中谱峰的相关数据,如谱峰强度等可直接用做定量分析.
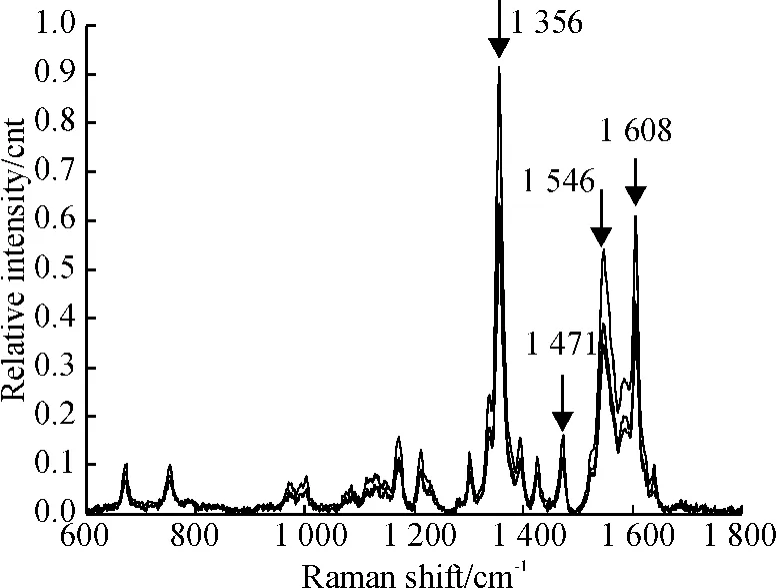
图3 经去噪、去背景、基线校准、归一化处理后的血红蛋白拉曼谱图Fig.3 Raman spectra of hemoglobin obtained by denoising,removing the background,normalization and baseline correction
实验选取血红蛋白的4个特征谱峰,1 356、1 471、1 546、1 608 cm-1,获得谱强与血红蛋白浓度的线性回归方程,如表1所示.从所建立的线性回归方程的相关系数R和决定系数R2值上看,1 546 cm-1处的线性相关最优.
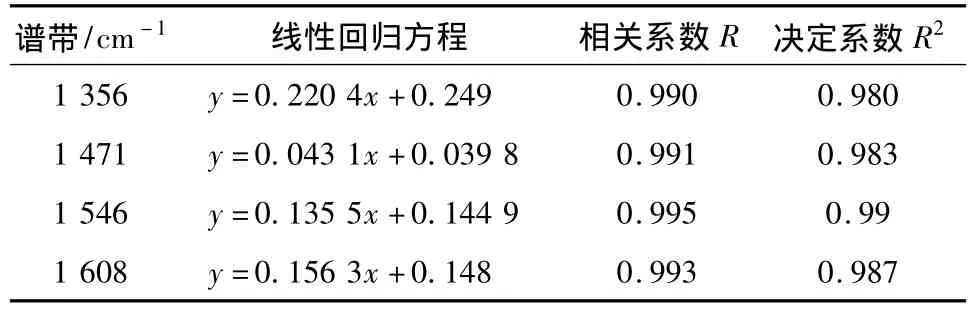
表1 谱峰与浓度间的线性回归方程及其线性相关Table 1 Results of the function relation and the linear correlation between intensity of Raman bands and hemoglobin concentration
利用上述4个谱带所获取的线性回归方程,对不同浓度的血红蛋白样品进行检验分析,各个检验样定量分析结果的相对误差如表2所示.
从表2中可以看出,利用上述4个谱带建立的线性回归方程计算出的检验样品的相对误差率,除1 471 cm-1谱带的相对误差波动较大外,其他3个谱带的相对误差波动较小,且平均相对误差率均在0.058 7 ~0.094 3.说明利用 1 356、1 546、1 608 cm-1谱峰做血红蛋白浓度的定量分析都是可行的,分析结果的精确率较高.

表2 离体血红蛋白检验样的平均相对误差Table 2 The average relative error of tested hemoglobin
将1 356、1 471、1 546、1 608 cm-14 个谱峰分别应用于定量分析后出现的不同结果可能与其本身谱线的归属性质有关,其归属类型如表3所示.1 356 cm-1归属于去氧血红蛋白的特征谱线,隶属ν4,是吡咯半环对称振动.该谱带在514 nm激发光下处于明显的共振模式,是血红蛋白所有特征谱线中信号最强,最不易受噪声干扰的谱带,稳定性高.但该谱带对卟啉环上π-π*的跃迁非常敏感,对血红素的氧合状态也非常敏感,被称为其氧化标记带[13-14].血红蛋白与氧结合后,该谱带移至1 371 cm-1处.故选择ν4谱线做定量分析时,只要确保血红蛋白完全处于去氧态或氧合态(处于氧合态时,可利用1 371 cm-1谱线做定量分析),不存在既有氧合态又有去氧态的情况,便可利用本实验提出的归一化方法快速、准确地对血红蛋白浓度进行测定分析.而判定血红蛋白是否完全处于去氧态或氧合态,则仅需观察血红蛋白拉曼谱是否只出现1 356 cm-1谱带或只出现1 371 cm-1谱带.若两者同时出现,则说明血红蛋白处于氧合态-去氧态的转换过程中,此时采集的谱线,利用本实验采用的归一化方法做定量分析的准确度会受到影响,相对误差高.一般而言,不建议采用去氧态和氧合态共存的血红蛋白拉曼谱线做定量分析,若采集到的拉曼谱中两种谱线都存在,则建议选择两个谱带间谱区域的强度和做比值参照,这样对改善该谱线定量分析结果的精确度会有所帮助.
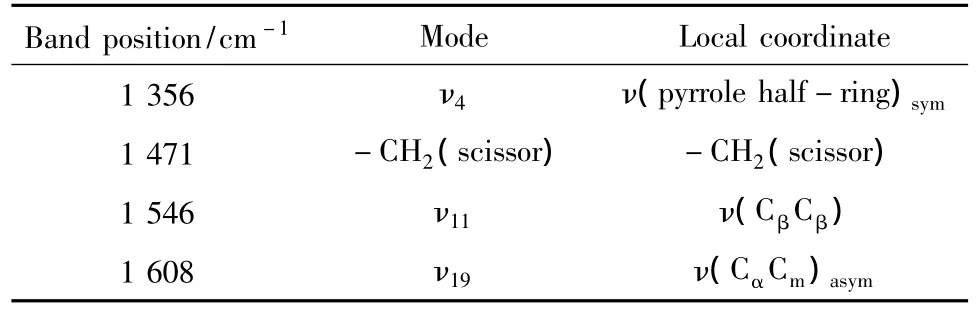
表3 特征谱线的归属[13-15]Table 3 The assignment of Raman bands for hemoglobin
1 546、1 608 cm-1谱带分别归属于 ν(CβCβ)振动模式和ν(CαCm)不对称振动模式,当使用这两个谱带做定量分析时,同样受到血红蛋白所处分子构象(氧合态和去氧态)的影响.1 608 cm-1谱带属于去氧血红蛋白的特征谱线,当血红蛋白结合氧后,该谱带消失,产生位于1 638 cm-1属于υ10模式的谱线.血红蛋白结合了少量的氧,但还没有转变到氧合态时,1 608 cm-1谱带出现了强度降低,而1 638 cm-1强度升高.这时采用任一个谱带做定量分析都是不准确的.所以,同1 356 cm-1谱带一样,只能采用血红蛋白完全处于去氧态或氧合态时的拉曼谱图做定量分析.选用1 546 cm-1谱带做定量分析的前提条件与 1 356、1 638 cm-1相同.
1 471 cm-1谱带表征-CH2的振动模式,对血红素的氧合状态不敏感.选择该谱带作为代表,目的是讨论采用对血红蛋白变化不敏感的特征谱带做血红蛋白浓度定量分析的可行性.从表2的结果上看,该谱带用于定量分析时,虽然有部分检验样得出的相对误差较小,准确性较高,但是不同检验样检测结果的准确率不稳定,波动较大,相对误差在0.038 3~0.376 0变动,说明采用该谱带做定量分析,定量结果的随机性较高,结果的准确性难以保证,该方案可行性不高.
综上所述,对血红蛋白采用本实验发展的归一化方法进行拉曼光谱定量分析,在判定血红蛋白完全处于去氧态或氧合态后,选取ν4谱带如去氧合态的1 356 cm-1谱带做定量分析的相对误差最小,仅为0.058 7.
3 结论
本实验结合归一化方法,利用优化的定量分析技术,对血红蛋白的浓度进行定量分析,分析结果表明,利用该方法可以对离体血红蛋白进行无损、简单、快速、精确的定量分析.开创了拉曼光谱定量分析在生物样品上的应用,拓展了拉曼光谱的应用领域.特别是,实现了对生物样品的无创性定量检测,有力地推动发展了生物样品的无损测量技术.
[1]CAREY P R.Biochemical Applications of Raman and resonance Raman spectroscopies[M].New York:Academic,1982.
[2]LYON L A,KEATING C D,FOX A P,et al.Raman spectroscopy[J].Analytical Chemistry,1998,70:341 -361.
[3]HUANG Yao-xiong,WU Zheng-jie,JITENDRA Mehrishi,et al.Human red blood cell aging:correlative changes in surface charge and cell properties[J].J Cell Mol Med,2011,15(12):2634-2642.
[4]王 朋,陈文新,刘应亮,等.稀土离子掺杂对于TiO2结构和光催化性能的影响[J].暨南大学学报:自然科学版,2003,24(5):81 -87.
[5]SHAVER J M,CHRISTENSEN K A,PEZZUTI J A,et al.Structure of dihydrogen phosphate ion aggregates by Raman-monitored serial dilution[J].Appl Spectrosc,1998,52(2):259-264.
[6]JESTEL N L,SHAVER J M,MORRIS M D.Hyperspectral raman line imaging of an aluminosilicate glass[J].Appl Spectrosc,1998,52(1):64-69.
[7]ANDREW J J,HANCEWICZ T M.Rapid analysis of raman image data using two-way multivariate curve resolution[J].Appl Spectrosc,1998,52(6):797 -807.
[8]刘文涵,杨 未,吴小琼,等.激光拉曼光谱内标法直接测定乙醇浓度[J].分析化学,2007,35(3):416-418.
[9]张洪波,宿德志,何焰蓝.用傅立叶变换拉曼光谱法测定乙醇浓度[J].分析测试技术与仪器,2007,13(3):190-193.
[10]吴正洁,黄耀熊,王 成,等.多种拉曼光谱归一化法对乙醇定量分析的研究[J].光谱学与光谱分析,2010,30(4):971 -974.
[11]吴正洁,黄耀熊,王 成,等.对强荧光背景拉曼光谱定量分析的研究[J].光谱学与光谱分析,2010,30(7):1798-1801.
[12]康立丽.单个活态细胞的显微激光拉曼光谱扫描技术及应用研究[D].广州:暨南大学,2007.
[13]WOOD B R,CASPERS P,PUPPELS G J,et al.Resonance Raman spectroscopy of red blood cells using nearinfrared laser excitation[J].Analytical and Bioanalytical Chemistry,2007,387(5):1691 -1703.
[14]WOOD B R,HAMMER L,DAVIS L,et al.Raman microspectroscopy and imaging provides insights into heme aggregation and denaturation within human erythrocytes[J].Journal of Biomedical Optics,2005,10(1):14005.
[15]KANG L L,HUANG Y X,LIU W J,et al.Confocal Raman microscopy on single living young and old erythrocytes[J].Biopolymers,2008,89:951 -959.
