Ca2+、Mg2+及盐度对凡纳滨对虾体内代谢酶的影响
2013-10-13张立田戴习林臧维玲
张立田, 戴习林, 臧维玲
( 1. 上海海洋大学 水产与生命学院, 上海201306; 2. 东海水产研究所, 上海200090)
凡纳滨对虾(Litopenaeus vannamei)俗称南美白对虾, 为当今世界养殖产量最高的虾类品种, 其自然分布区主要在东太平洋[1]。凡纳滨对虾盐度适应范围广, 在海水和淡水水域中均能生长, 但与海水养殖相比, 在淡水中生长速度较慢, 抗病能力较差, 这与海水和淡水中离子成分及含量有关[2-5]。海水中常量离子成分和含量都比较稳定[6], 淡水离子种类及含量与海水有一定差异, 其中与对虾蜕壳和生长有紧密联系的必需离子 Ca2+、Mg2+在淡水中的含量甚低, 世界河水中 Ca2+、Mg2+含量的平均值仅分别为20.4 mg/L与3.4 mg/L[7], 远低于海水。因此, 低盐、低钙及低镁水体中凡纳滨对虾的生长力和抗病力就成了学者和养殖业者关注的内容。
凡纳滨对虾生长力受多方面的影响, 其中与食物消化吸收有关的消化酶及与蜕壳紧密相关的Na+-K+三磷酸腺苷酶(Na+-K+-ATP酶)、Ca2+三磷酸腺苷酶(Ca2+-ATP酶)、Mg2+三磷酸腺苷酶(Mg2+-ATP酶)对其生长力有很大影响[8-10]; 凡纳滨对虾抗病力与其体内免疫机制有关, 凡纳滨对虾体内存在着可以诱导的非特异性免疫防御系统, 超过氧化物歧化酶(SOD)、酸性磷酸酶(ACP)和碱性磷酸酶(AKP)等是体液防御系统中的重要免疫因子[11]; 关于 Ca2+、Mg2+及盐度对凡纳滨对虾生长力与免疫力方面的研究已有一些报道, 刘存歧、沈丽琼等[3,5,10]对Ca2+, Mg2+或盐度对凡纳滨对虾免疫类酶影响有过研究, 但这些研究均甚少涉及Ca2+、Mg2+、盐度三因素在剔除两因素效应下对凡纳滨对虾体内代谢酶的影响以及三者之间的交互作用。本试验主要根据中国内陆不同养殖水体的水质类型, 采用正交试验探讨 Ca2+、Mg2+、盐度对凡纳滨对虾体内代谢酶的相对独立作用和相互影响, 进而为提高凡纳滨对虾生长力和免疫力提供理论依据。
1 材料与方法
1.1 试验用虾及养殖试验池
试验用虾购自厦门海水淡化苗(盐度=2), 平均体长=(0.800±0.028)cm, 平均体质量=(0.002±0.001)g,暂养于100 L塑料箱备用。试验池为上海市金山区申漕特种水产开发公司玻璃温室内的水泥育苗池(3.50 m×7.15 m)。
1.2 试验基础用水与药品
试验基础用水为经沉淀过滤、杀菌消毒的养殖场邻近三洪河河水, 盐度0.3, Ca2+为50 mg/L, Mg2+为20 mg/L。调配试验用水的化学药品分别为工业纯:NaCl(日晒盐)、CaCl2·2H2O、MgCl2·6H2O、KCl、NaBr、H3BO3、Na2SO4。
1.3 试验设计
依据中国内陆不同地区地表水水质类型[7]及预试验结果, 选择 L49(78)正交表安排 Ca2+、Mg2+、盐度3因素7水平试验, 研究3者对凡纳滨对虾体内代谢酶的相对独立影响, 分析 3个因子对凡纳滨对虾代谢酶影响趋势; 选择 L8(27)正交表安排 Ca2+、Mg2+、盐度3因素2水平试验, 考察3者之间的交互作用, 各试验组均设1个平行组, 两正交表中各因素水平分别列于表1和表2。

表1 L49(78)中Ca2+、Mg2+、盐度水平Tab.1 Ca2+, Mg2+ and salinity levels in L49(78)

表2 L8(27)中Ca2+、Mg2+、盐度水平Tab.2 Ca2+, Mg2+ and salinity levels in L8(27)
1.4 试验方法
1.4.1 试验用水调配
除L49(78)中Ca2+、Mg2+水平为1试验组的基准水为经氢氧化钠处理降低钙镁含量, 并调节pH后的河水, 其他试验组均以河水作为调配基准水。按试验设计要求先调节Ca2+、Mg2+水平, 再以盐度为35自然海水作为参照, 依据臧维玲[12]罗氏沼虾(Macrobrachium rosenbergii)育苗用水调配原则, 按照设定盐度比例分别添加其他离子(K+、Br-、H3BO3、SO42-),最后以 NaCl(日晒盐)调节各试验组盐度水平, 水深50 cm, 经充分曝气一周后用于试验。
1.4.2 试验用虾驯化与放养
各试验组受试虾苗约1 000尾分别在100 L塑料箱中驯养, 每日早晚分别用各自调配水换水[13]驯化, 同时每日早中晚各投虾片1次, 并及时排出残饵污物。10 d后驯化完毕, 将各组驯化苗完全随机人工逐尾计数500尾置于试验池中, 平均体长 =(0.920±0.028)cm, 平均体质量 =(0.003±0.001)g。
1.4.3 日常管理
试验期间每天定时投喂配合饲料, 早期每日 4次,后期每日 3次, 连续散气石充气增氧, 定期排污, 不换水, 每隔 15 d测量盐度及 Ca2+、Mg2+含量, 及时补充因蒸发所失基础水, 试验期间各水体中 TAN≤0.1 mg/L,NO-2-N≤0.005 mg/L, 水温 30.6±1.4℃。60 d后准确计数各池存活虾数, 并分别准确测量体长与体质量。
1.5 试验指标的测定
水体中 Ca2+、Mg2+含量测定采用络合滴定法进行滴定[5], 盐度采用德国 WTW 多参数水质分析仪Multi 340i测量。
成活率=试验结束时对虾尾数/试验开始时放养尾数
体长日均增长=(试验结束时虾体均长-试验开始时虾体均长)/养殖天数
日均增质量=(试验结束时虾体均质量-试验开始时虾体均质量)/养殖天数
1.6 虾体组织酶活测定
蛋白酶活性采用福林-酚法测定[14], 淀粉酶采用3,5-二硝基水杨酸显色法(DNS法)[15], 脂肪酶采用以聚乙烯醇橄榄油为底物的标准氢氧化钠溶液滴定法[16], 酶活测定组织取自凡纳滨对虾肝胰腺。
Na+-K+-ATP酶、Ca2+-ATP酶、Mg2+-ATP酶采用南京建成生物研究所所配试剂盒进行测定, 规定每小时每毫克组织蛋白的组织中ATP酶分解ATP产生1 μmol无机磷的量为一个ATP酶活力单位, 即微摩尔分子磷/毫克蛋白/小时, 即: μmol/(mg·h), 酶活测定组织取自凡纳滨对虾鳃丝。
ACP、AKP、SOD采用南京建成生物研究所所配试剂盒进行测定, ACP、AKP为每克组织蛋白在37℃与基质作用30 min产生1 mg酚为一个活力单位(U),SOD为每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活力单位(U),酶活测定组织取自凡纳滨对虾肝胰腺。
蛋白含量测定采用考马斯亮蓝法进行测定。酶的比活力=酶活力/组织蛋白含量
1.7 数据处理
采用Excel2003和SPSS 17. 0进行数据整理和分析。方差分析处理正交试验数据, Duncan法均值多重比较, 差异显著性设置为P<0.05。
2 结果
2.1 Ca2+、Mg2+、盐度对凡纳滨对虾存活及生长的影响
Ca2+、Mg2+、盐度对凡纳滨对虾存活及生长的影响见表 3。由方差分析知 Ca2+、Mg2+、盐度对凡纳滨对虾成活率均具有显著影响(P<0.05)。由表 3发现, Ca2+在30~300 mg/L时, 成活率呈抛物线趋势, 100 mg/L时出现第一个峰值, 400 mg/L时为第二个峰值, 500 mg/L成活率降至71.0%; Mg2+除150 mg/L外, 成活率基本呈递增之势,1 200 mg/L时成活率最高, 达到79.6%(P<0.05), 100 mg/L时成活率最低, 仅为53.3%; 盐度由0.5上升到10时成活率逐渐升高, 此后随盐度增加逐渐降低。
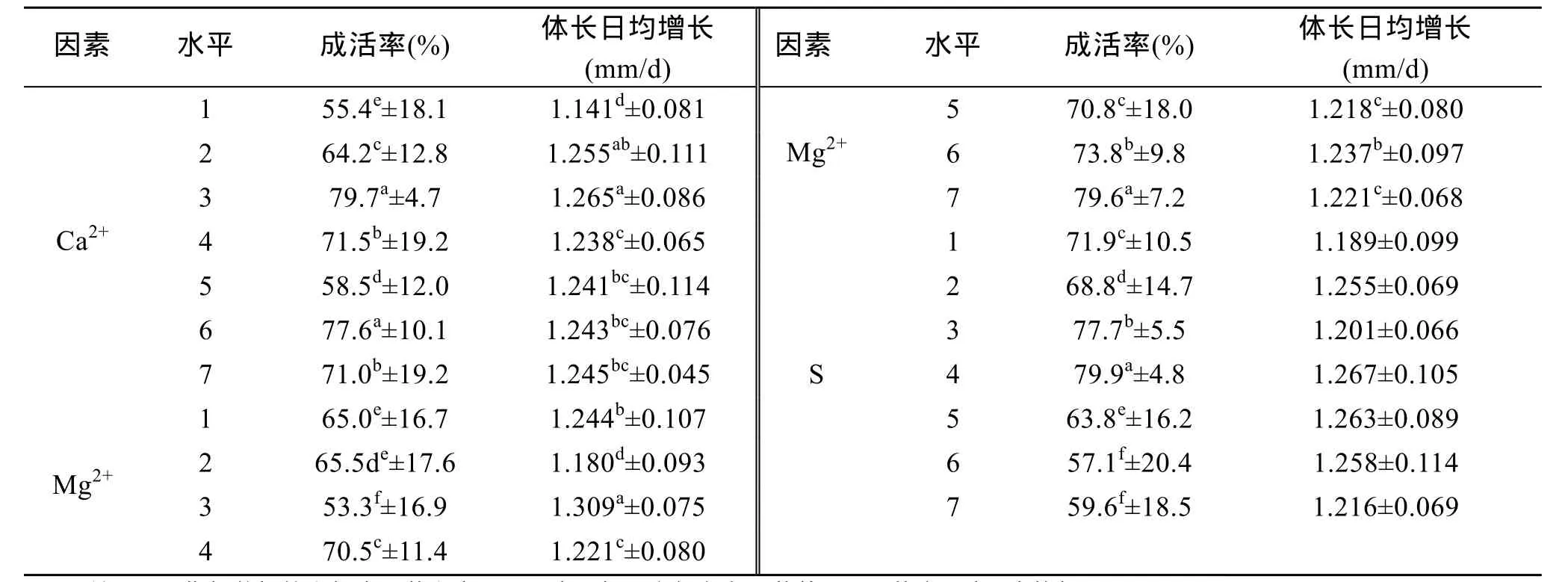
表3 Ca2+、Mg2+、盐度对凡纳滨对虾成活率、体长日均增长的影响Tab.3 Effect of Ca2+, Mg2+ and salinity on survival, growth and flavor amino acids of Litopenaeus vannamei
由方差分析知 Ca2+、Mg2+对凡纳滨对虾体长日均增长具有显著影响(P<0.05)。表 3表明, Ca2+为100mg/L时其体长日均增长最快, 30 mg/L时, 体长日均增长值最小, 显著低于其余 Ca2+水平组; Mg2+为150 mg/L时生长速度最快, 50 mg/L时生长速度最慢,Mg2+≥300mg/L时其生长速度差别不大, 而<300 mg/L时, 各水平组间对虾生长速度变化较大; 对虾生长与盐度的关系呈抛物线状趋势, 生长速度在盐度为10~20时较快。
2.2 Ca2+、Mg2+、盐度对凡纳滨对虾体内消化酶的影响
Ca2+、Mg2+、盐度对凡纳滨对虾体内消化酶的影响见表4。表4表明, Ca2+对类胰蛋白酶影响显著, 盐度对胃蛋白酶、类胰蛋白酶具有显著影响, Mg2+对4种消化酶均没有显著影响。
由表4看出, 对胃蛋白酶的影响Ca2+为200 mg/L时酶活较高, 500 mg/L时酶活又达到一较高值, Mg2+在300 mg/L时酶活最低, 750 mg/L时酶活最高, 盐度低于 10时, 酶活呈递增之势, 此后随盐度增加酶活又逐渐降低, 30时降到一较低水平, 而35时酶活又达到一较高水平; 对类胰蛋白酶的影响 Ca2+高于300 mg/L时, 随 Ca2+增加酶活逐渐升高, Ca2+低于300 mg/L时酶活变化较大, 其中在200 mg/L时酶活为最高值, 在 100 mg/L和 300 mg/L时酶活最低,Mg2+低于 150 mg/L时, 随 Mg2+增加酶活逐渐降低,150~750 mg/L时, 随Mg2+增加酶活逐渐升高, 1 200 mg/L时酶活降至最低, 盐度低于20时, 随盐度增加酶活逐渐升高, 此后随盐度增加酶活又稍有下降; 对淀粉酶的影响Ca2+为30 mg/L, Mg2+为 20、60 mg/L时酶活最低, Ca2+为 500 mg/L 、Mg2+为500 mg/L时酶活最高, 而盐度对酶活影响呈抛物线状, 20时酶活最高;对脂肪酶的影响Ca2+为50 mg/L , Mg2+为20 mg/L,盐度为2时酶活最高, Ca2+为30 mg/L, Mg2+为500 mg/L,盐度为30时酶活最低。

表4 Ca2+、Mg2+、盐度对凡纳滨对虾消化酶、ATP酶比活力影响Tab.4 Effect of Ca2+, Mg2+ and salinity on digestive enzymes, ATP enzymes specific activity of L. vannamei
2.3 Ca2+、Mg2+、盐度对凡纳滨对虾 ATP酶的影响
Ca2+、Mg2+、盐度对凡纳滨对虾ATP酶的影响见表4。表4表明, Ca2+对 Na+-K+-ATP酶、Mg2+-ATP酶、Ca2+-ATP酶酶活都有显著影响, Mg2+对Na+-K+-ATP酶、Mg2+-ATP酶酶活具有显著影响, 而盐度仅对Na+-K+-ATP酶酶活影响显著。
由表4看出Ca2+对Na+-K+-ATP酶影响呈波浪趋势, 50、100、300 mg/L时酶活较高, 30、200、400、500 mg/L时酶活较低, 其中Ca2+为300 mg/L时酶活最高, 30mg/L时酶活最低, Mg2+对Na+-K+-ATP酶的影响在低于500 mg/L时, 随Mg2+增加酶活逐渐升高,高于 500mg/L时酶活又有较大幅度下降, 其中在750 mg/L时酶活最低, 盐度对 Na+-K+-ATP酶的影响在低于 30时, 基本随盐度增加而逐渐升高, 盐度为 5除外, 盐度为 5时酶活较高, 而在盐度达到 35时酶活较盐度为30时略有下降; Ca2+对Mg2+-ATP酶的影响趋势呈抛物线趋势, 30mg/L时酶活最低,200 mg/L时酶活最高, Mg2+对Mg2+-ATP酶影响也基本呈一抛物线趋势, 其中 20 mg/L时酶活最低,500 mg/L时酶活最高, 盐度对Mg2+-ATP酶影响除35外也呈一抛物线趋势, 在0.5时酶活最低, 10时酶活最高, 而 35时酶活达到一较高水平; Ca2+对Ca2+-ATP酶影响呈抛物线趋势, 30 mg/L时酶活最低, 200、300 mg/L时酶活最高, Mg2+对Mg2+-ATP酶影响也基本呈抛物线趋势, 20 mg/L时酶活最低,150 mg/L时酶活最高, 而盐度对Ca2+-ATP酶影响趋势与盐度对Mg2+-ATP酶酶活影响趋势相同, 0.5时酶活最低, 5时酶活最高。
2.4 Ca2+、Mg2+、盐度对凡纳滨对虾体内免疫酶的影响
Ca2+、Mg2+、盐度对凡纳滨对虾体内免疫酶的影响见表5。表5表明, Ca2+对ACP、SOD酶活具有显著影响, Mg2+对ACP、AKP酶活有显著影响, 而盐度对AKP、SOD酶活影响显著。
由表5看出,对ACP影响, Ca2+为100 mg/L时酶活最高, 30 mg/L时酶活最低, Mg2+在150 mg/L时酶活最高, 1200 mg/L时酶活最低, 20、60 mg/L时酶活也较低, 而在高于 150 mg/L时随Mg2+增加酶活基本呈逐渐下降之势, 盐度为5时酶活最低, 高于10时对酶活的影响差别不大, 而由 0.5增加到 5时酶活逐渐降低; 对AKP影响,Ca2+对AKP影响基本呈递减之势, Mg2+对AKP影响呈抛物线趋势, 150 mg/L时酶活最高, 1 200 mg/L时酶活最低, 而盐度对AKP影响呈递增之势; 对 SOD影响,Ca2+低于 100 mg/L时随 Ca2+增加酶活逐渐升高, 100~300 mg/L时随Ca2+增加酶活逐渐降低, 在 400、500 mg/L时酶活波动较大, 但酶活仍然较高, Mg2+对 SOD 影响除1200 mg/L外酶活呈抛物线趋势, 盐度对SOD 影响呈递增之势。

表5 Ca2+、Mg2+、盐度对凡纳滨对虾免疫类酶比活力影响Tab.5 Effect of Ca2+, Mg2+, salinity on immune enzymes specific activity of L. vannamei
2.5 Ca2+、Mg2+、盐度对酶活影响极差分析
Ca2+、Mg2+、盐度对酶活影响极差分析见表6。表6表明, Ca2+对Mg2+-ATP酶、Ca2+-ATP酶、SOD影响最大, Mg2+对类胰蛋白酶、淀粉酶、Na+-K+-ATP酶、ACP、AKP影响最大, 盐度对胃蛋白酶、脂肪酶影响最大。
2.6 Ca2+、Mg2+、盐度及其交互作用对凡纳滨对代谢酶影响
Ca2+、Mg2+、盐度及其交互作用对凡纳滨对虾消化酶影响见表7、表8。
表7表明, Ca2+与Mg2+、Ca2+与盐度、Mg2+与盐度之间的交互作用对凡纳滨对虾胃蛋白酶酶活都没有显著影响, 而对类胰蛋白酶酶活都有显著影响, Ca2+与盐度、Mg2+与盐度之间的交互作用对淀粉酶酶活具有显著影响, Ca2+与Mg2+间的交互作用对脂肪酶酶活具有显著影响; Ca2+与Mg2+、Mg2+与盐度之间的交互作用对凡纳滨对虾Na+-K+-ATP酶酶活具有显著影响, Ca2+与盐度间交互作用对 Mg2+-ATP酶酶活具有显著影响, Ca2+与盐度、Mg2+与盐度间的交互作用对 Ca2+-ATP酶酶活具有显著影响; 表8表明, Ca2+与Mg2+、Ca2+与盐度、Mg2+与盐度间的交互作用对 ACP酶活都有显著影响, 而对AKP酶活及SOD酶活都没有显著影响。
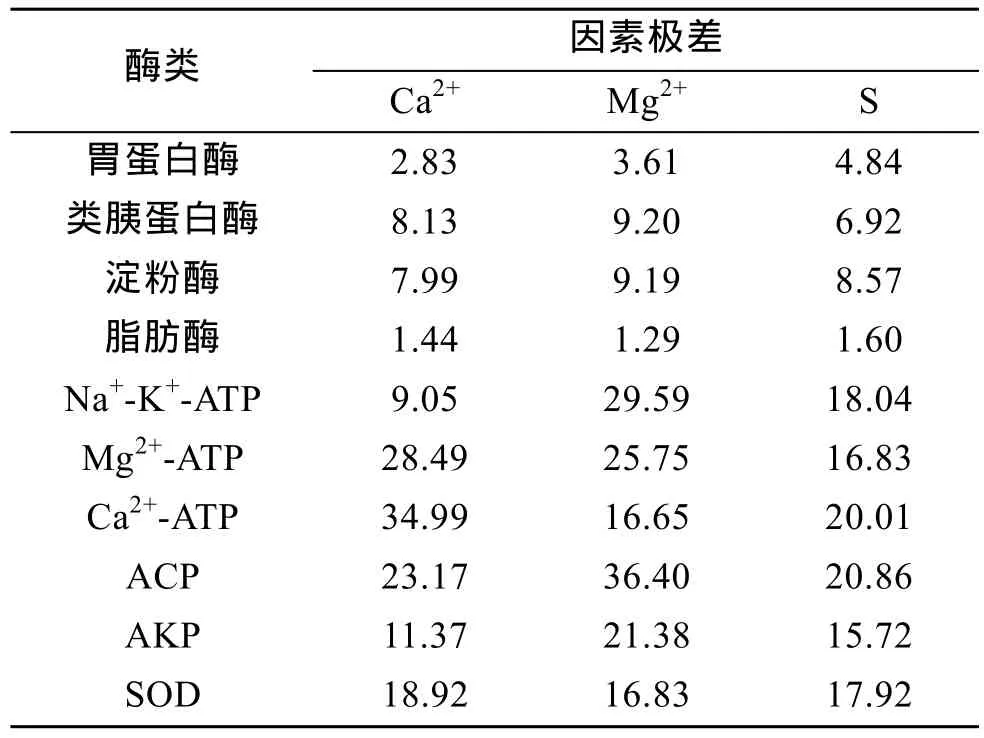
表6 Ca2+、Mg2+、盐度对酶活影响极差分析Tab.6 Range analysis of effect of Ca2+, Mg2+ and salinity to enzyme activity of L. vannamei
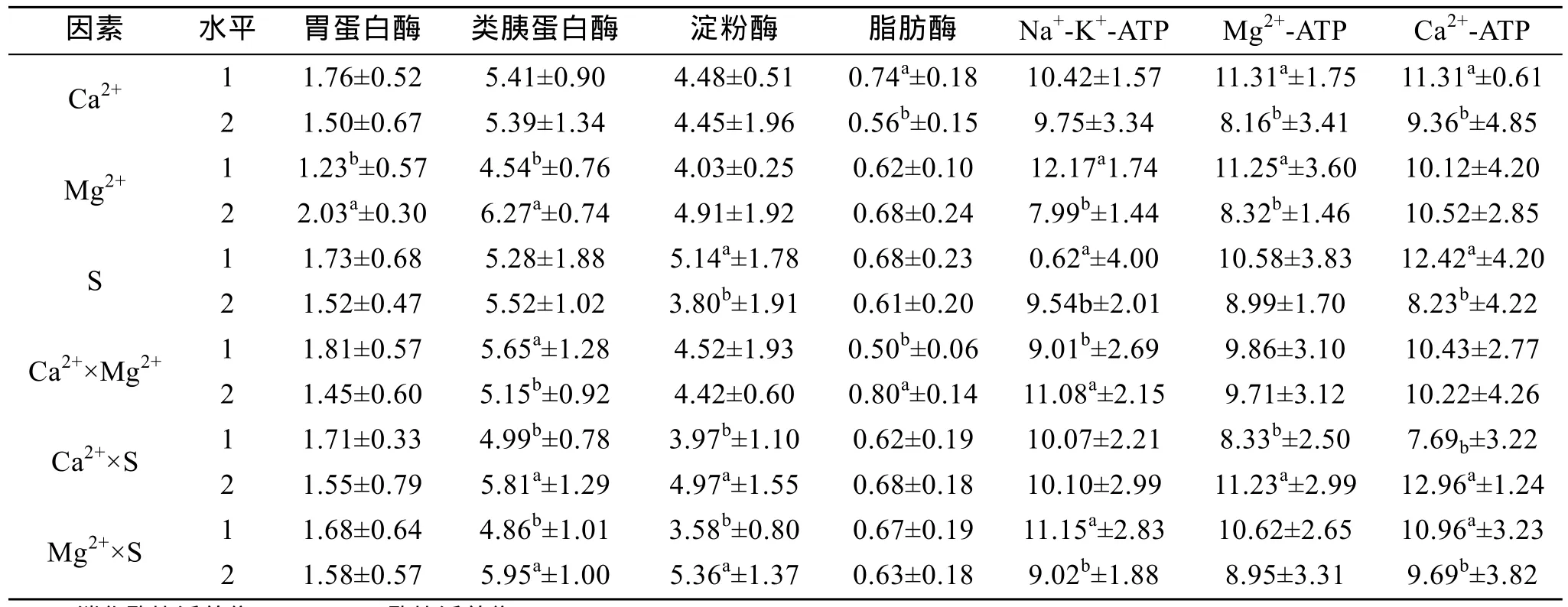
表7 Ca2+、Mg2+、盐度间交互作用对凡纳滨对虾消化酶及ATP酶影响Tab.7 The interaction effect of Ca2+, Mg2+, salinity on digestive enzymes and ATP enzymes specific activity of L. vannamei

表8 Ca2+、Mg2+、盐度间交互作用对凡纳滨对虾免疫类酶比活力影响Tab.8 The interaction effect of Ca2+, Mg2+ and salinity on immune enzymes specific activity of L. vannamei
3 讨论
3.1 Ca2+、Mg2+、盐度对凡纳滨对虾生长力的影响
虾类的生长是通过蜕皮来实现阶梯式增长的, Dall等[17]研究发现对虾类体内没有钙的储存机制, 蜕皮后早期钙化所需钙必须从水中吸收获得, 如果水体中Ca2+、Mg2+浓度较低, 蜕皮后表面钙化困难, 生长缓慢, 且当水体中Ca2+、Mg2+浓度达到凡纳滨对虾生长的合适范围时, 虾体通过离子调节过程中耗能较少, 其生长速度便较快[18-19]。Panikkar[20]关于对虾渗透压研究得出盐度影响凡纳滨对虾的渗透压调节,如果盐度过高或过低会使得渗透压调节的耗能增加,能量转换效率降低, 从而导致其生长速度减慢。Ca2+、Mg2+、盐度对凡纳滨对虾的生长有着重要的作用, 对其体内消化酶和 ATP酶的活性也有重要的影响, 酶活作为凡纳滨对虾生长的一个指标其活性高低可以判断凡纳滨对虾生长状况。
消化酶作为动物消化吸收的辅助因子对动物生长具有重要作用, 对凡纳滨对虾消化酶的研究, 多数集中于消化酶种类、性质、幼体发育不同阶段的酶活力变化以及饵料对消化酶活力的影响等方面[8,21-22],关于Ca2+、Mg2+及盐度对消化酶影响报道较少。从本试验结果看 Ca2+、Mg2+、盐度对与凡纳滨对虾消化吸收联系最紧密的蛋白酶都有显著影响。比较盐度对 4种消化酶影响与盐度对生长影响可以看出消化酶酶活的高低与生长速度紧密相连, 结果表明盐度为10时凡纳滨对虾生长速度最快, 而恰好盐度为10时 4种消化酶酶活都最高, 因此消化酶的活性可以很好地作为凡纳滨对虾生长指标, 据此也可以推测在凡纳滨对虾饲料中适当添加一定的消化酶酶活制剂能有效促进凡纳滨对虾生长; 极差分析表明 Mg2+对类胰蛋白酶影响最显著, 在Mg2+高于150 mg/L时其对凡纳滨对虾生长的影响与对类胰蛋白酶酶活的影响规律基本相似, Mg2+为 750 mg/L时生长最快,而在Mg2+低于150 mg/L时对凡纳滨对虾生长的影响与对类胰蛋白酶酶活的影响规律差别较大, 此可能与水体中 Mg2+含量太低受其他离子影响所致, 而交互作用试验表明Ca2+与Mg2+交互作用对类胰蛋白酶具有显著影响, 而在离子水平较低时此影响可能更大; Ca2+对类胰蛋白酶影响显著, 但折线图看出Ca2+对类胰蛋白酶影响没有一定规律, 与 Ca2+对凡纳滨对虾生长的影响规律差别较大, 此可能与交互作用有关, Ca2+与Mg2+, Ca2+与盐度之间的交互作用对类胰蛋白酶酶活都有显著影响。
三磷酸腺苷酶(ATP酶)是一族酶, 它是 Na+-K+泵、Ca2+泵、H+泵的构成成分, 与机体渗透压紧密相连, 在物质的跨膜转运中是一种非常重要的酶[23],本试验中Ca2+、Mg2+、盐度对Na+-K+-ATP酶都有显著影响。比较 Ca2+凡纳滨对虾生长影响可以看出除Ca2+为300 mg/L外Ca2+对Na+-K+-ATP酶酶活的影响与 Ca2+对生长影响规律基本一致, 此可能与Na+-K+-ATP酶对 Ca2+吸收与排放有关; Mg2+是Na+-K+-ATP酶的激活剂, 试验中Mg2+为500 mg/L时酶活最高, 这与刘存歧等[10]研究结果相同。Mg2+太低和太高时酶活都很低, 且 Mg2+太低时其生长速度也较慢, 因此适当增加淡水水体中 Mg2+对酶激活有显著作用, 同时促进了生长。盐度对酶影响基本呈递增之势, 但盐度过高却限制了凡纳滨对虾生长, 这正好表明高盐下Na+-K+-ATP酶耗能影响了对虾生长,因此在淡水养殖条件下应适当增加盐度。关于Mg2+-ATP酶、Ca2+-ATP酶的研究报道很少见, 此两种酶主要是促进Ca2+、Mg2+的吸收, 本试验中Ca2+、Mg2+、盐度对 Mg2+-ATP酶、Ca2+-ATP酶影响基本都呈抛物线状, 即Ca2+、Mg2+及盐度过高和过低都会降低Mg2+-ATP酶、Ca2+-ATP酶活性, 进而限制Ca2+、Mg2+吸收。
3.2 Ca2+、Mg2+、盐度对凡纳滨对虾免疫力的影响
Dall等[17]提出水体中 Ca2+、Mg2+、盐度对凡纳滨对虾存活具有重要影响, 对虾类的表皮薄而柔软,在淡化养殖水体中, Ca2+、Mg2+等离子含量较低, 对虾难以吸收足够的Ca2+、Mg2+维持正常的生理功能,从而影响对虾的存活, 本次试验结果与之一致,Ca2+、Mg2+、盐度均显著影响凡纳滨对虾的存活, 而成活率的高低可以由对虾体内免疫指标进行衡量,ACP、AKP和SOD等作为对虾体液防御系统中的重要免疫因子, 其活性高低反映了虾体免疫力强弱。刘存歧, 刘丽静[7]等在试验中证实 Ca2+、Mg2+对凡纳滨对虾体内 SOD和 AKP的活性有重要的影响。盐度作为一种外源刺激和环境胁迫因子可以引起无脊椎动物相关免疫指标及机体抵抗力变化[11]。
AKP和ACP均为磷酸单酯酶, 对钙质吸取、骨骼形成、磷酸钙化、甲壳素的分泌形成等都具有重要作用[24]。ACP广泛分布于动物组织中, 在酸性环境下起到吞噬异物作用[4], 本试验中Ca2+、Mg2+、盐度对ACP都有显著影响, Ca2+、Mg2+对ACP影响基本呈抛物线状, Ca2+为100 mg/L, Mg2+为150 mg/L时酶活最高, 这与Ca2+对凡纳滨对虾成活率影响一致, 但与Mg2+对凡纳滨对虾成活率相反, 这可能与交互作用有关, 试验中得出Mg2+与Ca2+间、Mg2+与盐度之间的交互作用对ACP都有显著影响, 而盐度对ACP酶活的影响在盐度高于 10时酶活基本稳定在同一值, 变化不大, 这与盐度对存活的影响稍有差别, 而在盐度低于10时酶活变化较大这与盐度对存活影响类似, 此可能盐度较低受交互作用影响较大; AKP是一种含锌的对底物专一性较低的磷酸单酯水解酶[25], Muhammad[26]根据试验证实蜕皮后的罗氏沼虾碱性磷酸酶活性显著高于蜕皮间期以增加钙镁的吸收, 本试验中Mg2+对AKP酶活具有显著影响, 比较 Mg2+对 AKP酶活影响与Mg2+对成活率的影响可以看出两者变化规律相差较大, Mg2+过高限制了 AKP酶活, 而此时成活率较高, 这可能是其他免疫因子起到了关键作用, 其具体原因还有待进一步研究。SOD是一种与机体免疫相关的酶, 可以消除体内产生的自由基[27], 本试验中Ca2+和盐度对SOD具有显著影响, Ca2+对酶活影响规律与对凡纳滨对虾成活率影响规律类似, 而盐度对酶活影响与对成活率影响差别较大, 盐度高时酶活较高而此时成活率较低, 此可能主要与凡纳滨对虾渗透压调节有关。
综上, 本研究所用消化酶类、三磷酸腺苷酶类及免疫类酶均与水体中 Ca2+、Mg2+及盐度有着紧密联系, 因此它们活性的高低可做为检测水中离子浓度是否适合凡纳滨对虾存活与生长发育的重要指标,以判断对虾的机能状态。
[1]张伟权.世界重要养殖品种-南美白对虾生物学简介[J].海洋科学, 1990, 14(3):69-73.
[2]谢达祥, 陈晓汉.水体中钙和镁对凡纳滨对虾幼体成活率和生长的影响[J].水利渔业, 2007, 27(5): 46-51.
[3]刘存歧, 刘丽静, 张亚娟, 等.基于卤水的养殖用水中 Ca2+/Mg2+对凡纳滨对虾生长及体内 SOD和 AKP的影响[J].水产科学, 2007, 26(2): 67-69.
[4]梁萌青, 王士隐, 王家林, 等.海水养殖与低盐养殖凡纳滨对虾生长性能、酶活及RNA/DNA比值的差异[J].海洋水产研究, 2007, 29(4): 69-75.
[5]沈丽琼, 陈政强, 陈昌生, 等.盐度对凡纳滨对虾生长与免疫功能的影响[J].集美大学学报, 2007, 12(2):108-113.
[6]Stumm W, Morgan J J. 水化学: 天然水体化学平衡导论[M].北京: 科学出版社, 1987.
[7]雷衍之, 减维玲.养殖水环境化学[M].北京: 中国农业出版社, 2004.
[8]朱春华, 李广丽, 文海翔.南美白对虾早期幼体消化酶活力研究[J].海洋科学, 2003, 27(5): 54-57.
[9]潘鲁青, 刘 志, 姜令绪.盐度、pH变化对凡纳滨对虾鳃丝Na+-K+-ATPase活力影响[J].中国海洋大学学报, 2004, 34(5): 787-790.
[10]刘存歧, 刘丽静, 王军霞, 等.盐碱地渗水钙镁离子对凡纳滨对虾酶活力的影响[J].动物学杂志, 2007,42(2): 129-133.
[11]曹剑香, 简纪常, 吴灶和.虾类体液免疫研究进展[J].湛江海洋大学学报, 2006, 26(1): 89-93.
[12]臧维玲, 戴习林, 张建达, 等.罗氏沼虾育苗水中Mg2+和Ca2+含量及Mg2+/Ca2+对出苗率的影响[J].海洋与湖沼, 1995, 26(5): 552-557.
[13]臧维玲, 林喜臣, 戴习林.淡化方式与盐度对凡纳对虾幼虾生长的影响[J]. 上海水产大学学报, 2003,12(4): 308-312.
[14]刘玉梅, 朱谨钊, 吴厚余, 等. 中国对虾幼体和仔虾消化酶活力及氨基酸组成的研究[J]. 海洋与湖沼,1991, 22(6): 571-575.
[15]刘玉梅, 朱谨钊.对虾消化酶的研究[J].海洋科学,1984, 8(5): 46-50.
[16]潘鲁青, 王克行.中国对虾幼体消化酶活力的试验研究[J].水产学报, 1997, 21(1): 26-32.
[17]Dall W, Smith D M. Ionic regulation of four species ofpanacid prawn[J]. Journal of Experimental Marne Biology and Ecology.1981, 55: 219-232.
[18]Digby P S B.Calcification in crustacean: the fundamental process[J].Physiologist, 1980, 23: 105.
[19]Dong S L, Du N S, Lan W.Effects of pH and Ca2+concentration on growth and energy budget ofMacrobrachium nipponense[J].Fish China, 1994,18(2):118-122.
[20]Panikkar N K. Osmotic behavior of shrimps and prawns in relation to their biology and culture[J].FAO Fish Rep, 57: 527-538.
[21]陈楠生.对虾生物学[M].青岛: 青岛海洋大学出版社, 1992: 172-175.
[22]杨奇慧, 周存歧, 马丽莎, 等.凡纳滨对虾幼体胃蛋白酶和类胰蛋白酶活力的研究[J].海洋科学, 2005, 29(5): 6-9.
[23]Towle D W, Palmer G E, Harris J L.Role of gill Na+,K+-ATPase in acclimation of blue crab,Callinectes sapidus, low salinity[ J].J Exp Zoo, 1976, 196: 315- 322.
[24]顾德平, 方卫星, 叶维明.对虾淡化驯化存活率的观察[J].水产科技情报, 1998, 25(1): 35-36.
[25]Blasco J, Puppo J, Sararsquete M.Acid and alkaline phosphates activities in the champRuditapes philipinarum[ J].Mar.Biol.1993, 115: 113- 118.
[26]Muhammad A L.Effects of environment alkalinity on calcium-stimulated dephosphodating enzyme activity in the gills of postmoult and intermoult giant freshwater prawnsMacrobrachium rosenbergii(de Man)[J].Comp Biochem Physic, 1992, 107A(4): 597-601.
[27]Dalla Via.Salinity response in bricks water popularations of the freshwater shrimpPalaemonetes antenariusI.Oxygen consumption[J].Comp Biochem Physic, 1987, 87(2): 471-478.
