蓝隐藻藻蓝蛋白结构与功能稳定性研究
2013-10-13李文军
李文军, 陈 敏
(烟台大学 生命科学学院, 山东 烟台 264005)
藻胆蛋白是存在于蓝藻、红藻、部分隐藻和甲藻中的捕光色素蛋白复合物, 它们吸收 500~650 nm的可见光, 并将吸收的光能传递给膜上的反应中心进行光合作用。由于藻胆蛋白在可见光区和近紫外区都有明显的特征吸收, 并且具有很高的荧光量子产率, 作为一个天然内标, 其色基与蛋白质之间的结合状态以及蛋白质所处的内部微环境的微小变化,都可以在其光谱性质上呈现出很灵敏的反映, 因此是研究蛋白质结构与功能关系的难得材料。
隐藻是一类单细胞、结构较为复杂的双鞭毛藻类,在淡水和海水中都有分布[1]。每种隐藻只含有一种藻胆蛋白[2], 或者藻蓝蛋白(PC)或者藻红蛋白(PE)。目前, 对于红、蓝藻中的藻胆蛋白, 无论结构、性质以及组装而成的藻胆体等, 都有相当透彻的研究, 但是对于隐藻藻胆蛋白却了解较少, 其蛋白亚基的性质、彼此之间的组装和连接方式, 以及与膜上反应中心的接触等情况, 目前都不完全确定[3]。本文使用的蓝隐藻(Chroomonas placiodea)只含有一种藻蓝蛋白PC-645。据报道, PC-645含有α1、α2和β三种亚基, 通过半胱氨酸的硫醚键共价连接多个色素基团, 包括藻蓝胆素(phycocyanobilin,PCB),藻紫胆素(phycobiliviolin, PXB)和在长波端697 nm有最大吸收的一种色素基团(mesobiliverdin, 也称MBV)。色基吸收的光能从PXB经PCB、MBV, 最终传递给膜上的叶绿素[4]。PC-645亚基通过折叠形成球形的三级结构, 并以(α1β)(α2β)异二聚体方式形成四级结构, 为色素基团提供了稳定的内环境, 并且使其相互靠近, 从而保证能量传递功能的实现[5]。目前对藻胆蛋白结构、功能和重折叠的研究只限于红、蓝藻藻胆蛋白, 而对隐藻藻胆蛋白尚未有报道。由于隐藻藻胆蛋白是位于类囊体膜内侧或堆积在膜腔中[6-7], 而不是伸展在叶绿体基质中,伴随着光合作用过程中叶绿体内环境的变化, 其结构和构象的变化与位于基质中的红、蓝藻藻胆蛋白必然有所不同, 并可能导致其能量传递效率的改变。为此, 本文以蓝隐藻(C.placiodea)PC-645为材料, 在不同 pH和不同质量浓度尿素中, 通过对荧光光谱、吸收光谱的监测,研究蓝隐藻 PC-645蛋白的变性和复性动力学, 以及蛋白结构和能量传递功能的关系。
1 材料与方法
1.1 PC-645样品制备
蓝隐藻(C. placiodea)的培养和PC-645的制备、纯化方法参照文献[8]。纯化的80%硫酸铵沉淀的PC-645,经 Pall 30kDa超滤管浓缩, 并调整蛋白质量浓度为50 g/L待用。以下操作全部于室温、弱光下进行。
1.2 pH变性及复性实验
采用0.1 mol/L的HCL或0.1 mol/L的NaOH溶液调节 0.2 mmol/L的磷酸氢二钾缓冲液 pH, 经HANNA PH211台式酸度计检测, 配制成不同pH缓冲液。将浓缩后的PC-645用相应pH的缓冲液稀释至蛋白终质量浓度为2 g/L和0.1g/L, 涡旋混匀后放置10 min, 分别用于吸收和荧光光谱的测定[9-10]。
1.3 极端pH下时间耐受性实验
如1.2操作, 在pH3条件下分别调节PC-645蛋白终质量浓度为2 g/L和0.1g/L, 在60 min内间隔取样, 分别用于测定吸收和荧光光谱。
1.4 尿素变性及复性实验
高质量浓度尿素变性实验中, PC-645被稀释至不同pH值的尿素溶液中, 尿素终质量浓度为8 mol/L, 蛋白终质量浓度为 2 g/L; 尿素复性实验时, 蛋白质量浓度为2 g/L的PC-645在终质量浓度为3 mol/L的尿素(含50 mmol PBS)缓冲液中变性1h后, 置于半透膜中对纯水透析除去尿素, 定时取样测定吸收光谱。
1.5 吸收光谱测定
采用TU-1900紫外-可见分光光度计检测, 扫描范围250~750 nm, 蛋白终质量浓度为2 g/L, 光径1 cm,步长1 nm。
1.6 荧光光谱测定
用 PerkinElmer LS55 荧光分光光度计检测, 蛋白终质量浓度为0.1 g/L, 光径1 cm。
2 pH耐受光谱动力学
2.1 吸收光谱
天然状态下的 PC-645在可见光区有 582、625和645 nm三个特征峰吸收峰[11], 其中582 nm峰对应于PXB色基的吸收, 625 nm吸收肩峰对应于PCB,两者以1:1关系存在于β亚基上; 而645 nm吸收对应于 MBV, 其吸收范围可跨越 640~695 nm, 为α亚基所仅有[12]。随着环境中pH的降低, 藻蓝蛋白光吸收逐渐减弱(图1A)。在pH低于3时, 吸光度下降非常快, 原582 nm和650 nm最大光吸收红移, 在pH低于2.5时, 吸收峰融合为一个600~700 nm的较宽吸收峰, 可能是α亚基构象改变, MBV色基暴露的结果。PC-645的α亚基含有较多碱性氨基酸[4,13], 当外界pH环境较低时,α亚基更易于受到影响, 所带负电荷减少, 亚基变性伸展, 结合在 Cys α19上的 MBV色基暴露, 表现吸收峰红移。在碱性溶液中, 藻蓝蛋白吸收光谱在pH 7~10时较为稳定(图1B), 而pH超过10.25时, 吸收光谱强度下降显著。与酸性环境中相同的是, 582 nm最大光吸收处出现红移; 不同的是,645 nm处最大光吸收处出现了蓝移, 并且没有属于MBV的670~700 nm长波吸收峰显现; 显然α亚基在碱性条件下似乎相对稳定。另外, 伴随着645 nm处光吸收强度的快速下降, 582 nm处峰位的吸收值的下降则要缓慢的多。这是由于 582 nm处吸收峰来自于PXB, 相比于PCB, PXB通过β50和β61两个半胱氨酸残基与PC-645连接, 而PCB仅靠一个半胱氨酸残基与PC-645 β82相连, 所以PXB表现出更高的稳定性。当pH高于10.75时, 各个吸收峰相互融合为一个550~640 nm的峰, PC-645的特征吸收峰消失, 表明藻胆素色基所处蛋白内部的微环境构象变化, 指示藻蓝蛋白亚基的三级结构已经解体[14]。

图1 pH对PC-645吸收光谱的影响Fig.1 Effects of solvent pH on the absorption spectra of PC-645
近紫外区374 nm和340 nm是藻胆素特征吸收峰, 与色基本身的构象和状态有关。在pH 3.25~7和pH 7~10.25之间, 374 nm和340 nm处的吸收值略有下降和浮动, 但变化幅度较小; 而到达pH 3.25以下或pH 10.25以上时, 两个峰的吸收值迅速升高。此结果说明, 藻胆素色基所处的蛋白环境在 pH 3.25~10.25之间相对稳定, 因而色基状态变化有限。而当处于极酸和极碱的时候, 光吸收值的快速增高,可能是因为PC-645亚基变性伸展, 处于结构内部的藻胆素逐渐暴露, 也可能是因为pH变化对藻胆素产生了不可逆的修饰。此外, 远紫外区属于芳香族氨基酸的280 nm吸收峰也呈现类似的变化趋势, 由于疏水的芳香族氨基酸通常位于蛋白质内部疏水区, 因此其吸收变化也可提示蛋白构象变化的信息。
2.2 荧光光谱

图2 pH对PC-645荧光发射谱的影响Fig.2 Effect of pH on fluorescence emission spectra of PC-645
选择582, 625和645 nm三个波长的激发光分别对PC-645进行激发。其中582、625 nm是位于β亚基上的PXB和PCB的最大吸收, 而645 nm被认为与α亚基上的MBV有关。在PC-645内部, 色基吸收的能量将沿着 PXB→PCB→MBV 方向传递, 最终产生660~662 nm 的末端发射。如图 2所示, 采用三个不同波长进行激发PC-645都只产生662 nm特征荧光,pH条件变化, 仅影响发射的荧光强度, 不影响峰的位置。在pH 3~7范围内, 荧光发射峰强度都随pH的降低有所降低, 但幅度很小; 当pH降低到3时, PC发射峰强度开始骤降; 而pH低于2.5时, 荧光发射峰几近消失。在碱性范围内, 当pH从7逐渐升到 10的过程中, 荧光强度同样逐渐降低, 但下降速度明显快于酸性条件; 当pH升高到10.5时,荧光强度可降至 pH7时的 50%以下。结合吸收光谱测定结果, 说明在pH 3.5~10之间时, PC-645不仅结构相对稳定, 并且保持了较高的内部能量传递能力。
2.3 藻蓝蛋白在极端pH下时间耐受性实验

图3 pH3时PC-645荧光强度(A)与吸收值(B)随时间的变化Fig.3 Changes of the relative fluorescence intensity (A)and absorption value (B)of PC-645 with time at pH3
由于隐藻PC-645在pH > 3时变性缓慢, 而pH < 3时荧光光谱与吸收光谱都呈快速持续下降趋势, 因此选择pH3条件下, 观测PC-645的光谱随时间变化。如图3所示, 在此极端酸性条件下, PC-645的荧光发射强度在10 min内迅速下降, 之后进入一个相对稳定的平台期,而吸收峰值在60 min内则是呈持续下降趋势。这表明PC-645在 pH3条件下, 其能量传递功能的消失和蛋白空间结构的变化并非同步过程, 能量传递功能的失去先于结构变化。因为亚基解离、三级或者二级结构解体、色基修饰等结构变化是一个复杂的动态过程, 过程中任何一步都可能影响到色基的相对距离和排布, 导致能量传递功能丧失。因此, 为了获得稳定、重复的光谱测定结果, 实验中变性时间严格控制为10 min。
2.4 藻蓝蛋白在pH复性过程中的吸收光谱
将缓冲液从 pH极端酸性或碱性逐渐调回中性,PC-645吸收光谱的变化情况如图 4。结果显示,PC-645在pH为3时尽管吸收强度下降, 但吸收峰形依然保持完整。将pH从3调整到7后, 吸收峰形并无改变(图 4B), 但是强度明显增加, 可以达到极高的复性效率。当pH降低到2后, 尽管复性后的吸收峰形可有一定程度的恢复(图 4A), 但强度增加有限,并且出现了675~700 nm的一个长波吸收。说明pH为 3时, PC-645的大部分蛋白构象变化和色基状态改变依然是可逆的, 在酸性区可逆变性和不可逆变性的临界点可以达到 3以下, 低于其他藻胆蛋白类型[5]。而在碱性范围内, 从 pH11或者 pH12恢复到pH7时, PC-645吸收峰的形状略有恢复, 但强度没有明显的恢复(图4C、图4D)。表明在极端碱性pH条件下, 仅有局部的蛋白会发生复性, 绝大部分蛋白的变性剧烈, 基本是不可逆的。
3 尿素光谱动力学
3.1 尿素与pH变性比较
通常认为, 高质量浓度的尿素可使蛋白质达到完全变性[15]。如图5所示, 当用pH为12的碱性尿素变性时, 其效果与单纯使用碱性溶液时结果相似,在 580~650 nm范围的吸收大幅下降, 645、625和582 nm吸收峰合并为一个590~600 nm的吸收单峰,而350~400 nm属于色基的吸收明显增加, 并且280 nm芳香族氨基酸的吸收增加。但使用pH2的酸性尿素变性时, 发现藻蓝蛋白变性程度反而不及单纯的酸性条件时剧烈, 这可能因为尿素氨基的质子化消耗了部分氢质子, 延缓了pH降低的效应。在含8mol/L尿素、pH为7的中性条件下, PC-645在10 min内即可完全变性, 且变性的结果与碱变性所得的图谱更为近似。因此, 可见光区吸收值降低, 特征吸收峰形单峰化, 以及近紫外区色基吸收明显增加等光谱特征, 可以看作是藻蓝蛋白完全变性, 亚基构象破坏的标志。

图4 pH复性过程中PC-645的吸收光谱Fig.4 Absorption spectra of PC-645 in protein refolding induced by pH adjustment

图5 尿素(8mol/L)在不同pH条件下对PC-645吸收光谱的影响Fig.5 Influence of urea (8mol/L)on the absorption spectra of PC-645 at different pH
3.2 PC-645的尿素复性过程中的吸收光谱
以往有报道, 尿素导致的蛋白质变性的动力学过程呈现S型, 质量浓度高于4 mol/L时, 蛋白变性速度极快[16], 因此实验选择 3 mol/L尿素处理PC-645并观测其变性过程的光谱变化。结果如图6。
PC-645在尿素中变性的结果, 只是导致 582、625和645 nm特征吸收峰值下降和350~400 nm色基的吸收的小幅度增加, 但峰形基本不变, 即使变性时间长达24 h, 也只有645 nm峰降低相对略快(图6A)。说明低质量浓度尿素最初影响的只是PC-645的外部结构, 或者亚基的聚合状态, 而色基所处的内部蛋白环境没有被波及, 表现出一定的耐受性。透析除去尿素时, PC-645在最初复性的1h内, 特征吸收峰吸收值逐渐增加, 峰形更为完整, 说明藻蓝蛋白活性可逐渐恢复。但时间更长以后, 由于透析袋内藻蓝蛋白样品被稀释, 表观吸收值反而下降。
4 讨论
PC-645作为一种捕光色素蛋白, 其最重要的生理功能就是吸收和传递光能。光能的吸收由 PXB、PCB和MBV三种藻胆素色基共同承担, 它们在可见光区和紫外区都呈现特征的吸收, 当色基所处的蛋白质微环境不同或者发生变化时, 相同的色基也可产生不同的吸收谱峰。因此吸收光谱的变化是色基所处蛋白质内环境变化的探针, 直接反映亚基二、三级空间结构状态。此外, PC-645色基吸收的能量是次第传递的, PXB、PCB和MBV任何一种色基激发后,PC-645在缺少能量受体的情况下都可发射并且只发射来自MBV的660~662nm特征荧光(图3), 说明在PC-645中PXB和PCB都是敏化基团, 只有MBV是发色基团, 此荧光强度的变化直接反应能量传递效率的高低。由于这些色基分别位于不同亚基上, 要保证能量传递功能的实现, 要求蛋白质亚基要具备完整的二、三级甚至四级结构。因此, 改变环境条件,综合观测藻蓝蛋白吸收和荧光光谱, 可给出大量的结构与功能信息。
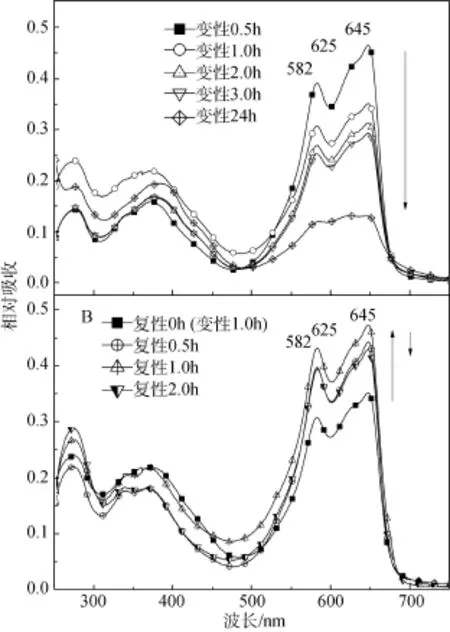
图6 PC-645在3mol/L尿素中的变性和复性过程吸收谱Fig.6 Absorption spectra of PC-645 in 3mol/L urea during denaturation and renaturation
如图7所示, pH诱导的PC-645蛋白构象与功能变化可分为三个不同的区段。(1)稳定区: 在pH 3.5~7区域, 吸收和荧光谱都比较稳定, 显示蛋白质构象和功能在此区域都保持正常。(2)次稳定区: 在pH在7~10时, 荧光强度缓步下降, 但光吸收依然保持平稳, 说明位于亚基内部的色素基团的状态、所处的疏水微环境都没有改变, 二、三级结构大部分完好; 荧光传递效率的降低, 可能是亚基局部区域构象变化或者色素基团间的空间距离变化(如四级结构微扰)引起。(3)不稳定区: pH在 2.75~3.5和 pH为 10~11时, 吸光度和荧光强度都呈快速下降, 色基在近紫外和可见光区的吸收峰位变动, 蛋白构象处于快速崩溃期。

图7 pH对PC-645吸收光谱、荧光光谱的影响Fig.7 Influence of pH on the traces of peak intensities of absorbance and fluorescence of PC-645
光谱分析结果说明, 蓝隐藻PC-645在酸性范围比在碱性范围内更稳定, 这一点在pH复性实验中再次得到证实(图4)。这可能与隐藻藻胆蛋白所处的生理环境特殊有关。蓝藻藻胆蛋白附着在类囊体膜的表面与光合系统 II相连接, 红藻藻胆蛋白附着在类囊体膜的外表面, 与叶绿体基质相接触, 而隐藻藻胆蛋白处于类囊体腔中。伴随着光合作用的进行, 光驱动电子传递的结果, 使叶绿体基质pH升高, 而类囊体腔则逐步酸化, 所以对于隐藻藻胆蛋白而言,在酸性条件下维持结构和功能的稳定具有更为重要的生理意义。
隐藻PC-645在很宽的pH范围以及一定质量浓度的尿素中均保持稳定, 表现出构象与功能对环境变化的高度适应性。推测其亚基间可能存在一些关键位点, 在受到一定程度的pH环境干扰时, 这些位点能够比较稳定的维持蛋白的结构状态; 而在蛋白结构的一些非关键区域中, 肽链的结构则允许呈现一定的柔性变化而不影响功能的发挥[17]。隐藻PC-645的两种 α亚基均含有大量的碱性氨基酸, 其中α1亚基等电点大于 9[18], 说明这些碱性残基大多位于蛋白质表面; 而PC-645的β亚基PI为5.7~6.0,偏于酸性。显然在隐藻PC-645两种亚基聚合或四级结构形成中, 除了疏水力之外, 静电相互作用可能扮演着重要角色。pH变化可影响氨基酸残基的解离,从而影响如盐键等静电相互作用而导致蛋白质变性;而尿素则既可作为质子受体也可作为质子供体, 通过形成氢键使蛋白质肽链伸展[15]。PC-645能在广泛pH条件下保持能量传递功能稳定, 并且在低质量浓度尿素中维持吸收状态较长时间不变, 说明其亚基结构相当致密, 并且四级结构稳定。由于PC-645在酸性区变性的临界pH在3~3.5附近, 接近羧基侧链的解离区段, 推测酸性 β亚基上的羧基侧链可能参与了亚基之间的关键作用, 当环境 pH低于羧基的pK值时, 大部分羧基质子化而失去负电荷, 导致蛋白空间结构崩溃、解体。
[1]Hoef-Emden K, Melkonian M. Revision of the genus cryptomonas (Cryptophyceae): a combination of molecular phylogeny and morphology provides insights into a long-hidden dimorphism[J]. Protist. 2003, 154(3–4): 371-409.
[2]Guard-Friar D, Eisenberg B L, Edwards M R, et al.Immunochemistry on cryptomonad biliproteins[J]. Plant Physiol. 1986, 80(1): 38-42.
[3]Doust A B, Wilk K E, Curmi P M G, et al. The photophysics of cryptophyte light-harvesting[J]. Journal of Photochemistry and Photobiology A: Chemistry,2006,184(1–2): 1-17.
[4]Sidler W, Nutt H, Kumpf B, et al. The complete amino-acid sequence and the phylogenetic origin of phycocyanin-645 from the cryptophytan algaChroomonas sp[J]. Biol Chem Hoppe Seyler,1990, 371(7): 537-547.
[5]Liu L N, Su H N, Yan S G, et al. Probing the pH sensitivity of R-phycoerythrin: investigations of active conformational and functional variation[J]. Biochim Biophys Acta.2009, 1787(7): 939-946.
[6]Ludwig M, Gibbs S P. Localization of phycoerythrin at the lumenal surface of the thylakoid membrane inRhodomonas lens[J]. J Cell Biol, 1989, 108(3): 875-884.
[7]Lichtlé C, Duval J C, Lemoine Y. Comparative biochemical, functional and ultrastructural studies of photosystem particles from a Cryptophycea:Cryptomonas rufescens; isolation of an active phycoerythrin particle[J].Biochimica et Biophysica Acta (BBA)- Bioenergetics,1987, 894(1): 76-90.
[8]张允允, 陈敏. 蓝隐藻藻蓝蛋白的分离、纯化及性质研究[J]. 烟台大学学报(自然科学与工程版), 2011,24(4): 281-286.
[9]张少斌, 王瑾, 马镝, 等. 天然食用色素藻蓝蛋白的稳定性研究[J]. 食品科技, 2007(6): 169-171.
[10]范刚, 陈德文, 潘思轶, 等. 葛仙米藻胆蛋白提取工艺及藻蓝蛋白稳定性研究[J]. 食品科学, 2005, 26(9): 215-218.
[11]Morschel E, Wehrmeyer W. Cryptomonad biliprotein:phycocyanin-645 from aChroomonasspecies[J]. Arch Microbiol, 1975, 105(2): 153-158.
[12]Maccoll R, Guard-Friar D. Phycocyanin 645. The chromophore assay of phycocyanin 645 from the cryptomonad protozoaChroomonasspecies[J]. J Biol Chem, 1983, 258(23): 14327-14329.
[13]Glazer A N, Wedemayer G J. Cryptomonad biliproteins —an evolutionary perspective[J]. Photosynthesis Research,1995, 46(1): 93.
[14]邵思蜜, 苏海楠, 张熙颖, 等. 光谱学方法对钝顶螺旋藻异藻蓝蛋白活性构象研究[J]. 光谱学与光谱分析, 2010, 30(6): 1643-1646.
[15]Thoren K L, Connell K B, Robinson T E, et al. The free energy of dissociation of oligomeric structure in phycocyanin is not linear with denaturant[J]. Biochemistry, 2006, 45(39): 12050-12059.
[16]Maccoll R, Malak H, Cipollo J, et al. Studies on the dissociation of cryptomonad biliproteins[J]. J Biol Chem, 1995, 270(46): 27555-27561.
[17]苏海楠. 蓝藻与红藻中藻胆蛋白的活性构象研究[D].济南: 山东大学, 2010.
[18]Zhang Y Y, Chen M, Cui H. Isolation and characterization of a new subunit of phycocyanin fromChroomonas placoidea[J]. Chinese Chemical Letters, 2011, 22(10):1229-1232.
