绿藻浒苔对浮游植物群落结构影响研究
2013-10-13栾青杉孙坚强
张 雪 , 栾青杉, 孙坚强, 王 俊
(1. 上海海洋大学 水产与生命学院, 上海 201306; 2. 中国水产科学研究院 黄海水产研究所 海洋可捕资源评估与生态系统实验室 山东省渔业资源与生态环境重点实验室, 山东 青岛 266071)
浒苔(Enteromorpha prolifera)在分类学上属于绿藻门、石莼目、石莼科、浒苔属, 广泛分布于河口、海湾等浅水区以及海陆结合部的咸淡水交汇的生境中[1-2]。在水体富营养化等适宜的环境条件下,浒苔极易大量繁殖并暴发形成“绿潮”[3], 给近海的生态环境和渔业经济发展带来不利的影响[4]。浮游植物主要由单细胞的藻类组成, 在水体中大量繁殖时会形成水华, 近年来有害藻华频繁发生, 规模不断扩大, 如何进行有效的预测和防治, 实现海洋生物资源的可持续利用, 成为亟待解决的重要科学问题[5]。
植物之间可以通过向环境中释放化学物质而产生直接或间接的相生相克作用。大型藻对单细胞浮游植物克生作用的研究已有很多报道[6-12], 涉及的浮游植物都是我国近海赤潮的主要肇事物种,比如硅藻门的三角褐指藻(Phaeodactylum tricornutum)和中肋骨条藻(Skeletonema costatum), 甲藻门的塔玛亚历山大藻(Alexandrium tamarense)、前沟藻(Amphidinium hoefleri)、米氏凯伦藻(Karenia mikimotoi)、东海原甲藻(Prorocentrum donghaiense)、海洋原甲藻(P. micans)和锥状施克里普藻(Scrippsiella trochoidea), 金藻门的球等鞭金藻(Isochrysis galbana)以及黄藻门的赤潮异弯藻(Heterosigma akashiwo)等。这些研究在开展赤潮的生物防治以及赤潮发生海域的生态修复等方面都有着积极的意义。
大型藻与浮游植物的相互作用研究, 多为针对单一物种的室内受控模拟实验, 在浮游植物群落水平上的研究相对较少[13-14]。本研究拟在前人工作的基础上, 选取青岛近海习见大型绿藻浒苔和采样点海水中浮游植物群落, 进行室内的共培养实验, 从物种组成、细胞丰度和多样性的变化等方面探讨绿藻浒苔对浮游植物群落结构的影响, 以期为近海的生态系统健康和环境修复提供基础数据和科学依据。
1 材料与方法
1.1 实验材料
实验所用大型绿藻浒苔于2011年7月采自山东青岛第三海水浴场附近海域。采集的样品去除杂藻后, 用Whatman GF/F滤膜过滤的海水冲洗干净, 于过滤海水中在合适的培养条件下适应1~2 d。
实验所用浮游植物群落采自浒苔取样点附近海水, 经150 μm孔径筛绢过滤去除捕食者, 过滤后海水避光暂存。
采集浒苔取样点附近的海水, 经GF/F滤膜过滤后煮沸冷却, 按照f/2配方添加营养元素[15], 配制成50倍的f/2营养液母液备用。
1.2 实验设计
为了观察浒苔鲜组织对浮游植物群落结构的影响, 于7月29日至8月8日进行了10天的浒苔和浮游植物群落共培养实验。实验设计4个不同的处理,包括1个对照组和3个实验组, 每组分别设置3个平行样。对照组为未添加浒苔的浮游植物群落, 实验组浒苔鲜组织用滤纸吸干表面水分, 分别按照 0.8(低添加组)、2.4(中添加组)和7.2 g /L(高添加组)的湿质量添加到浮游植物群落中进行共培养。
实验使用2 L的玻璃三角瓶进行, 培养体系为1 L的浮游植物群落, 培养温度设置为采样点附近海水的温度(24.0±0.5 )℃, 光照强度为3 000 lx, 光暗比L∶D为12 h∶12 h。营养元素添加按照f/2配方进行。
培养瓶每天摇匀 1~2次, 使用雷磁 PHS-3C型pH计(上海精科)测定培养体系的pH, 取出20 mL浮游植物样品, 加入终浓度 2%~5%的甲醛水溶液固定保存, 然后向培养瓶中加入20 mL的50倍f/2营养液母液以补充营养。每2天将浒苔取出, 用滤纸吸干藻体表面水分, 称质量后放回原来的培养瓶中继续培养。
实验结束后, 浮游植物样品的分析使用倒置显微镜(COIC IBE2000)于 160×倍下进行, 根据物种在形态学上的差异进行分类鉴定和数量统计[16]。
1.3 数据处理
浒苔的相对增长率参照如下公式计算[17]:

式中,Ki表示浒苔两次取样之间每天的相对增长速率;Wi表示第i次取样的浒苔湿质量生物量;Wi+1表示第i+1次取样的浒苔湿质量生物量;t为两次取样间隔时间(d)。
浮游植物群落多样性指数采用 Margalef物种丰富度指数(dMa)、Shannon-Weaver物种多样性指数(H)和Pielou物种均匀度指数(J)计算[18]。
方差分析(ANOVA)使用IBM SPSS Statistics 20软件进行, 采用LSD法和Dunnett法进行不同处理之间均值的多重比较。
2 结果
2.1 浮游植物物种组成
实验期间共检出浮游植物28属37种, 其中硅藻24属31种, 甲藻 3属5种, 金藻1属1种(表 1)。在共培养体系中形成优势的物种有: 利玛原甲藻(Prorocentrum lima)、长菱形藻(Nitzschia longissima)、活动齿状藻(Odontella mobiliensis)和新月柱鞘藻(Cylindrotheca closterium)。
共培养期间, 浒苔的湿质量生物量呈现显著的下降趋势, 平均相对增长率在低、中、高3个浒苔添加组分别为(–8.99±4.54)%/d、(–8.63±4.26)%/d 和(–4.92±2.47 )%/d, 且未发现显著性的差异。
2.2 浒苔鲜组织对浮游植物细胞丰度的影响
在10 d的共培养实验期间, 浮游植物总细胞丰度, 在实验组和对照组之间没有显著性差异(表 2)。在第 7天, 总丰度相对高低的变化趋势发生了改变,在对照组丰度继续保持增加, 而在实验组则开始降低(图1)。高添加组的总丰度, 在实验第 3天高达对照组的90倍, 而在第10天则降低到对照组的1.4%。硅藻在整个培养期间, 细胞丰度表现出逐步升高的趋势, 硅藻的生长受到浒苔明显的抑制, 在3个不同的实验组细胞丰度显著降低(P<0.05), 降幅分别达到84.1%、92.1%和 95.3%, 高添加组的硅藻丰度在第10天只有对照组的0.78%。甲藻在共培养期间, 细胞丰度表现出先升高后降低的趋势, 甲藻丰度在实验组高于对照组, 在高添加组增加显著(P<0.05), 细胞丰度平均为对照组的 21.8倍, 特别是在第 3天达到了对照组的98.6倍。硅甲藻比在3个实验组亦出现显著的降低(P<0.05), 在对照组, 硅藻占有绝对的优势, 而在中添加和高添加2个实验组, 硅甲藻比被抑制在<1的水平。

表1 共培养期间的浮游植物物种组成Tab. 1 Phytoplankton species composition during the cocultivation period

表2 不同处理共培养中浮游植物群落结构的变化Tab.2 Changes of phytoplankton community structure in cocultures with different treatment

图1 不同处理共培养中浮游植物细胞丰度的变化Fig. 1 Changes of phytoplankton cell abundance in cocultures with different treatment
2.3 浒苔鲜组织对浮游植物优势种的影响
在共培养实验期间, 浮游植物优势种丰度, 在实验组和对照组之间也表现出不同的变化趋势。利玛原甲藻细胞丰度在共培养期间先升高后降低(图2),高添加组实验期间平均细胞丰度为(6.76±3.61)×105个/L, 显著高于对照组平均丰度(P<0.05), 在第 3天更是高达对照组丰度的98.7倍。长菱形藻在培养期间, 对照组细胞丰度表现出逐步升高的趋势, 而在实验组长菱形藻的生长受到浒苔明显的抑制, 在 3个不同的浒苔添加组细胞丰度显著降低(P<0.05),降幅都在 95%以上, 高添加组的平均细胞丰度只有(0.08±0.01)×105个/L, 在第 10天细胞丰度更是低至对照组的0.38%。活动齿状藻在共培养期间细胞丰度一直保持升高的趋势, 高添加组平均细胞丰度显著低于对照组平均丰度(P<0.05), 在第3天只有对照组丰度的4.2%。新月柱鞘藻的生长也受到了浒苔明显的抑制, 在 3个不同的添加组细胞丰度显著降低(P<0.05), 高添加组的细胞丰度降幅达到 96.1%, 在第10天只有对照组的0.99%。
2.4 浒苔鲜组织对物种丰度组成的影响
在共培养实验期间, 浮游植物物种细胞丰度的百分比组成出现了较大的改变(图 3)。对照组中, 利玛原甲藻丰度比例由实验初始的 75.3%逐渐降低到 0.67%,而长菱形藻丰度比例则由实验初始的4.4%逐渐增加到71.4%。在实验结束时, 利玛原甲藻丰度比例在低、中、高3个浒苔添加组分别降低到13.8%、30.5%和44.4%;长菱形藻丰度比例在实验组没有明显的变化; 活动齿状藻丰度比例明显增加, 在低、中、高3个实验组的第10天分别达到了68.1%、55.7%和21.8%。
2.5 浒苔鲜组织对物种多样性的影响
在整个共培养实验期间, 浒苔添加也影响到了浮游植物群落的多样性水平(图4)。物种丰富度在浒苔高添加组平均为 0.54±0.06, 较对照组显著降低(P<0.05)。物种多样性和物种均匀度的实验期间平均水平, 在实验组和对照组之间没有显著的变化, 但是从共培养的第2天到第6天, 实验组的物种多样性和物种均匀度皆出现了显著的降低。在第3天, 高添加组的物种多样性和物种均匀度水平分别只有对照组的4.4%和4.6%。
3 讨论

图2 不同处理共培养中浮游植物优势种丰度的变化Fig. 2 Cell abundance changes of predominant phytoplankton species in cocultures with different treatment
本研究实验期间, 每天向共培养体系中补充营养液, 并且去除了捕食者的摄食压力, 这使得对照组浮游植物细胞丰度处于良好的指数增长状态。但是浒苔添加组的浮游植物丰度却表现出了先升高后降低的现象。甲藻丰度在共培养前3天迅速增加, 而后出现回落, 且主要为优势种利玛原甲藻所控制。从培养条件来看, 光照和温度处于受控状态, 且 f/2培养液对于原甲藻生长属于富营养化的状态[19], 因此原因可能是实验组前 3天 pH较低的培养液环境所致(图 5)。已有资料显示[20-22], 甲藻对 pH的变化极其敏感, 适宜的pH范围很小, 在7.5~8.0有较高的生长速率。在浒苔与浮游植物群落共培养期间, 3个实验组的浒苔湿质量生物量呈现下降的趋势, 平均相对增长率的结果也表明实验期间浒苔处于负增长的状态。因培养实验所用水体较小, 浒苔藻体的分解会使培养体系的 CO2含量升高, 降低了培养体系的酸碱度, 使甲藻处在了适宜的生长环境, 导致优势种利玛原甲藻大量繁殖, 细胞丰度较对照组显著升高。

图3 不同处理共培养中浮游植物细胞丰度百分比组成的变化Fig. 3 Percentage composition changes of phytoplankton cell abundance in cocultures with different treatment

图4 不同处理共培养中浮游植物多样性的变化Fig. 4 Changes of phytoplankton diversity in cocultures with different treatment
共培养实验发现, 浒苔通过影响浮游植物优势种的生长和演替, 改变了浮游植物的群落结构。实验组的硅甲藻比在整个培养期间一直处于较低的水平,硅藻始终没有占到绝对的优势。浒苔添加组的物种丰富度和多样性水平, 在培养开始后的第2~6天, 处在较低的水平, 这表明浒苔的存在使得浮游植物优势种组成趋于单一, 多样性程度大为降低, 不利于维持健康稳定的群落结构。在自然海域, 浒苔的过量繁殖形成“绿潮”, 导致生态系统结构的改变和生物多样性的丧失[3,23], 也给近海的生态环境带来了有害的影响。
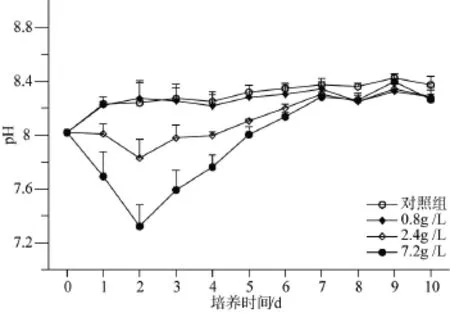
图5 不同处理共培养中pH的变化Fig. 5 Changes of pH value in cocultures with different treatment
大型藻与单细胞浮游植物之间的相互作用, 除了营养竞争(光、营养盐等)以外, 还存在相生相克作用, 即通过向环境中释放化学物质, 彼此之间直接或间接地产生有利或有害的现象[6-7,10,24-25]。实验期间, 硅藻丰度略有升高后, 即一直处于相比对照组较低的水平, 特别是在培养的中后期这种差异更为明显。硅藻优势种长菱形藻的细胞丰度在实验组有很大程度的降低, 这表明浒苔的存在对硅藻的生长产生了明显的抑制作用。由于共培养体系在实验期间一直处于受控的状态, 而且中后期甲藻丰度逐渐回落, 对硅藻不会产生明显的营养竞争, 因此推测浒苔鲜组织内存在克生物质, 对单细胞的硅藻产生了明显的克生作用。对于水体富营养化程度较高的自然海区, 适宜密度的浒苔可以有效地抑制赤潮藻的过度繁殖, 这在赤潮的生物防治和水域环境的生态修复等方面都有着重要的作用。
[1]Tseng C K. Common seaweeds of China [M]. Beijing:Science Press, 1983.
[2]丁兰平, 栾日孝. 浒苔(Enteromorpha prolifera)的分类鉴定、生境习性及分布 [J]. 海洋与湖沼, 2009, 40(1): 68-71.
[3]Fletcher R L. The occurrence of “green tides”: a review[C]//Schramm W, Nienhuis P H. Marine benthic vegetation: recent changes and the effects of eutrophication. Berlin: Springer, 1996: 7-43.
[4]唐启升, 张晓雯, 叶乃好, 等. 绿潮研究现状与问题[J]. 中国科学基金, 2010, 1: 5-9.
[5]周名江, 朱明远. 我国近海有害赤潮发生的生态学、海洋学机制及预测防治研究进展 [J]. 地球科学进展,2006, 21(7): 673-679.
[6]Jin Q, Dong S, Wang C. Allelopathic growth inhibition ofProrocentrum micans(Dinophyta)byUlva pertusaandUlva linza(Chlorophyta)in laboratory cultures [J].European Journal of Phycology, 2005, 40: 31–37.
[7]许妍, 董双林, 于晓明. 缘管浒苔对赤潮异弯藻的克生效应 [J]. 生态学报, 2005, 25(10): 2681–2685.
[8]张善东, 宋秀贤, 王悠, 等. 大型海藻龙须菜与锥状斯氏藻间的营养竞争研究 [J]. 海洋与湖沼, 2005,36(6): 556-561.
[9]王兰刚, 徐姗楠, 何文辉, 等. 海洋大型绿藻条浒苔与微藻三角褐指藻相生相克作用的研究 [J]. 海洋渔业, 2007, 29(2): 103-108.
[10]霍元子, 田千桃, 徐姗楠, 等. 浒苔对米氏凯伦藻生长的克生作用 [J]. 海洋环境科学, 2010, 29(4): 496-508.
[11]孙颖颖, 刘筱潇, 王长海. 浒苔提取物对4种赤潮微藻生长的抑制作用 [J]. 环境科学, 2010, 31(6): 1662-1669.
[12]张建恒, 霍元子, 王阳阳, 等. 浒苔与球等鞭金藻相互抑制的实验验证 [J]. 上海海洋大学学报, 2011,20(2): 211-216.
[13]邱东茹, 吴振斌, 况琪军, 等. 不同生活型大型植物对浮游植物群落的影响 [J]. 生态学杂志, 1998, 17(6): 22-27.
[14]李宵, 杨宇峰, 陈伟洲. 大型海藻龙须菜对浮游植物群落结构影响的实验研究 [J]. 生态科学, 2009, 28(2): 102-106.
[15]Guillard R R L, Ryther J H. Studies on marine planktonic diatoms. I.Cyclotella nanaHustedt andDetonula confervaceae(Cleve)Gran [J]. Canadian Journal of Microbiology, 1961, 8: 229-239.
[16]Tomas C R. Identifying marine phytoplankton [M]. San Diego: Academic Press, 1997.
[17]李瑞香, 吴晓文, 韦钦胜, 等. 不同营养条件下浒苔的生长 [J]. 海洋科学进展, 2009, 27(2): 211-216.
[18]孙军, 刘东艳. 多样性指数在海洋浮游植物研究中的应用 [J]. 海洋学报, 2004, 26(1): 62-75.
[19]张淑雯, 欧林坚, 吕颂辉, 等. 光照及营养盐对3种赤潮甲藻吞噬营养行为的影响 [J]. 海洋科学, 2011, 35(4): 94-99.
[20]Schmidt L E, Hansen P J. Allelopathy in the prymnesiophyteChrysochromulina polylepis: effect of cell concentration, growth phase and pH [J]. Marine Ecology Progress Series, 2001, 216: 67-81.
[21]邓光, 李夜光, 胡鸿钧, 等. 温度、光照和pH值对锥状斯氏藻和塔玛亚历山大藻光合作用的影响及光暗周期对其生长速率和生物量的影响 [J]. 武汉植物学研究, 2004, 22(2): 129-135.
[22]Hansen P J, Lundholm N, Rost B. Growth limitation in marine red-tide dinoflagellates: effects of pH versus inorganic carbon availability [J]. Marine Ecology Progress Series, 2007, 334: 63-71.
[23]Valiela I, McClelland J, Hauxwell J, et al. Macroalgal blooms in shallow estuaries: Controls and ecophysiological and ecosystem consequences [J]. Limnology and Oceanography, 1997, 42(5): 1105-1118.
[24]Keating K I. Allelopathic influence on blue-green bloom sequence in a eutrophic lake [J]. Science, 1977, 196: 885-887.
[25]俞子文, 孙文浩, 郭克勤, 等. 几种高等水生植物的克藻效应 [J]. 水生生物学报, 1992, 16(1): 1-7.
