中国明对虾血蓝蛋白C末端片段在毕赤酵母中的表达及其抗菌活性
2013-10-13邱楚雯王宝杰蒋克勇孙姝娟孟晓林骆作勇
邱楚雯 , 刘 梅 王宝杰 蒋克勇 孙姝娟 孟晓林 , 骆作勇 , 王 雷
(1. 中国科学院 海洋研究所, 山东 青岛266071; 2. 中国科学院大学, 北京100049)
根据联合国粮农组织(FAO)数据统计结果显示,自20世纪80年代初以来全球对虾养殖产量不断增加[1], 越来越多的消费者把虾作为重要的蛋白质来源。目前虾捕捞产量未见明显增长, 消费者日益增长的需求量主要是通过水产养殖来满足的。然而高密度养殖虾导致了许多问题, 其中最为严重的是病毒、细菌和真菌病原体的感染性疾病。中国明对虾(Fenneropenaeus chinensis)是中国主要的虾类养殖品种之一。中国明对虾养殖过程中疾病的爆发严重影响养殖产业的发展。因此, 迫切需要找到有效的方法来防止和抑制虾类养殖过程中疾病的发生[2]。
血蓝蛋白是节肢动物和软体动物血淋巴中的呼吸蛋白, 由 3个结构域构成, 分别是 hemocyanin_N结构域, hemocyanin_M结构域和hemocyanin_C结构域[3]。第1个和第个3结构域分别为蛋白的N端和C端, 第 2个结构域为血蓝蛋白的活性部位。近年来,研究表明血蓝蛋白不仅参与氧的运输, 而且还参与能量储存, 维持渗透压, 蜕皮调控, 伤口愈合以及黑色素的合成。值得注意的是Destoumieux等[4-5]研究发现南美蓝对虾(Penaeus stylirostris)和凡纳滨对虾(Penaeus vannamei)的血蓝蛋白及其降解片段参与非特异性免疫活动。因此, 血蓝蛋白被认为有抗菌活性。
抗菌肽(Antimicrobial peptide, AMPs)是生物体内产生的小肽类物质, 在先天性免疫反应中发挥重要作用, 其抗菌谱广, 对细菌、真菌、病毒等均有抑制作用。抗菌肽直接破坏膜的稳定性并产生穿孔或裂解, 引起内容物泄露, 导致细胞死亡[6]。自从Steiner等[7]首先在巨型蚕蛾中发现了天蚕素cecropin抗菌肽之后, 越来越多的抗菌肽被发现或预测出来。根据氨基酸组成、分子大小和结构的不同, 将抗菌肽分为几种类型, 其中包括α-螺旋、β-折叠结构的抗菌肽等[8]。常见的抗菌肽多为阳离子抗菌肽(Cationic AMPs (CAMPs))。而Lai等[9]根据蟾蜍的基因序列克隆并合成了抗菌肽 Maximin H, 发现它是具有与阳离子抗菌肽类似功能的阴离子抗菌肽(Anionic AMPs(AAMPs))。
目前, 在脊椎动物、无脊椎动物和植物体内均发现有阴离子抗菌肽。阴离子抗菌肽是动植物体内先天性免疫系统的重要组成部分[10]。阴离子抗菌肽的净 电 荷 从 –1 到 –7, 由 5~70 个 残 基 构 成[11]。Destoumieux等[4]研究表明血蓝蛋白的C-端片段具有阴离子抗菌肽活性。基于血蓝蛋白 C端片段的抑菌活性, 本研究利用真核表达系统重组表达中国明对虾血蓝蛋白 C端基因片段。与传统的分离与纯化抗菌肽相比, 真核表达系统具有许多优点, 如产量高,易于纯化, 培养基成分简单, 成本较低[12]。作为真核生物, 毕赤酵母具有高等真核表达系统的许多优点,如蛋白加工、折叠、翻译后修饰等。不仅如此, 毕赤酵母(Pichia pastoris)具有与酿酒酵母相似的分子及遗传操作优点, 且它的外源蛋白表达水平是后者的10倍以至 100倍, 这使得毕赤酵母成为非常有用的蛋白表达系统。实际上, 已有利用毕赤酵母表达系统重组表达抗菌肽的报道[13-16]。本研究构建了中国明对虾血蓝蛋白-C端的部分片段(FcHC-C1和FcHC-C2)的毕赤酵母表达体系, 并初步研究这两种重组多肽片段的抗菌活性。
1 材料与方法
1.1 实验材料
1.1.1 菌株、质粒、引物
毕赤酵母表达菌株GS115购自Invitrogen 公司,大肠杆菌Top10来自于本实验室。改造的pPIC9K酵母表达载体由中国科技大学周丛照教授馈赠。引物均由上海生工生物工程技术服务有限公司合成, 引物序列见表1。2个基因片段(FcHC-C1和FcHC-C2)在中国明对虾血蓝蛋白基因FcHC(GenBank登录号:FJ594414)的相对位置分别为1741~1947和1936~2055,基因序列可参见NCBI数据库。

表1 引物序列Tab.1 Primer sequences
1.1.2 工具酶及主要试剂
Taq DNA Polymerase 购自TIANGEN公司、T4 DNA Ligase 购自 MBI公司,EcoR I、SaII、BamH I工具酶购自大连宝生物公司, Tris、EDTA、核酸marker 、蛋白 marker、Agarose、Tryptone、Yeast Extract、Biotin、YNB、山梨醇、dNTP、UNIQ-10柱式DNA胶回收试剂盒等购自上海生工生物工程技术服务有限公司。
1.2 实验方法
1.2.1 表达载体的构建
本实验室已从中国明对虾肝胰腺中克隆出血蓝蛋白基因FcHC的全长cDNA序列(GenBank登陆号:FJ594414), 根据中国明对虾血蓝蛋白 cDNA序列设计特异性引物, 克隆两个FcHC-C端片段, 分别命名为FcHC-C1和FcHC-C2。引物CPF23E/CPR23B和CPF13E/CPR13B 分别用来扩增FcHC-C1和FcHC-C2。正向引物含有EcoR I限制性酶切位点, 反向引物包含BamH I限制性酶切位点。PCR条件如下:95 ℃预变性5 min; 95 ℃变性30 s, 60℃退火30 s, 72 ℃延伸30 s, 36个循环; 72 ℃继续延伸10 min。用限制性内切酶EcoR I和BamH I分别对纯化后的PCR片段和含有组氨酸(His)标签的质粒 pPIC9K进行双酶切, 采用 DNA凝胶回收试剂盒回收酶切片段, 采用T4 DNA连接酶连接酶切产物。连接产物分别转化Escherichia coliTop10感受态细胞, 通过筛选获得重组酵母表达载体pPIC9K-FcHC-C1和pPIC9K-FcHC-C2。用上游α-Factor引物(TACTATTGCCAG CATTG CTGC)为测序引物, 对重组载体进行测序鉴定。
1.2.2 pPIC9K/FcHC-C转化P. pastorisGS115及高拷贝转化子筛选
用SalⅠ酶切重组质粒 pPIC9K-FcHC-C, 根据Invirogen公司毕赤酵母表达手册, 采用PEG法将重组子转化到毕赤酵母 GS115感受态细胞中, 并将转化后的毕赤酵母GS115感受态细胞涂布于MD生长培养基上, 30 ℃培养约2 d, 直至克隆出现。吸取2 mL无菌水收集 MD平板上的转化子。一定浓度的转化子涂布于含有不同浓度G418(0.5, 1.0, 1.5, 和2.0 g/L)的YPD(1%酵母提取物, 2%蛋白胨, 2%葡萄糖, 2%琼脂)平板上, 30 ℃孵育2~5 d。挑取单菌落至YPD液体培养基, 30 ℃培养 24 h后提取 DNA, 用AOX-F/AOX-R 引物(表 1)进行 PCR 鉴定, 使用pPIC9K空质粒转化的毕赤酵母菌做阴性对照。
1.2.3 重组毕赤酵母GS115诱导表达FcHC-C
将筛选出的阳性克隆接种于50 mLBMGY培养基中(1%酵母提取物, 2%蛋白胨, 1.34%YNB, 1%甘油和0.4 g/ L的生物素和1%磷酸钾缓冲液)[15], 28℃,转速230 rpm条件下培养约 20 h, 直到培养物达到A600为2~5。培养物通过5 000 r/min离心5 min收集菌体。菌体用50 mL BMMY培养基(1%酵母提取物,2%蛋白胨, 1.34% YNB, 0.5%甲醇和0.4 mg/mL的生物素和1%磷酸钾缓冲液)重新悬浮于500 mL三角瓶中28℃培养, 转速为230 rpm。每24 h添加甲醇溶液(100%)至最终质量分数为0.5%。
1.2.4 重组蛋白rFcHC-C1和rFcHC -C2的纯化及鉴定
将培养96 h后的菌液, 12 000 r/min离心20 min,收集上清液, 上样于用 20 mmol/L磷酸钠, 0.5 mol/L氯化钠, 20 mmol/L 咪唑(pH7.4)预平衡后的His-GraviTrap柱子, 用20 mmol/L磷酸钠, 0.5 mol/L氯化钠, 500 mmol/L咪唑(pH7.4)洗脱。纯化的重组蛋白FcHC-C1和FcHC-C2透析脱盐处理, 最终冻干备用。按Western blotting 常规方法制胶, 将纯化后样品经Tricine-SDS-PAGE电泳[17]后, 30 V恒压15 min转移到硝酸纤维素膜上, 室温下封闭1 h后加入一抗(兔抗His抗体 1: 50000比例), 4℃放置12 h以上。弃一抗, 用TBST洗膜4次。加入二抗(羊抗兔抗体1: 2000比例),平稳摇动, 室温下1 h。弃二抗, TBST洗膜4次。加入显色液后避光显影至出现条带后终止反应[18]。
1.2.5 重组蛋白rFcHC-C1和 rFcHC-C2的抗菌活性检测
对纯化后的重组蛋白rFcHC-C1和rFcHC-C2进行抑菌活性鉴定。指示菌包括革兰氏阳性细菌如藤黄微球菌(Micrococcus luteus), 革兰氏阴性细菌如鳗弧菌(Vibrio anguillarum)、嗜水气单胞菌(Aeromonas hydrophila)以及铜绿假单胞菌(Pseudomonas aeruginosa), 真菌如尖孢镰刀菌(Fusarium oxysporum)、终极霉菌(Pythium ultimum)、灰霉病菌(Botrytis cinerea)、柑桔绿霉病菌(Pestalotia diospyri)、黄瓜炭疽病菌(Colletotrichum orbiculare)以及核盘菌(Sclerotinia sclerotiorum), 共10种菌。最小抑菌浓度(MIC)测定方法如下[19-21]: 将纯化后的重组蛋白用 0.01%的乙酸和 0.2%的牛血清白蛋白稀释成适当倍数之后, 取10 μL样品加入96孔板中, 同时加入 100 μL LB 培养基培养的细菌(2×105~7×105个/mL)或者加入80 μL PDB培养基培养的真菌孢子(104个/mL)。30℃振摇培养24 h后, 在600 nm下用酶标仪测定吸光值。
2 结果
2.1 pPIC9K-FcHC-C载体构建
以本实验室保存的血蓝蛋白(FcHC)cDNA为模板, PCR扩增血蓝蛋白基因的2个C末端基因片段FcHC-C1和FcHC-C2, 琼脂糖凝胶电泳检测可见在100~250 bp有两个不同大小的条带。FcHC-C1片段大小与预计的207 bp相符。FcHC-C2片段大小则与预计的120 bp相符(图1)。胶回收的PCR产物酶切后连接到载体 pPIC9K。测序结果表明插入的外源基因与FcHC-C1和FcHC-C2序列相符, 重组 pPIC9KFcHC-C1与pPIC9K-FcHC-C2载体构建成功。

图1 FcHC-C基因片段的PCR扩增Fig.1 PCR product of FcHC-C
2.2 PCR鉴定转化子
pPIC9K/FcHC-C1、pPIC9K/FcHC-C2和 pPIC9K分别通过SalI酶切线性化之后采用 PEG法转化GS115感受态细胞, 挑取单菌落至YPD液体培养基,30℃培养24 h后提取DNA, 用AOX-F/AOX-R引物进行PCR鉴定。琼脂糖凝胶电泳显示阳性转化子扩增出两个条带(图 2)。重组菌 GS115/pPIC9KFcHC-C1扩增出约700 bp(pPIC9K上下游引物之间序列长度与插入目的基因长度之和)和2.2 kb(AOX1)条带; 重组菌 GS115/pPIC9K-FcHC-C1扩增出约610 bp和2.2 kb(AOX1)条带。表明重组载体pPIC9K/FcHC-C已经成功整合到酵母基因组DNA上。
2.3 FcHC-C1和 FcHC-C2在毕赤酵母中的表达
挑取G418质量浓度为2 g/L的YPD平板上的单菌落, 甲醇诱导表达 96 h后, 发酵液经过离心取上清液通过His-GraviTrap柱纯化后的样品通过蛋白凝胶电泳Tricine-SDS-PAGE, 可见在大约7 ku和5 ku附近出现条带(图3)。条带大小与预计大小有些偏差是由于 SDS-PAGE蛋白电泳过程中, 蛋白的迁移受许多因素的影响, 蛋白电泳显示的蛋白大小是蛋白的表观大小并非实际大小, 蛋白大小的偏差的具体原因有待进一步验证[22]。凝胶电泳 Tricine-SDS-PAGE结果表明外源基因在毕赤酵母系统中已表达, Western Blot分析结果也发现目的条带表明血蓝蛋白C端的两个片段(FcHC-C1和FcHC-C2)成功表达。
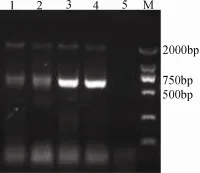
图2 PCR鉴定重组载体整合入酵母基因组Fig.2 PCR Analysis of Pichia Integrants

图3 纯化的rFcHC-C1和rFcHC-C2的Tricine-SDS-PAGE分析Fig.3 Tricine-SDS-PAGE analysis of the expressed FcHCC1 and FcHC-C2
2.4 表达产物抗菌活性检测
采用多种细菌和真菌对毕赤酵母重组表达产物rFcHC-C1和rFcHC-C2进行抗菌活性检测, 所采用的指示菌包括6种真菌、1种革兰氏阳性细菌和3种革兰氏阴性细菌。结果表明 rFCHc-C1和rFcHC-C2具有一个相对宽的抗菌谱(表 2)。rFcHC-C1对黄瓜炭疽病菌、尖孢镰刀菌最小抑菌浓度 MIC 分别为 1.1~2.1 μmol/L、10.6~21.2 μmol/L。rFcHC-C2对灰霉病菌和黄瓜炭疽病菌的最小抑菌浓度MIC为1.3~2.6 μmol/L, 而对尖孢镰刀菌的最小抑菌浓度 MIC 为 13.0~26.0 μmol/L。rFcHC-C1和 rFcHC-C2对其他指示真菌抑菌活性较弱(MICrFcHC-C1>21.2 μmol/L 和 MICrFcHC-C2>26.0 μmol/L)。rFcHC-C1和rFcHC-C2可以抑制革兰氏阳性细菌-藤黄微球菌生长。然而, 这两种重组蛋白对3种革兰氏阴性菌抑菌效果比革兰氏阳性菌和部分真菌弱。
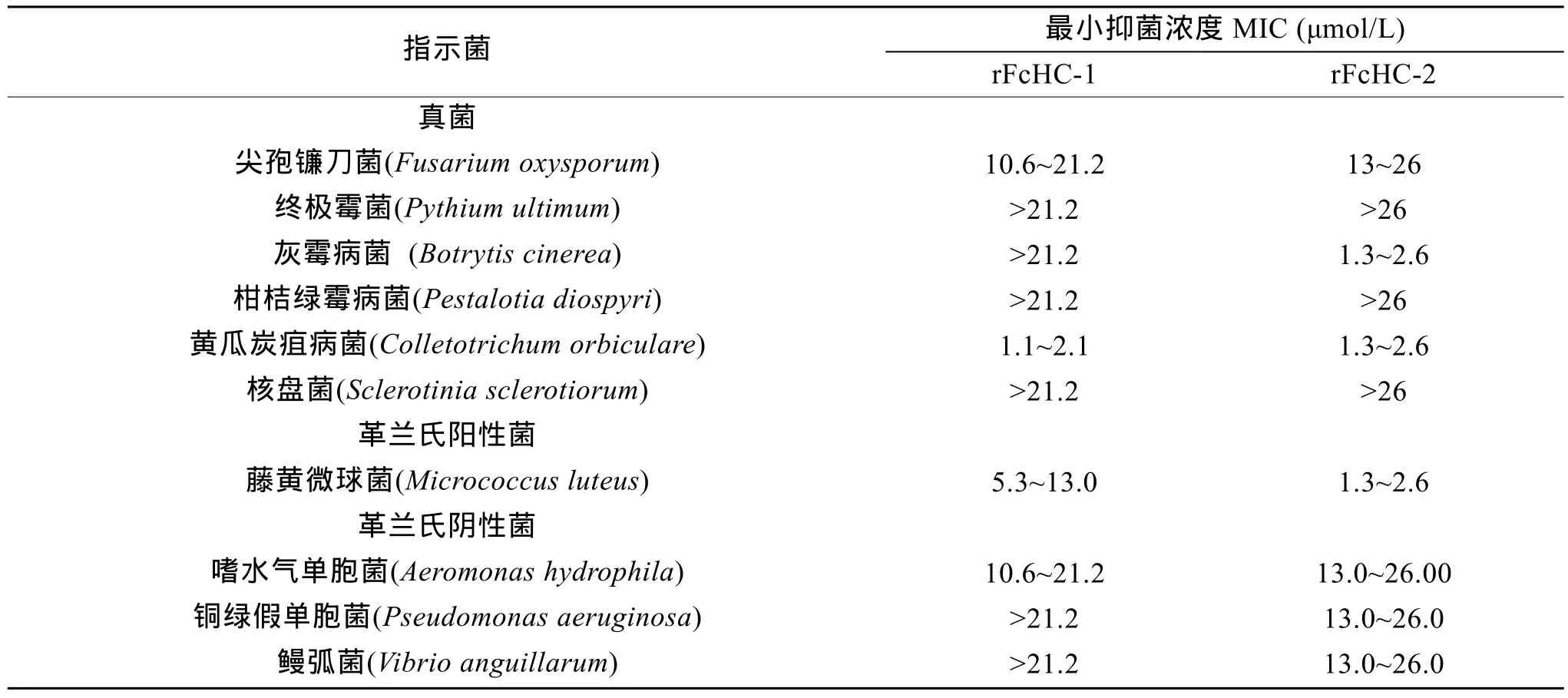
表2 重组抗菌肽FcHC-C1和FcHC-C2最小抑菌浓度(MIC)Tab.2 Minimal growth inhibition concentrations (MIC)of rFcHC-C1 and rFcHC-C2
3 讨论
目前, 甲壳类动物, 如南美白对虾[23]、斑节对虾[24]血蓝蛋白的基因已被克隆并测序。本课题组已经克隆到中国明对虾血蓝蛋白 cDNA全长, 并命名为FcHC(GenBank登录号: FJ594414)。Destoumieux等研究表明血蓝蛋白不仅负责氧气输送, 而且血蓝蛋白及其降解片段参与各种先天免疫活动, 其中血蓝蛋白的C-端参与抗菌肽的形成和释放。Destoumieux等从南美蓝对虾(P. stylirostris)血清中纯化抗菌肽PsHCt1和PsHCt2; 在凡纳滨对虾(P. vannamei)血清中发现抗菌肽PvHCt, 这3种血蓝蛋白抗菌肽具有很强的抗真菌活性[4]。将 2个血蓝蛋白 C末端片段(FcHC-C1和FcHC-C2)与Destoumieux等分离纯化出的抗菌肽(PsHCt1、PsHCt2和 PvHCt)序列比对结果显示本研究中 FcHC-C1氨基酸序列(FcHCC1--LVVAVTDGEADAAVEGLHDNTDFIHYGSHGK YPDNRPHGYPLD)与PsHCt1和PsHCt2有 67.7%和69.7%的相似性; FcHC-C2的氨基酸序列(FcHC-C2--FEVLPNFKHIQVKVFNHGEHIHHH)与PvHCt有91.3%的相似性。因此推断中国明对虾血蓝蛋白 C-端可能具有潜在的抗菌活性, 其具体功能尚待阐明。甲壳类抗菌肽主要有3种类型, 分别是对虾素(Penaeidins)、甲壳素(Crustins)和抗脂多糖因子(Anti-lipopolysaccharide factor)[25-27]。其中大部分抗菌肽为阳离子抗菌肽, 而阴离子抗菌肽的研究较少。FcHC-C1和FcHC-C2序列编码蛋白的等电点估计为5.08和 6.77。阴离子抗菌肽的净电荷从–1到–7, 由5~70个残基构成[11], 因而推断 rFcHC-C1 和rFcHC-C2为阴离子抗菌肽。这为甲壳类动物阴离子抗菌肽的研究提供参考。
毕赤酵母菌株 GS115的分泌表达系统, 是通过信号肽 α-factor, 使外源蛋白实现胞外表达[28], 分泌表达的外源蛋白通过Kex2和Ste13酶切α-factor, 从而形成成熟肽, 有利于外源蛋白的纯化利用。同时外源基因是整合到毕赤酵母基因组中, 有利于表达系统的保存[29]。由此表明, 本研究通过毕赤酵母真核表达系统用于表达血蓝蛋白-C端抗菌 FcHC-C1和FcHC-C2具有可行性。
毕赤酵母重组表达的抗菌肽 rFcHC-C1和rFcHC-C2抗菌活性检测结果与Destoumieux等纯化出的抗菌肽PsHCt1, PsHCt2和PvHCt活性类似[4]。PsHCt1, PsHCt2和PvHCt的等电点为5.65~6.54, 为阴离子抗菌肽, 主要表现为抗真菌活性; rFcHC-C1和rFcHC-C2预测等电点为5.08和6.77, 也是阴离子抗菌肽。rFcHC-C1和rFcHC-C2对真菌抑菌活性分析表明, 两者对黄瓜炭疽病菌作用效果最好, 其次是尖孢镰刀菌和灰霉病菌。然而 rFcHC-C1和rFcHC-C2也表现出抗细菌的活性, 它们对革兰氏阳性细菌抑菌效果优于革兰氏阴性细菌。此外根据最小抑菌浓度大小, rFcHC-C2抑菌活性整体强于rFcHC-C1, 推测原因可能是由于 rFcHC-C2的等电点更接近于 7.0, 表现出了阳离子抗菌肽的广谱抗菌性。在毕赤酵母菌株GS115甲醇诱导表达过程中, 酵母细胞生长缓慢, 上清液有一定黏性, 空白对照无此现象, 表明这两种重组表达蛋白对表达宿主有一定的抑制活性。
总之, 本研究通过毕赤酵母表达系统重组表达中国明对虾血蓝蛋白-C端基因, 并研究表明此 2种阴离子抗菌肽抗菌活性较好; 可用于有植物和水生动物疾病控制。然而, 中国明对虾血蓝蛋白 C末端片段在对虾免疫防御机制中的功能有待进一步研究。中国明对虾血蓝蛋白 C末端片段如何参与免疫反应, 并在免疫系统中扮演的角色尚存在疑问。深入研究中国明对虾血蓝蛋白 C末端抗菌肽在抗病反应中的作用方式, 如何生产更多的抗菌肽FcHC-C对疾病的预防有深远的影响。
[1]Flegel T W, Lightner D V, Lo C F, et al. Shrimp disease control: past, present and future[J]. Diseases in Asian Aquaculture VI. Fish Health Section, Asian Fisheries Society. Manila, Philippines, 2008: 355-378.
[2]Lightner D V, Redman R M. Shrimp diseases and current diagnostic methods[J]. Aquaculture, 1998, 164:201-220.
[3]Stoeva S, Idakieva K, Georgieva D N, et al.Penaeus monodon(tiger shrimp)hemocyanin: subunit composition and thermostability[J]. Zeitschrift fur Naturforschung C,2001, 56: 416-422.
[4]Destoumieux-Garzón D, Saulnier D, Garnier J, et al.Crustacean Immunity[J]. Journal of Biological Chemistry,2001, 276: 47070-47077.
[5]Zhang X B, Huang C H, Qin Q W. Antiviral properties of hemocyanin isolated from shrimpPenaeus monodon[J]. Antiviral Research, 2004, 61: 93-99.
[6]Smith V J, Desbois A P, Dyrynda E A. Conventional and unconventional antimicrobials from fish, marine invertebrates and micro-algae[J]. Marine Drugs, 2010,8: 1213-1262.
[7]Steiner H, Hultmark D, Engström Å, et al. Sequence and specificity of two antibacterial proteins involved in insect immunity[J]. Nature, 1981, 292: 246-248.
[8]Lai Y P, and Gallo R L. AMPed up immunity: how antimicrobial peptides have multiple roles in immune defense[J]. Trends in Immunology, 2009, 30: 131-141.
[9]Lai R, Liu H, Hui Lee W, et al. An anionic antimicrobial peptide from toadBombina maxima[J]. Biochemical and Biophysical Research Communications, 2002, 295:796-799.
[10]Harris F, Dennison S R, Phoenix D A. Anionic antimicrobial peptides from eukaryotic organisms[J].Current Protein and Peptide Science, 2009, 10:585-606.
[11]Diego-García E, Batista C V F, García-Gómez B I, et al.The Brazilian scorpionTityus costatusKarsch: genes,peptides and function[J]. Toxicon, 2005, 45: 273-283.
[12]Li L, Wang J X, Zhao X F, et al. High level expression,purification, and characterization of the shrimp antimicrobial peptide, Ch-penaeidin, inPichia pastoris[J].Protein Expression and Purification, 2005, 39: 144-151.
[13]Jin F, Xu X, Wang L, et al. Expression of recombinant hybrid peptide cecropinA(1-8)-magainin2(1-12)in Pichia pastoris: purification and characterization[J].Protein Expression Purification, 2006, 50 (2): 147-156.
[14]Li L, Wang J X, Zhao X F, et al. High level expression,purification, and characterization of the shrimp antimicrobial peptide, Ch-penaeidin, in Pichia pastoris[J].Protein Expression Purification, 2005, 39 (2): 144-151.
[15]Yu X, Li Z, Xia X, et al. Expression and purification of ancrod, an anticoagulant drug, in Pichia pastoris[J].Protein Expression Purification, 2007, 55 (2): 257-261.
[16]Bhanot V, Balamurugan V, Bhanuprakash V, et al.Expression of P32 protein of goatpox virus in Pichia pastoris and its potential use as a diagnostic antigen in ELISA[J]. Journal of Virological Methods, 2009, 162(1-2): 251-257.
[17]Schägger H, Von Jagow G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa[J].Analytical Biochemistry, 1987, 166: 368-379.
[18]陈小芳, 陈显凌, 邹起练. 纤维连接蛋白C端肝素结合域多肽在毕赤酵母中的表达、纯化及鉴定[J]. 生物工程学报, 2012, 28 (10): 1265-1273.
[19]Bulet P, Dimarcq J, Hetru C, et al. A novel inducible antibacterial peptide of Drosophila carries an O-glycosylated substitution[J]. Journal of Biological Chemistry, 1993, 268 (20): 14893-14897.
[20]Hetru C, Bulet P. Strategies for the isolation and characterization of antimicrobial peptides of invertebrates[J]. Methods in Molecular Biology, 1997, 78:35-50.
[21]Nakamura T, Furunaka H, Miyata T, et al. Tachyplesin, a class of antimicrobial peptide from the hemocytes of the horseshoe crab (Tachypleus tridentatus). Isolation and chemical structure[J]. Journal of Biological Chemistry, 1988, 263 (32): 16709-16713.
[22]Ferguson, K. Starch-gel electrophoresis-application to the classification of pituitary proteins and polypeptides[J].Metabolism, 1964, 13(10): p. 985-1002.
[23]Sellos D, Lemoine S, Van Wormhoudt A. Molecular cloning of hemocyanin cDNA fromPenaeus vannamei(Crustacea, Decapoda): structure, evolution and physiological aspects[J]. FEBS Letters, 1997, 407:153-158.
[24]Sritunyalucksana K, Cerenius L, Söderhäll K. Molecular cloning and characterization of prophenoloxidase in the black tiger shrimp,Penaeus monodon[J]. Developmental& Comparative Immunology, 1999, 23: 179-186.
[25]Destoumieux D, Munoz M, Bulet P, et al. Penaeidins, a family of antimicrobial peptides from penaeid shrimp(Crustacea, Decapoda)[J]. Cellular and Molecular Life Sciences, 2000, 57: 1260-1271.
[26]Smith V J, Fernandes J M O, Kemp G D, et al. Crustins:enigmatic WAP domain-containing antibacterial proteins from crustaceans[J]. Developmental & Comparative Immunology, 2008, 32: 758-772.
[27]Cerenius L, Jiravanichpaisal P, Liu H P, et al.Crustacean immunity[J]. Invertebrate Immunity 2010,708: 239-259.
[28]Brake A J, Merryweather J P, Coit D G, et al.Alpha-factor-directed synthesis and secretion of mature foreign proteins in Saccharomyces cerevisiae[J].Proceedings of the National Academy of Sciences of the United States of America, 1984, 81 (15):4642-4646.
[29]Cereghino G P L, Cregg J M. Applications of yeast in biotechnology: protein production and genetic analysis[J].Current Opinion in Biotechnology, 1999, 10 (5): 422-427.
