电渗析法浓缩低浓度含铜废水
2013-10-11瞿广飞吴淼淼
瞿广飞,吴淼淼,宁 平,郭 辉
(昆明理工大学环境科学与工程学院,云南 昆明 650500)
含铜废水通常来源于电镀、化工、印染、染料生产、有色冶炼、有色金属矿山开采、电子材料漂洗废水等过程,其作为工业废水之一受到了广泛关注[1-2]。铜离子进入环境后不能被生物降解,只能发生迁移和形态转化,往往参与食物链循环并最终在生物体内富集,破坏生物体正常生理代谢活动[3],对生态环境和人体健康危害极大[4-7]。目前,常用的含铜废水处理方法主要有化学法、吸附法[8]、离子交换法、反渗透法、电渗析法[9-11]。化学法需要向水中加入大量化学药剂,且产生大量的污泥,出水含盐量高,难以回用,出水外排有可能造成二次污染同时浪费宝贵的水资源;吸附法所采用的多数吸附剂吸附容量较小,吸附速率较低,吸附饱和后再生困难;离子交换树脂需要经常使用大量酸碱再生,操作不便,无法连续工作且对环境污染较重;反渗透由于本身工艺要求高,因而其应用受到限制;而电渗析不适合处理稀溶液,出水往往难以达到排放标准。本论文针对电渗析法处理稀溶液难以达标的问题,在实验室中以低浓度含铜离子废水为研究对象,考察电渗析浓缩过程中直流电压、极板间距、通电时间等因素对去除效率的影响,并分析其原因。
1 实验部分
1.1 实验装置
实验采用自制的电渗析装置,如图1 所示。聚乙烯异相离子交换膜(北京畅源宏业净水技术有限公司)由隔板固定在反应装置内。实验采用不锈钢电极作为阴极、阳极,所需直流电由直流稳压稳流电源提供,在通电情况下对含铜废水进行电渗析浓缩实验。
1.2 实验原理
电渗析过程中,在直流电场的作用下,以电位差为动力,离子透过选择透过性膜迁移,从而使电解质离子自溶液中部分分离出来。本实验的实验原理如图2所示。

在外加电压作用下,浓室不断接收清室中的铜离子,使浓室中铜离子浓度不断升高,而清室中的阴离子与阳离子则分别穿过阴膜以及阳膜迁离清室,使清室中铜离子浓度不断下降。结果是消耗外加电源电能,达到浓缩含铜废水的目的。
1.3 实验方法
1.3.1 实验过程
本实验采用间歇式反应,在室温条件下,分别用硫酸铜配制不同浓度的含铜废水,并进行单因素实验研究。通过改变负载电压、通电时间和极板间距对废水进行电渗析浓缩。各实验条件下,清室与浓室出水量比例为2∶1。根据《二乙基二硫代氨基甲酸钠分光光度法》(HJ 485—2009)检测溶液中Cu2+浓度(可见光分光光度计722E型,上海光谱仪器有限公司)。通过比较不同条件下处理前后的指标变化,得出最佳工艺操作条件。
1.3.2 实验效果评价与计算
根据实验要求,定时采集水样,测取吸光度值,并由式(1)计算铜离子的浓度。去除率Re(removal efficiency)由式(2)计算。浓缩倍数Ef(enrichment factor)由式(3)计算。

式中,C为水样中Cu2+含量,mg/L;y为测得的吸光度值;V为水样体积,mL;C0为进水水样中Cu2+浓度,mg/L;Ct为电渗析一定时间后水样中Cu2+浓度,mg/L;Cc为浓室中Cu2+的浓度,mg/L。
2 结果与讨论
2.1 极板间距的影响
配制Cu2+浓度为40.37~40.46 mg/L的废水进行实验。以极板间距作为孤立变数,考察极板间距对去除效率等指标的影响。在pH值为7、温度20℃、直流电压为8 V、通电时间为2 h时,结果如图3、图4所示。
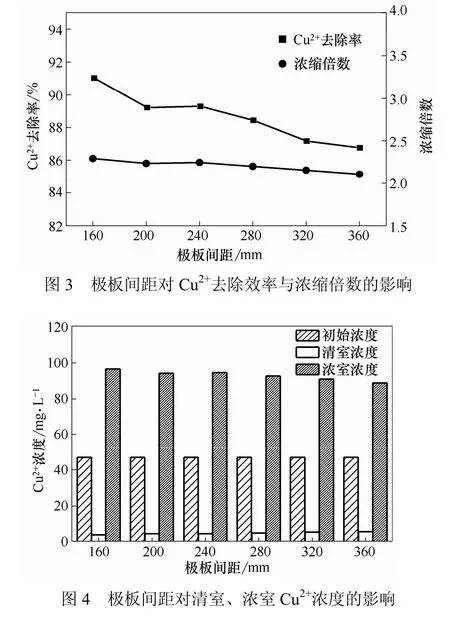
由图3可以看到,随着极板间距的增大,去除效率与浓缩倍数缓慢降低。当极板间距从 160 mm增大至360 mm时,Cu2+去除率下降了约4个百分点,而浓缩倍数减小0.3左右。极板间距的变化对去除率有一定影响,其原因是极板间距增大,电场的强度减弱,使得离子迁移的速度减慢,通过选择性透过膜的离子数量减少,从而去除效率降低。从图4直观比较清室和浓室中Cu2+浓度的变化得出,在上述极板间距变化内,清室与浓室中Cu2+浓度变化较小,说明极板间距的影响较小。考虑到后续实验,选择极板间距360 mm。
2.2 通电时间对浓缩的影响
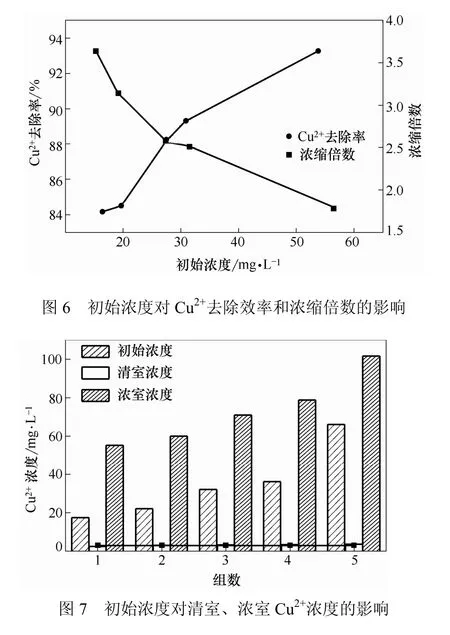
通电时间对含铜废水的去除效率有显著影响。选择低浓度含铜废水(14.84~14.91 mg/L)进行实验研究,以通电时间作为孤立变量,考察通电时间对Cu2+去除效率和浓缩倍数的影响。pH值为7、温度20 ℃、极板间距360mm、直流电压为6 V时,实验结果如图5所示。
由图5可以看出,通电时间对电渗析浓缩重金属有显著的影响。随着通电时间的增长,在浓室中的离子,由于离子交换膜的阻挡无法迁出,浓室还要接受相邻淡室迁来的离子,离子愈积愈多,去除效率与浓缩倍数成线性增长。同时随着通电时间的延长,势必增加能耗以及反应器容积,对于实际应用来说,较短的反应时间更加有利。
2.3 初始浓度对浓缩的影响
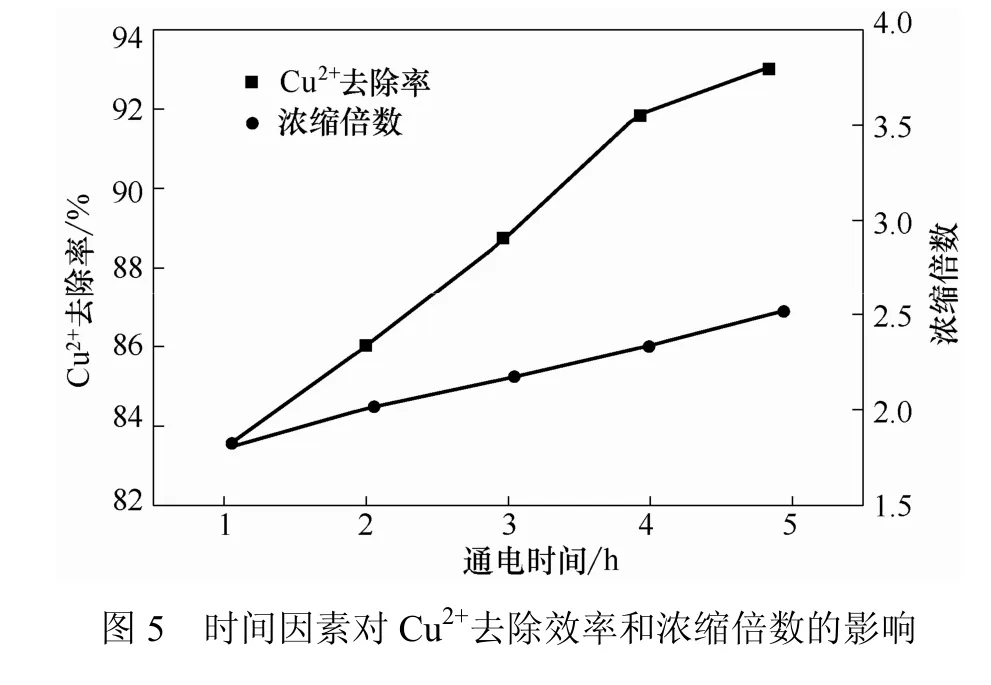
考察在pH值为7、温度20 ℃、直流电压6V、极板间距360 mm、通电时间5h时,含铜废水初始浓度对Cu2+去除效率和浓缩倍数的影响,如图6所示。
由图6可看出,含铜废水的初始浓度对电渗析去除效率和浓缩倍数影响较大。随着初始浓度的增加,去除效率逐渐增大,而浓缩倍数呈明显下降趋势。从图7可以看到,清室Cu2+浓度随初始浓度增加缓慢增加,其值均在3.0 mg/L左右。可见,初始浓度在10~60 mg/L范围内对清室Cu2+浓度影响较小。
2.4 直流电压对去除效率的影响
选择低浓度含铜废水(14.84~14.91 mg/L)进行实验研究。以直流电压作为孤立变量,考察直流电压对去除效率的影响。在pH值为7、温度20 ℃、极板间距360 mm、通电时间为1 h时,Cu2+去除效果如图8、图9所示。
实验结果如图8、图9所示,直流电压对浓缩效果影响较大。由图8可以看到,当直流电压从2 V变化到6 V时,去除效率几乎成线性增长,6 V变化到8 V时,去除效率增长减缓,当电压增加到8 V时,去除效率最高。从图9可以看到,在电压为8 V时,清室Cu2+浓度最低,同时浓室Cu2+浓度最高。研究证明,传质驱动力随着电压的增加而增大,同时溶液电阻率减小,这样可以加速离子迁移以及电沉积[12-13],从而解释图9中去除率随电压增加而增加。但继续增大电压,去除效率降低,可能的原因有以下几方面。①同名离子的迁移。根据唐南(Donnan)平衡理论,离子交换膜的选择性不可能达到 100%,所以也有少量与离子交换膜解离离子电荷相反的离子透过膜,即阴离子透过阳膜,阳离子透过阴膜。当膜的选择性固定后,随着浓室重金属离子浓度增加,这种同名离子迁移影响加大。②离子的浓差扩散。由于浓室和清室中的溶液中存在着浓度差,总会有少量的离子由浓室向清室扩散迁移,从而降低了去除效率。③水的电渗析。由于离子的水合作用和形成双电层,在直流电场作用下,水分子也可从清室向浓室迁移。④水的解离。随着直流电压的增大,会在膜界面层的两侧形成附加电势,该附加电势增大到一定程度时可使膜表面的水分子解离:H2O—→H++OH−[14]。这些水解离产物会透过膜发生迁移且与金属离子反应造成膜的结垢[15],从而降低离子去除效率。对于含铜废水来说,膜上的结垢有可能来自于铜离子的水解产物Cu(OH)2和 CuO[10]。

3 结 论
通过自设计的电渗析装置,对 10~50mg/L的低浓度含铜废水进行了试验研究。实验采用单因素法与间歇式反应,研究了直流电压、通电时间和极板间距对实验效果的影响。结果如下:在电压为8V、pH值为7、温度20 ℃、极板间距360 mm、通电时间1 h时, Cu2+(14.84~14.91 mg/L)去除效率为 90.4%,浓缩倍数为 3.5,清室 Cu2+浓度为 1.44 mg/L,接近排放标准。有如下结论。
(1)在实验极板间距变化范围内,极板间距对电渗析去除效率的影响较小,趋势是随着极板间距增大,电渗析的去除效率缓慢降低。
(2)通电时间对电渗析浓缩重金属的影响为去除效率和浓缩倍数通电时间的增长线性增长。
(3)直流电压对电渗析浓缩效果影响显著,该装置的最佳操作电压为8 V,初始浓度对清室Cu2+浓度影响不大。Cu2+去除效率随电压增大而增大,当电压增大到一定值时,去除效率降低。出现拐点的原因可能是:①同名离子的迁移;②离子的浓差扩散;③水的电渗析;④水的解离。
[1]Barakat M A.New trends in removing heavy metals from industrial wastewater[J].Arabian Journal of Chemistry,2011,4(4):361-377.
[2]Fu F,Wang Q.Removal of heavy metal ions from wastewaters:A review[J].Journal of Environmental Management,2011,92(3):407-418
[3]Omar W A,Zaghloul K H,Abdel-Khalek A A,et al.Genotoxic effects of metal pollution in two fish species,Oreochromis niloticus and Mugil cephalus,from highly degraded aquatic habitats[J].Mutation Research:Genetic Toxicology and Environmental Mutagenesis,2012,746(1):7-14.
[4]Jü ttner U G K,Schmieder H.Electrochemical approaches to environmental problems in the process industry[J].Electrochimica Acta,2000,45:2575-2594.
[5]Janssen L J J,Koene L.The role of electrochemistry and electrochemical technology in environmental protection[J].Chemical Engineering Journal,2002,85 :137-146.
[6]Wang Y,Qiao M,Liu Y,et al.Health risk assessment of heavy metals in soils and vegetables from wastewater irrigated area,Beijing-Tianjin city cluster,China[J].Journal of Environmental Sciences—China,2012,24(4):690-698.
[7]Yi Y,Yang Z,Zhang S.Ecological risk assessment of heavy metals in sediment and human health risk assessment of heavy metals in fishes in the middle and lower reaches of the Yangtze River basin[J].Environmental Pollution,2011,159(10):2575-2585.
[8]Ahmaruzzaman M.Industrial wastes as low-cost potential adsorbents for the treatment of wastewater laden with heavy metals[J].Advances in Colloid and Interface Science,2011,166(1-2):36-59.
[9]Sadyrbaeva T Z.Hybrid liquid membrane -Electrodialysis process for extraction of manganese(Ⅱ)[J].Desalination,2011,274(1-3):220-225.
[10]Chang J H,Ellis A V,Tung C H,et al.Copper cation transport and scaling of ionic exchange membranes using electrodialysis under electroconvection conditions[J].Journal of Membrane Science,2010,361(1-2):56-62.
[11]Cifuentes L,García I,Arriagada P,et al.The use of electrodialysis for metal separation and water recovery from CuSO4–H2SO4–Fe solutions[J].Separation and Purification Technology,2009,68(1):105-108.
[12]Peng C,Liu Y,Bi J,et al.Recovery of copper and water from copper-electroplating wastewater by the combination process of electrolysis and electrodialysis[J].Journal of Hazardous Materials,2011,189(3):814-820.
[13]Pazouki M,Moheb A.An innovative membrane method for the separation of chromium ions from solutions containing obstructive copper ions[J].Desalination,2011,274(1-3):246-254.
[14]孟洪,彭昌盛,卢寿慈,等.电渗析过程中的浓差极化及水解离机理[J].膜科学与技术,2003,23(1):7-11
[15]Valerdi-Perez R,Ibanez-Mengual J A.Current-voltage curves for an electrodialysis reversal pilot plant:Determination of limiting currents[J].Desalination,2001,141(1):23-37.
