磁性壳聚糖微球的合成及其在固定化血管紧张素转化酶的应用
2013-10-11周敬豪徐存华李玉婵黄顺礼熊珍爱孙建华蒋林斌童张法廖丹葵
周敬豪,徐存华,李玉婵,黄顺礼,熊珍爱,孙建华,蒋林斌,童张法,廖丹葵
(广西大学化学化工学院,广西 南宁 530004)
磁性微球是近 20年来发展起来的一种新型功能高分子材料,由于它同时具有无机磁性载体、超顺磁响应性以及表面功能化修饰等优点[1],在外磁场作用下可快速从反应介质中分离出来,因而在生物技术、化学、环境治理等领域得到了广泛的应用[2]。壳聚糖是具有很好生物相容性的天然多糖材料,其分子链上含大量的羟基和氨基可进行修饰和功能化,因此广泛用于酶的固定化[3-4]。
血管紧张素转化酶(angiotensin converting enzyme,ACE)是肾素-血管紧张素系统中的一种酶类,其在体内不仅可以将血管紧张素Ⅰ转化为血管紧张素Ⅱ,还会分解缓激肽,这都会导致人体内血压的升高。许多科研工作者通过筛选ACE抑制剂来寻找抗高血压类物质,但筛选ACE抑制剂需要大量的ACE[5]。商业ACE价格十分昂贵,从动物组织中提取ACE却又存在过程繁琐,产量极低,易失活等缺点。若将ACE固定在载体上,可以大大提高酶稳定性和循环利用率。
洪韫嘉、刘宏等[5-6]以硫酸铵分级沉淀、透析平衡、亲和分离等多步纯化的高纯度猪肺 ACE为原料,研究了壳聚糖和Sepharose CL-4B固定化ACE的性质,但以猪肺二级沉淀粗提ACE为原料的固定化ACE尚无文献报道,因此,本实验拟以猪肺二级沉淀粗提ACE为原料,研究磁性壳聚糖固定化ACE的效果和固定化酶性质,为简化固定化酶的前处理提供依据。
1 实验部分
1.1 试剂与仪器
壳聚糖,脱乙酰度≥95%,浙江金壳生物化学有限公司;马尿酰-组氨酰-亮氨酸(HHL),美国Sigma公司;环氧氯丙烷、三氟乙酸,分析纯,中国国药集团;FeCl2·4H2O、FeCl3·6H2O、50%戊二醛、乙酸、氨水、Span-80、油酸等均为国产化学纯。
SK8200HP数控超声波清洗器(上海);NICOLET 6700傅里叶变换红外光谱仪(Thermo Fisher Scientific,美国);Nano-S激光纳米粒度分析仪(Malvern,英国);STA 449 F3 Jupiter同步热分析仪(NETZSCH,德国);1260 液相色谱仪(Agilent,德国);7400振动样品磁强计(Lake Shore,美国)。
1.2 实验方法
1.2.1 改性 Fe3O4磁性纳米粒子及磁性壳聚糖微球的制备
采用化学共沉淀法制备Fe3O4磁性纳米粒子[7]。配制一定浓度的 FeCl3·6H2O 和 FeCl2·4H2O 溶液,置于250 mL三口烧瓶中,通入氮气,高速搅拌条件下滴加浓氨水,至溶液变成黑亮色,加入油酸改性,搅拌熟化30 min。反应结束后,磁铁分离收集,去离子水清洗干净,真空干燥。
将壳聚糖溶于 2%的乙酸溶液中,加入 Fe3O4磁性纳米粒子混合,超声分散,高速搅拌条件下,缓慢将壳聚糖混合溶液滴加到装有液体石蜡和Span-80的三口烧瓶中,搅拌30 min,加入交联剂戊二醛,继续搅拌1 h,调节pH值到9,搅拌1 h后结束反应。产物依次用石油醚、乙醇、去离子水洗涤干净,磁铁分离收集,真空干燥并进行表征[8]。
壳聚糖与戊二醛的交联反应及磁性壳聚糖微球的合成过程分别如图1和图2所示。
1.2.2 Fe3O4纳米粒子及磁性壳聚糖微球的性能表征
样品粒径分布采用激光纳米粒度分析仪进行测定;结构采用傅里叶变换红外光谱仪进行分析;磁学性能采用振动样品磁强计进行分析;热失重过程采用同步热分析仪进行分析[9]。
1.2.3 血管紧张素转化酶(ACE)的固定化
从新鲜猪肺中提取二级沉淀 ACE粗酶[10]。称取一定量磁性壳聚糖微球,加入环氧氯丙烷,在40℃条件恒温水浴摇床中活化4 h。再称取一定量活化后的磁性壳聚糖微球,按质量体积比1∶10加入二级沉淀的ACE粗酶溶液(由含0.3 mol/L NaCl的0.1 mol/L硼酸盐缓冲溶液配制,pH值8.3),在50 ℃恒温水浴摇床中反应1.5 h。反应结束后,用去离子水和缓冲溶液洗涤固定化ACE的磁性壳聚糖微球,磁铁分离收集。加入硼酸盐缓冲溶液,4 ℃冰箱冷藏待用。
1.2.4 ACE活性测定方法
溶液酶活性测定[11]:以HHL作为酶反应底物,酶反应催化生成的马尿酸(HA)作为检测指标。取20 μL ACE 酶液,加入 40 μL 底物溶液和 140 μL 缓冲液,在37 ℃下反应30 min,加入25 μL 2 mol/L盐酸终止反应。反应液用0.45 μm纤维膜过滤后进液相检测生成的HA的含量。1个酶活力单位(U)定义:在本实验条件下,每分钟催化底物 HHL生成1 μmol产物HA所需的酶量。
固定化酶活性测定:与测定溶液酶的方法相同,每次取30 mg固定化酶微球,加入40 μL底物溶液和160 μL缓冲液,在37 ℃下反应30 min,4 ℃冷冻离心,取上清液加入25 μL盐酸终止反应,用0.45 μm纤维膜过滤后进样。固定化ACE活力单位(U)定义:在本实验条件下,1 g固定化酶1 min催化底物HHL生成1 μmol产物HA为1个活力单位。
2 结果与讨论
2.1 磁性壳聚糖微球结构性能表征
2.1.1 粒度分析
粒径分布是评价 Fe3O4磁性纳米粒子和磁性壳聚糖微球的分散性和均一性的重要指标。Fe3O4磁性纳米粒子和磁性壳聚糖微球的粒径分布如图3和图4所示。由图3、图4可知,Fe3O4磁性纳米粒子平均粒径大约为6 nm,磁性壳聚糖微球的粒径分布比较窄,平均粒径大约为901 nm,具有良好的体表效应,单位微球表面的活性基团越多,可交联结合的游离酶越多,因此可将磁性壳聚糖微球应用于酶的固定化。
2.1.2 傅里叶红外光谱(FT-IR)分析

图5中a、b、c分别为Fe3O4纳米粒子、壳聚糖及磁性壳聚糖微球的红外光谱图。其中,584 cm−1处为Fe3O4中Fe—O的特征吸收峰;3500 cm−1处强的吸收峰为—NH2中N—H键不对称伸缩振动和对称伸缩振动峰;3388 cm−1、3290 cm−1是O—H和N—H的伸缩振动峰; 2921 cm−1、2867 cm−1处为羧羟基和脂肪族碳氢的伸缩振动峰;1559 cm−1处为酰胺特征吸收峰;1400 cm−1左右为—CH2的弯曲振动、—CH3的变形振动峰;1062 cm−1处为C—O伸缩振动峰。谱线c为磁性壳聚糖微球的红外谱图,谱图中不仅保留了壳聚糖原有的特征吸收峰,且在590 cm−1处出现了Fe3O4的Fe—O特征吸收峰,说明了制备的磁性壳聚糖微球包裹了Fe3O4磁性纳米粒子。


2.1.3 磁响应性分析
Fe3O4纳米粒子和磁性壳聚糖微球的磁性分析结果如图6。由图6可知,Fe3O4纳米粒子和磁性壳聚糖微球均具有超顺磁性,Fe3O4纳米粒子和磁性壳聚糖微球的饱和磁化强度分别为37.24 emu/g和7.93 emu/g,磁核包裹壳聚糖后,由于复合微球体积变大,磁性受到影响,但仍具有良好的磁响应性,可用于后续的固定化酶的快速收集。
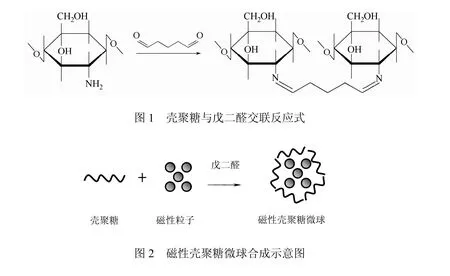
2.1.4 热重分析
图7为磁性壳聚糖微球热重分析结果,从室温升至120 ℃,其14%的失重应为样品中吸附水的脱除[12]。从120 ℃升温到700 ℃,其 58%的失重为磁性微球中壳聚糖的热分解及 Fe3O4骨架上 H、N的脱去。700 ℃后样品质量基本不变,由于 Fe3O4在N2气保护下不会分解,因此可知磁性壳聚糖微球中Fe3O4的含量约为28%。
2.2 磁性壳聚糖微球固定化ACE条件优化
2.2.1 固定化最适pH值的确定
从新鲜猪肺中提取二级沉淀物为ACE粗酶,按1.2.4节条件分析得ACE粗酶活性为0.048 U/mg。
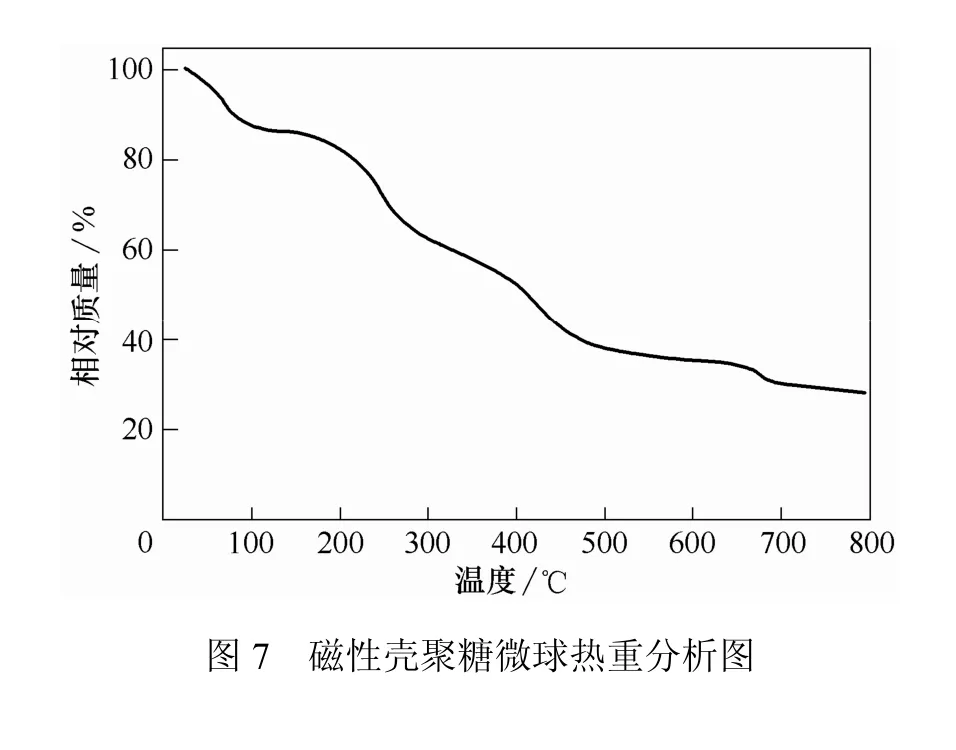
取5组经活化处理的磁性壳聚糖微球,分别加入5 mL pH值范围从7.3~9.3 硼酸盐缓冲液配制的ACE酶溶液,按1.2.3节条件对ACE进行酶固定化,不同pH值条件下固定化酶活性结果见图8。由图8可知,固定化酶活性随pH值升高先上升而后下降。当pH值为8.3时,固定化酶活性最高,因此选取pH值 8.3进行酶固定化。
2.2.2 固定化最适反应温度的确定
不同固定化温度下固定化酶活性结果见图 9。由图9可知,固定化酶活性随反应温度升高呈先上升而后下降。当温度为 50 ℃时,固定化酶活性最高,超过 50 ℃后,酶活性迅速下降,原因可能是酶活性部位因温度升高而遭到破坏,导致固定化酶失活,活性下降,因此选取50 ℃为最适固定化温度。
2.2.3 固定化最适反应时间的确定
不同固定化时间下固定化酶活性结果见图10。由图10可知,随反应时间不断增加,固定化酶活性增大。当反应超过1.5 h后,固定化酶活性开始下降,原因可能是此时微球负载酶量已达到饱和,延长反应时间只会增大酶空间位阻而致使酶活性变小,因此选取1.5 h为最适固定化时间。
2.2.4 固定化最适蛋白浓度的确定

不同浓度 ACE酶液固定化酶的活性变化见图11。由图11可知,随着粗酶液浓度增大,固定化酶活性也不断增大。当粗酶液浓度为6 mg/mL时,固定化酶活性达到最大。继续增大粗酶液浓度,固定化酶活性反而呈微弱下降趋势。这是因为磁性壳聚糖微球表面的活性基团和酶的结合已趋于饱和,再增加酶液浓度,酶不但不和活性基团结合,反而会使酶都聚集在一起,对酶活性中心造成阻碍,导致酶活性下降。因此,固定化的最适酶液浓度为 6 mg/mL,此时固定化酶活最大为0.048 U/g微球。
2.3 固定化酶性质考察
2.3.1 pH值对酶活性的影响
相同酶活力的游离ACE和固定化ACE在不同pH值条件下酶活变化如图12所示。由图12可知,虽然固定化酶和游离酶在pH值7.8处都具有最高的活力,但固定化酶的适合pH值范围要宽于游离酶,可能是固定化后ACE的构象发生了改变,因此在较宽的pH值范围内较为稳定。
2.3.2 温度对酶活性的影响
相同活力游离ACE和固定化ACE在不同温度下酶活变化如图13。由图13可知,游离酶在42 ℃时具有最高酶活力,继续升高温度,酶活力快速下降;而固定化酶在 47 ℃时具有最大酶活力,说明酶固定化后提高了热稳定性,其适用范围较游离酶更宽。

2.3.3 固定化酶的操作稳定性
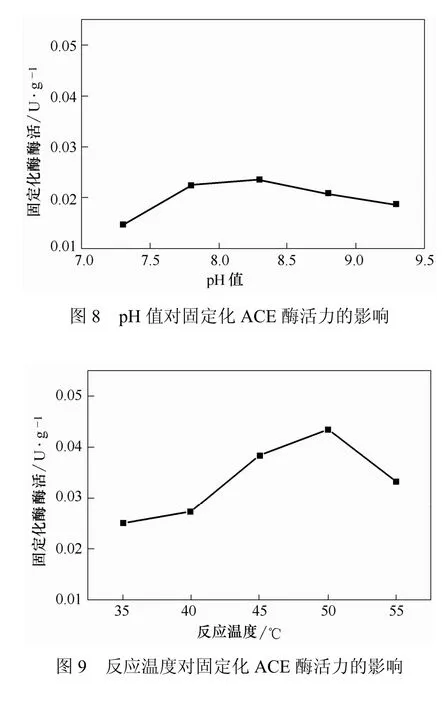
重复使用性是固定化酶在应用方面的一个重要指标。使用磁性壳聚糖固定化酶连续测定酶活力10次,结果见图14。从图14可知,固定化酶使用10次后,其相对活力仍然保持在40%以上,显示出较高的操作稳定性。
2.3.4 固定化酶的储藏稳定性
将固定化酶置于pH值8.3硼酸缓冲液,4 ℃冰箱中保存30天后,其活力为初始酶活力的82%,这表明固定化酶具有良好的储藏稳定性。
本实验采用猪肺二次盐析沉淀的粗酶为原料进行固定化,操作简便,省略了透析、凝胶层析、离子交换等多步分离纯化过程,除固定化酶活比文献[5]报道的0.085 U/g偏低外,固定化酶的其它性质均与文献报道相近,同时,由于采用磁性微球为固定化载体,该固定化酶在使用过程中进行分离较其它的固定化载体更为方便和快速。
3 结 论
(1)采用乳化交联法制备了磁性壳聚糖微球,并对磁核和磁性壳聚糖微球结构进行了表征。结果表明,磁性微球平均粒径为901 nm,具有良好的磁响应性和超顺磁性。
(2)以磁性壳聚糖微球作为固定化载体,对粗提血管紧张素转化酶进行固定化,并对固定化条件进行了优化,得到固定化ACE的最佳条件为:pH值 8.3,温度为50 ℃,反应1.5 h,酶液蛋白浓度为 6 mg/mL,此时固定化酶活力最高为 0.048 U/g微球。
(3)对磁性壳聚糖微球固定化酶进行性质研究,实验结果表明,与游离酶相比,固定化酶 pH值稳定性、热稳定性均得到提高。固定化酶具有较好的重复使用性和储藏稳定性。
[1]宋艳艳,孔维宝,宋昊,等.磁性壳聚糖微球的研究进展[J].化工进展,2012,31(2):345-354.
[2]周瑾,周作明,荆国华.磁性固定化技术在环境工程领域的研究和应用进展[J].化工进展,2011,30(5):1106-1111.
[3]Wang Y J,Wang X H,Luo G S,et al.Adsorption of bovin serum albumin(BSA) onto the magnetic chitosan nanoparticles prepared by a microemulsion system[J].Bioresource Technology,2008,99:3881-3884.
[4]Li G Y,Zhou Z D,Li Y J,et al.Surface functionalization of chitosan-coated magnetic nanoparticles for covalent immobilization of yeast alcohol dehydrogenase fromSaccharomyces cerevisiae[J].Journal of Magnetism and Magnetic Materials,2012,322:3862-3868.
[5]洪韫嘉,李谭瑶,陈波,等.壳聚糖固定化血管紧张素转化酶及其性质[J].高等学校化学学报,2009, 30(2):328-331.
[6]刘宏,陈兰英.血管紧张素转换酶的固相化与性质[J].中国医学科学院学报,2000,22(6):558-561.
[7]王红英,常凯.磁性壳聚糖微球的制备及其性能[J].大连工业大学学报,2011,30(2):105-108.
[8]Fan L L,Luo C N.Preparation of magnetic modified chitosan and adsorption of Zn2+from aqueous solutions[J].Colloids and Surfaces B:Biointerfaces,2011,88:574-581.
[9]Yan H,Yang L Y,Yang Z,et al.Preparation of chitosan/poly(acrylic acid) magnetic composite microspheres and applications in the removal of copper(Ⅱ) ions from aqueous solutions[J].Journal of Hazardous Materials,2012,229-230:371-380.
[10]刘宏,陈兰英.亲和层析法分离纯化猪肺血管紧张素转换酶[J].生物化学与生物物理进展,2000,27(5):544-547.
[11]廖丹葵,孙秀华,万顺刚,等.酶法水解和筛选蛋黄蛋白质中的药物前驱型降血压肽[J].精细化工,2006,23(8):757-759.
[12]Zhang L Y,Zhu X J,Sun H W,et al.Control synthesis of magnetic Fe3O4-chitosan nanoparticles under UV irradiation in aqueous system[J].Current Applied Physics,2012,10(3):828-833.
