季铵盐类抗菌聚合物的研究现状
2013-10-11左华江温婉华吴丁财符若文
左华江,温婉华,吴丁财,符若文
(1广西科技大学生物与化学工程系,广西 柳州 545006;2中山大学化学与化学工程学院聚合物复合材料及功能材料教育部重点实验室,广东 广州 510275)
近年来,人们越来越重视抵御微生物侵害,以保障自身的生命财产安全。与传统的物理、化学灭菌法相比,抗菌材料既能直接杀死表面的病原性微生物,有效避免交叉感染、抵御传染性疾病,又不会影响制品以外的空间及微生物环境,安全性能更好,且抗菌效果也更为长效、广谱、经济、方便。因此,抗菌材料业已成为材料科学中最具活力的领域之一。
根据抗菌方式的不同,抗菌剂(即抗菌材料中所添加的抗菌活性物质)可分为两大类,即释放型抗菌剂和接触型抗菌剂。前者以无机和有机抗菌剂为代表,后者则以高分子抗菌剂为代表。由于高分子抗菌剂是基于接触过程而不是活性物质的释放来抗菌,所以抗菌性能稳定,效果持久,且使用安全性大大提高。这使其备受青睐,近年来发展迅速,但到目前为止,其作用机理及构效关系尚未完全清楚,这极大地限制了抗菌性能的提升及其大规模应用。
季铵盐类聚合物(PQACs)是高分子抗菌剂的典型代表,抗菌性和安全性颇受肯定,研究和应用也较多。本文拟通过归纳 PQACs的研究现状,以帮助厘清认识,为后续理论和应用研究提供参考。
1 季铵盐抗菌聚合物的作用机理
随着 PQACs抗菌剂研究的不断升温,人们对它们的抗菌机理进行了大量研究。最为普遍接受的是“穿透型抗菌机理”,认为小分子季铵盐的(LMQACs)的抗菌过程包括6个基元步骤:①带正电荷的LMQACs通过静电引力,吸附到带负电荷的微生物细胞表面;②在亲脂性长烷基取代链的推动下,穿透细胞壁;③通过静电引力与细胞质膜中的磷脂双分子层及其它负电物质结合;④破坏细胞质膜;⑤引起细胞内物质(如DNA、RNA、K+等)的释放;⑥微生物死亡。由于 PQACs的电荷密度(即官能团密度)远高于LMQACs,由静电引力推动的步骤①和步骤③更容易进行,所以,PQACs能更快、更强地与微生物细胞表面及细胞质膜结合,发挥更优越的抗菌活性。不过,分子量增大会影响PQACs的其它性能,最终导致抗菌活性下降[1-3]。
大量研究反映了细菌与 PQACs接触后的形貌及结构变化。通过扫描电镜(SEM)[4-5]、透射电镜(TEM)[6]、原子力显微镜(AFM)等观察到,细菌与 PQACs接触后会发生变形和结构的破坏。其细胞膜与细胞壁剥离,细胞膜结构不连续,释放出粒状纤维物质,甚至细胞散成碎片[7];同时,溶液中也检测到 DNA、RNA[8]、β-半乳糖苷酶[9]、TTC脱氢酶[7]等生物大分子的存在。这说明PQACs能破坏细胞质膜的完整性,其作用靶位是细菌细胞膜。
但也有人认为,PQACs是通过与细胞膜中的Ca2+、Mg2+等发生离子交换,而不是穿透细胞膜来杀死细菌,即“离子交换机理”。在细胞膜内,Ca2+、Mg2+等与 G−菌的脂多糖或 G+菌的磷壁酸和多聚糖结合,维持着细菌的电荷平衡。一旦Ca2+、Mg2+等被PQACs交换,细胞将无法保持完整。持该“离子交换”观点的研究发现,当体系中有 Ca2+、Mg2+的盐存在时,PQACs的抗菌活性明显下降;而季铵盐官能团与抗衡阴离子的结合更紧密时,PQACs交换Ca2+、Mg2+的能力下降,抗菌活性也减弱[4,10]。
值得强调的是,PQACs的结构稳定性好,在抗菌过程中不发生变化,这使其能保持持久稳定的抗菌活性。Sauvet等[11]制备的表面固定季铵盐官能团的抗菌微球,经 66天浸泡实验后抗菌活性保持不变。而鹿桂乾等[12]开发的接枝 PQACs的棉织物,经100次水洗后仍具备良好的抗菌活性。
有研究发现,PQACs在使用一段时间后活性下降,这很可能源于表面被细菌残骸覆盖,活性基团无法与细菌接触。可采取适当方法除去细菌残骸,以恢复抗菌活性[13-14]。Nakagawa等[15]发现,多孔玻璃表面的季铵盐官能团密度(QAD)为 19~72 μmol/g时,主要通过疏水作用吸附细菌,可采用乙醇洗涤法恢复抗菌性能;QAD高达 880~1170 μmol/g时,材料与细菌残骸间以静电作用为主,需采用碱液进行浸泡。Hu等[24]制备的带季铵盐活性官能团的共聚微球在反复使用、抗菌性能下降后,只需在去离子水中振荡10 min,即可恢复活性,且总氮及 N+含量基本不变。这说明只要处理工艺合适,PQACs就能被重复持久利用,这能大大降低成本。
2 影响 PQACs抗菌性能的主要结构参数
2.1 分子量
PQACs的分子量与电荷密度有关,因此会对抗菌性能产生重要影响。一般而言,分子量增大,电荷密度增高,PQACs与细菌间的静电引力增强,步骤①和步骤③更容易发生,抗菌活性也就更高[1,3]。Timofeeva等[6]合成的两种 PQACs,即 PDAATFA和PDAMATFA(图1),当它们的分子量分别由24 kDa增加至62 kDa和55kDa时(约2.5倍),抗菌活性增加了 10~20倍。Huang等[16]通过原子转移自由基聚合(ATRP)在 PP表面接枝 PQACs,当PQACs的分子链密度一定,而分子量由1500 g/mol增加到9800 g/mol时,QAD由2 unit/nm2增加到14 unit/nm2,杀菌率也随之由85%增加到100%。据此计算,约7×108个季铵盐官能团能杀死一个细菌。
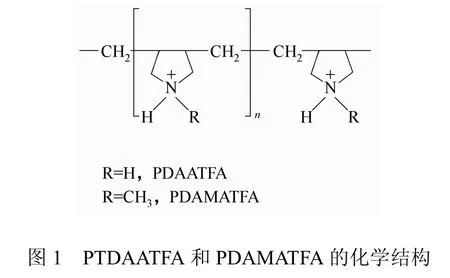
Murata等[17]的研究则从反面证实分子量-电荷密度-抗菌性能这三者间的关系。他们发现,控制PQACs的分子量不变,提高分子链密度,也会增大材料表面的 QAD,从而增强抗菌性能。QAD为5×1015charges/cm2时,材料表面紧密堆积的一层E.coli被杀死,此时细菌电荷密度恰好为(5×1014)~(5×1015)charges/cm2(差异可能来自于细菌生长阶段的不同)。
结合上述研究可以得出,电荷密度与抗菌性能密切相关,通过设计和调控 PQACs的分子量可以调节PQACs与细菌间的作用,从而改变抗菌性能。分子量是调节抗菌性能的一个重要手段。
但分子量的增大也有不利影响,如可能导致分子尺寸增大,降低PQACs穿透细菌细胞膜的能力。Pasquier等[18]发现,随着聚乙烯亚胺(PEI)分子量的增加,共聚物(图 2)更趋向于形成胶束,与细菌的接触变差,活性下降。有研究证明,分子量的影响符合“bell-like shape”规律,即PQACs只在一定的分子量范围内表现出良好的抗菌活性,分子量的进一步减少或增加都会使活性下降[6,19-20]。
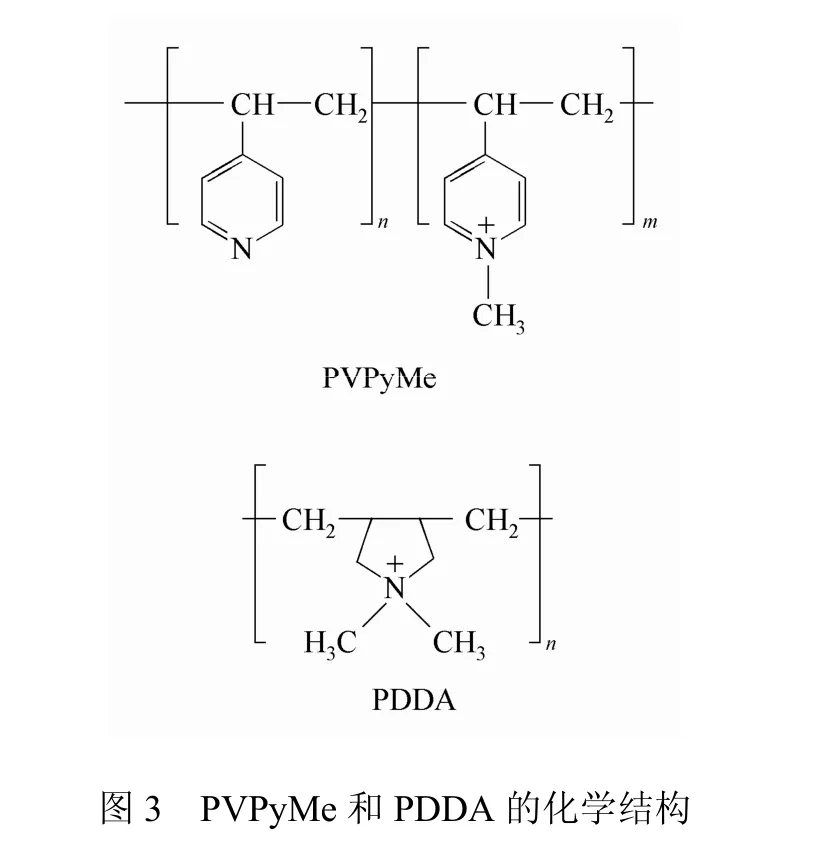
但一些现象与上述理论不符。Chen等[21]在树枝状聚丙烯亚胺(PPI)末端接入季铵盐官能团,发现第三代PPI的抗菌性能最差。这可能是第一、第二代PPI尺寸更小,更易穿透细胞膜,抗菌性能也相对较好;而第四、第五代PPI则凭借高官能团密度,部分弥补穿透能力下降的不利影响。Rivas等[22]合成的PVPyMe和PDDA这两种PQACs(图3),分子量改变时,抗菌性能的变化却并不明显。这些反常现象说明分子量对 PQACs抗菌性能的影响很复杂,需要研究者们开展更多研究深入分析。

2.2 取代烷基链长度
取代烷基链长度也对抗菌性能影响很大。有研究认为,PQACs中N+的4条取代烷基链中,至少其中一条的长度要达到 C8~C18,以增强与细菌亲脂性磷脂双分子层的相容性,从而更好地破坏细胞膜、杀死细菌[2]。Pasquier等[18]认为,PEI-A-B(图2)的烷基链为C12时抗菌性能最好。Dizman等[23]发现,当烷基链长由C12增加到C16时,所合成的带季铵盐官能团侧基的甲基丙烯酸酯类聚合物的抗菌性能也随之增强。Hu等[24]则发现,取代烷基链长度由C4增加到C10时,细菌细胞膜遭受的破坏更大,DNA、RNA、K+等细胞内物质的释放也更明显。
需要指出的是,取代烷基链也并非越长越好,需要综合考虑PQACs和基材的结构。Tiller等[25]在氨基玻璃表面接枝吡啶类PQACs,发现烷基链长为C6时抗菌性能最好;烷基链长度增加,抗菌活性下降,当烷基链长达到 C10时几乎无抗菌活性。鹿桂乾等[12]则发现,烷基链长度对季铵盐单体和聚合物的影响截然不同。单体(结构如图 4)的抗菌性能随烷基链长度的增加而增强,对应均聚物则相反。这可能是烷基链长度的增加增强了 PQACs的分子间及分子内疏水亲和力。当该亲和力超过N+的电荷斥力时,分子链团聚,大量活性官能团被包裹在内部、无法与细菌接触,因此抗菌活性下降[25-26]。另外一种可能是,烷基链长度的过度增加不利于季铵化反应的进行,导致 PQACs与细菌间的静电作用减弱。Lin等[26]就发现,在烷基链长由 C1增加到C18时,PEI的季铵化程度降低约90%;抗菌活性在C6时最佳。许多研究都有类似结果,但并未深入探讨原因[2,15,21],上述解释是否充分合理还需继续探讨。

要注意的是,烷基链的长度还会影响 PQACs的溶血能力。单体结构如图5的PQACs当R基团的链长由C4增加至C6时,抗菌活性增强约15倍,但毒性也增大了约6倍[27]。因此,还需审慎控制取代烷基链的长度,平衡抗菌效率与毒性的关系。
2.3 抗衡阴离子
卤代烷是最常用的季铵化试剂,抗衡阴离子的研究也以 Cl−、Br−、I−为主。持“离子交换机理”的研究认为,抗衡阴离子与N+的结合越紧密,越不利于N+与细菌细胞膜中的Ca2+或Mg2+等发生离子交换,抗菌性能也就越差。许多研究均支持这一观点。如Chen等[21]发现,Br−对N+的结合能力比Cl−弱,更有利于抗菌。Baudrion等[28]发现,抗衡离子为I−时,比Br−和Cl−的抗菌活性更强。但也有少量例外,Caillier等[29]发现,抗衡阴离子为 Cl−、Br−或 I−时,抗菌性能无明显差异。
2.4 间隔长度
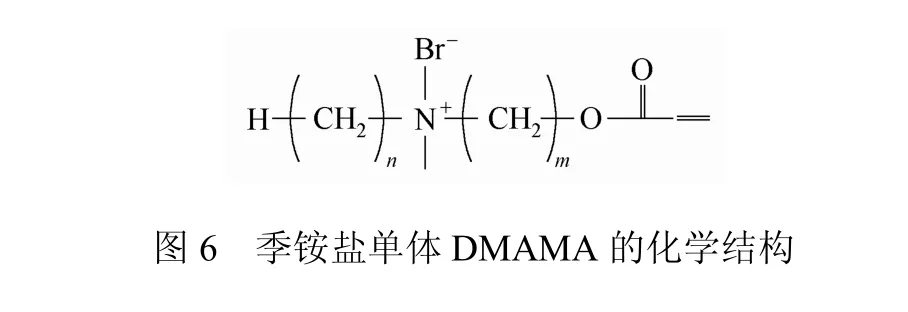
也有研究关注了季铵氮与主链的间隔长度对PQACs抗菌性能的影响。Pasquier等[30]合成了带季铵盐侧基的聚吖丙啶,在 N+与主链间的距离增加时,杀灭E.coli和B.subtilis所需的浓度下降。Caillier等[29]也发现,当季铵盐单体DMAMA(图6)的间隔长度m由2增加到11时,其聚合物对P.aeruginosa、C.albicans、A.niger、S.aureus四种致病菌的抑制和杀灭能力都明显增强。有研究提出,间隔长度会影响聚合物的分子链构象及电荷密度,因此会影响抗菌活性[3]。但具体规律如何,则未见详细报道。
3 应用方法
随着理论研究的深入,PQACs在各类材料中的应用研究也已展开。不仅常用的 PS、PP、PE、尼龙、涤纶、聚乙烯醇、聚氨酯等各类高分子材料都能利用 PQACs抗菌,甚至连表面化学惰性的不锈钢也能通过接枝PQACs抵御微生物[31-33]。
PQACs可通过物理或化学法添加到基材中。相对而言,通过化学键合能使 PQACs更稳定地锚固在基材中,充分发挥其稳定持久抗菌的优势,提高安全性。而根据键合方法的不同,又可细分为聚合接枝法(grafting from method)和偶联接枝法(grafting onto method)。本节将介绍和比较这两类方法。
3.1 接枝聚合法
接枝聚合法改性的关键是在基材表面产生活性中心,以引发季铵盐单体的接枝共聚,目前已开发出多种产生活性中心的方法。
3.1.1 湿化学法
湿化学法涉及化合物与材料在溶液中的反应[34]。一般先用强氧化性的物质处理材料,使其表面产生过氧基或自由基。例如,本文作者等[35]将棉布浸泡在硝酸铈铵溶液中,使其表面产生聚合活性中心,洗去多余硝酸铈铵后,再在氮气氛围下加入硝酸水溶液、铜粉和单体甲基丙烯酸二甲基氨基乙酯(DMAEMA)进行接枝反应。接枝成功后使DMAEMA季铵化,棉布即有良好的抗菌活性。Chen等[36]也通过相似路线,采用硝酸铈铵引发 2-丙烯酰乙基三甲基氯化铵在聚乙烯醇表面的接枝聚合,所得材料有望用作创伤敷料。除铈盐外,过硫酸盐[37]、偶氮二异丁腈、高锰酸钾[38]等多种自由基引发剂都可供选用。
对于一些材料,可充分利用其自身的官能团,如可通过氨基玻璃表面的—NH2与烯丙酰氯反应,引入C=C双键,从而可简便地接枝PQACs,获得良好的抗菌性能[25]。
总体而言,湿化学法反应条件较为温和,对设备的要求较低,易于操作,应用也较为广泛,但它的突出缺点是缺乏重现性,反应的不确定性较大,且可能引起高分子基材的降解,导致力学性能下降[34]。
3.1.2 高能辐照法
γ射线是工业上常用的高能辐射源,也可用于在材料表面接枝 PQACs,操作流程简单,应用方便[39]。例如,Goel等[40]将棉布浸泡在甲基丙烯酰氧乙基三甲基氯化铵(MAETC)的溶液中,再用60Co γ射线源进行辐照,MAETC就能接枝聚合在棉布表面,使棉布具备良好的抗菌活性。相似路线还用于在棉布上接枝丙烯酰氧乙基三甲基氯化铵和甲基丙烯酸羟乙酯的共聚物,所得材料同样有良好的抗菌性[41]。
但要注意的是,高能辐照可能使高分子材料发生一些副反应,如高分子的交联、裂解和降解以及自由基的重组等,因此它并不适用于对生物降解高分子的改性[34]。
3.1.3 臭氧处理法
臭氧处理法也是在材料表面接枝 PQACs的有效方法之一。例如,Zhou等[42]在30 ℃用臭氧处理硅橡胶表面达 30 min,即可使材料表面产生丰富的—O—OH基团,继而将硅橡胶浸泡在 50 ℃的N,N-二甲基N-甲基丙烯酰氧基乙基-N-(2-羧酸乙基)铵的溶液中,以引发单体的接枝聚合,同时添加少量Fe2+以抑制均聚反应,所得材料具有良好的抗菌性和生物相容性。
臭氧处理的流程也较简单,适用于多种材料。但缺点是臭氧会引起高分子降解,改变材料的力学性能,应用时需就具体材料进行全面评估。
3.1.4 等离子体处理法
等离子体技术也可直接在惰性材料表面产生活性中心。Asadinezhad等[43]在室温、大气氛围下,用200 W等离子电源处理PVC粒料15 s,就能使材料表面产生—OH、—OOH、—OO—等含氧官能团,引发丙烯酸单体接枝聚合,继而通过—COOH—与含氮化合物的反应及后续的季铵化,使材料获得抗菌活性。
目前已有多种等离子体可供选用,如 Jampala等[33]先后通入 O2和六甲基二硅氧烷这两种等离子体来活化不锈钢表面,以实现季铵盐的沉积。Yao等[44]则采用氩等离子体处理PU产生自由基,以实现PQACs的接枝共聚。
与湿化学法进行比较,等离子体技术的优点在于:①不会引起高分子基材的降解或裂解,因而不会破坏基材的力学性能;②可实现基材表面的均匀改性;③可避免使用溶剂[34]。但设备的一次性投资费用较高,限制了它的应用。
3.1.5 活性自由基聚合法
活性自由基聚合法是近十几年的新技术,主要包括ATRP和可逆加成断裂链转移聚合法(RAFT)。它们实质上也属于湿化学法,鉴于其反应过程及产物结构较为特殊,故单独列出。
这一新技术可应用于多种材料中。如 Cheng等[45]首先通过乙二醇二甲基丙烯酸酯与氯化苄的共聚,引入—ClCH2,脱水脱氧后,在CuCl/CuBr2/联吡啶的作用下使—ClCH2形成大分子引发剂,并引发DMAEMA的可控接枝共聚,随后采用溴代烷使其季铵化。Roy等[2]则将RAFT法应用于纤维素中。他首先在纤维素表面接入一定的链转移剂,随后采用偶氮二异丁腈作为引发剂,并借助于溶液中的自由链转移剂的作用,使DMAEMA接枝聚合在纤维素表面,最后进行季铵化反应。除了高分子材料,ATRP甚至可引发季铵盐单体在不锈钢表面的接枝聚合[46]。
活性自由基聚合法的优点是能准确控制PQACs的分子链密度、分子量及其分布,对于研究构效关系有重要价值。但缺点是反应条件苛刻、表面处理工艺繁琐、成本较为昂贵,不适合工业生产和大规模应用[46-48]。
3.2 偶联接枝法
先合成抗菌聚合物,再通过偶联反应使聚合物稳固结合在材料表面的方法即为偶联接枝法。其关键在于聚合物和材料间有可反应的官能团。
常见的做法是对聚合物结构进行设计,引入能与材料反应的组分。例如,Gao等[49]就利用 PEI中—NH—与偶联剂 γ-氯丙基三甲氧基硅烷中—Cl反应,引入能与 SiO2反应的—Si—O—CH3—官能团,从而实现 SiO2微球的抗菌改性。Huang等[50]则加入 3-(三甲氧基甲硅基)甲基丙烯酸丙酯与DMAEMA共聚,引入—Si—O—CH3—,也实现了玻璃的抗菌改性。除硅烷偶联剂外,还有多种偶联剂可供选用,如马来酸酐就可用于纤维素[12]、聚丙烯[51]等材料中。
有些研究则另辟佳径,选择对材料表面进行化学改性,引入能与聚合物反应的物质。例如,可通过氨基玻璃的—NH2与二溴丁烷反应,生成—NH—(CH2)4—Br基团,从而使聚乙烯基吡啶固定在材料表面,再浸泡在溴己烷溶液中季铵化。实验证明,季铵化程度可达96%,抗菌性能良好[25]。Lin等[26]则通过相似路径,在玻璃及Fe3O4纳米微球表面引入聚乙烯亚胺,随后使其季铵化。所得材料均有良好的抗菌活性。
相对于接枝聚合法,偶联接枝法对材料表面处理的要求较低,也较易控制聚合物的化学成分、单体组成、分子量及其分布等结构参数,因此更利于PQACs结构的定制和抗菌性能的调节。但偶联接枝法依赖于聚合物与材料间的化学反应,因此难应用于一些化学惰性的材料中。
4 前景与展望
近年来,SARS病毒、H1N1、致病性大肠杆菌等有害微生物的肆虐,给人类造成了极大的痛苦,促使人类不得不采取各种措施以保障自身的生命财产安全。其中,能有效抗菌、安全无毒的 PQACs毫无疑问具有重要意义。
在过去二十年里,PQACs的研究进展虽然较慢,但一直很稳定。而经过多年的积累,研究者们已开发出多种不同结构和性能的PQACs,并在纤维素、PP、PE、PS等多种材料中得到应用,这将有望促进有无菌或抗菌要求的食品包装、纺织品、伤口敷料、导尿管等领域的发展。人类对健康安全的渴求及 PQACs自身的进步,有望使其在近期获得蓬勃发展。
就目前的研究来看,PQACs方面还大有可为。
(1)PQACs的作用机理尚未完全明确,构效关系尚未完全建立,有待后续研究继续深入挖掘,以指导 PQACs的结构设计和优化,制备出抗菌性和安全性更好的抗菌聚合物。
(2)要与企业相结合, 开展 PQACs的规模化应用研究,建立完整的生产工艺和流程,控制和优化生产过程,充分降低成本。
应用研究上的突破必将极大地刺激理论研究的进步。
[1]Tashiro T.Antibacterial and bacterium adsorbing macromolecules[J].Macromol.Mater.Eng.,2001,286(2):63-87.
[2]Roy D,Knapp J S,Guthrie J T,et al.Antibacterial cellulose fiberviaRAFT surface graft polymerization[J].Biomacromolecules,2007,9(1):91-99.
[3]Kenawy E R,Worley S D,Broughton R.The chemistry and applications of antimicrobial polymers:A state-of-the-art review[J].Biomacromolecules,2007,8(5):1359-1384.
[4]Lenoir S,Pagnoulle C,Galleni M,et al.Polyolefin matrixes with permanent antibacterial activity:Preparation,antibacterial activity, and action mode of the active species[J].Biomacromolecules,2006,7(8):2291-2296.
[5]Xing X D,Lu D N,Wang X G,et al.Preparation and antibacterial function of auaternary ammonium salts grafted cellulose fiber initiated by Fe2+-H2O2redox[J].J.Macromol.Sci.A.,2009,46(5):560-565.
[6]Timofeeva L M,Kleshcheva N A,Moroz A F,et al.Secondary and tertiary polydiallylamm- onium salts:Nove polymers with high antimicrobialactivity[J].Biomacromolecules,2009,10(11):2976-2986.
[7]Lu D N,Zhou X R,Xing X D,et al.Quaternary ammonium salt(QAS) grafted cellulose fiber - preparation and anti-bacterial function[J].Acta.Polym.Sin.,2004(1):107-113.
[8]Liu C H,Tao Y,Gou J J,et al.Antimicrobial characteristic and mechanism of nano-fumed silica salt graftedN,N-dimethyln-tetradecylamine[J].Life.Sci.J.,2009,6(1):52-54.
[9]Xing X D,Wang X G.Preparation and atibacterial function of PE filmsco-grafted with Dmae-Bc and Nipaam[J].Acta.Polym.Sin.,2009(2):187-190.
[10]Kugler R,Bouloussa O,Rondelez F.Evidence of a charge-density threshold for optimum efficiency of biocidal cationic surfaces[J].Microbiol-Sgm.,2005,151(5):1341-1348.
[11]Sauvet G,Dupond S,Kazmierski K,et al.Biocidal polymers active by contact.V.Synthesis of polysiloxanes with biocidal activity[J].J.Appl.Polym.Sci.,2000,75(8):1005-1012.
[12]鹿桂乾,董卫民,左华江,等.反应性高分子抗菌剂的合成及对棉织物的抗菌整理[J].离子交换与吸附,2010,26(4):289-299
[13]Shi Z L,Neoh K G,Kang E T.Antibacterial and adsorption characteristics of activated carbon functionalized with quaternary ammonium moieties[J].Ind.Eng.Chem.Res.,2007,46(2):439-445.
[14]Cheng Z P,Zhu X L,Shi Z L,et al.Polymer microspheres with permanent antibacterial surface from surface-initiated atom transfer radical polymerization of 4-vinylpyridine and quaternization[J].Surf.Rev.Lett.,2006,13(2-3):313-318.
[15]Nakagawa Y,Hayashi H,Tawaratani T,et al.Disinfection of water with quaternary ammonium salts insolubilized on a porous glass surface[J].Appl.Environ.Microbiol.,1984,47(3):513-518.
[16]Huang J Y,Murata H,Koepsel R R,et al.Antibacterial polypropyleneviasurface-initiated atom transfer radical polymerization[J].Biomacromolecules,2007,8(5):1396-1399.
[17]Murata H,Koepsel R R,Matyjaszewski K,et al.Permanent,non-leaching antibacterial surfaces——2:How high density cationic surfaces kill bacterial cells[J].Biomaterials,2007,28(32):4870-4879.
[18]Pasquier N,Keul H,Heine E,et al.Amphiphilic branched polymers as antimicrobial agents[J].Macromol.Biosci.,2008,8(10):903-915.
[19]Franklin T J.Biochemistry and molecular biology of antimicrobial drug action[M].Snow G A.New York:Springer-Verlag,2005.
[20]Chen C Z S,Cooper S L.Interactions between dendrimer biocides and bacterial membranes[J].Biomaterials,2002,23(16):3359-3368.
[21]Chen C Z,Beck-Tan N C,Dhurjati P,et al.Quaternary ammonium functionalized poly(propylene imine)dendrimers as effective antimicrobials : Structure−activity studies[J].Biomacromolecules,2000,1(3):473-480.
[22]Rivas B L,Pereira E D,Mondaca M A,et al.Water-soluble cationic polymers and their polymer-metal complexes with biocidal activity:A genotoxicity study[J].J.Appl.Polym.Sci.,2003,87(3):452-457.
[23]Dizman B,Elasri M O,Mathias L J.Synthesis and antibacterial activities of water-soluble methacrylate polymers containing quaternary ammonium compounds[J].J.Polym.Sci.Pol.Chem.,2006,44(20):5965-5973.
[24]Hu F X,Neoh K G,Cen L,et al.Antibacterial and antifungal efficacy of surface functionalized polymeric beads in repeated applications[J].Biotechnol.Bioeng.,2005,89(4):474-484.
[25]Tiller J C,Liao C J,Lewis K,et al.Designing surfaces that kill bacteria on contact[J].P.Natl.Acad.Sci.,2001,98(11):5981-5985.
[26]Lin J,Qiu S Y,Lewis K,et al.Bactericidal properties of flat surfaces and nanoparticles derivatized with alkylated polyethylenimines[J].Biotechnol.Progr.,2002,18(5):1082-1086.
[27]Eren T,Som A,Rennie J R,et al.Antibacterial and hemolytic activities of quaternary pyridinium functionalized polynorbornenes[J].Macromol.Chem.Physic.,2008,209(5):516-524.
[28]Baudrion F,Perichaud A,Vacelet E.Influence of concentration and structure of quaternary ammonium salts on their antifouling efficiency tested against a community of marine bacteria[J].Biofouling,2000,14(4):317-331.
[29]Caillier L,de Givenchy E T,Levy R,et al.Synthesis and antimicrobial properties of polymerizable quaternary ammoniums[J].Eur.J.Med.Chem.,2009,44(8):3201-3208.
[30]Pasquier N,Keul H,Heine E,et al.From multifunctionalized poly(ethylene imine)s toward antimicrobial coatings[J].Biomacromolecules,2007,8(9):2874-2882.
[31]Ignatova M,Voccia S,Gilbert B,et al.Combination of electrografting and atom-transfer radical polymerization for making the stainless steel surface antibacterial and protein antiadhesive[J].Langmuir,2006,22(1):255-262.
[32]Yuan S J,Pehkonen S O,Ting Y P,et al.Inorganic-organic hybrid coatings on stainless steel by layer-by-layer deposition and surface-initiated atom-transfer-radical polymerization for combating bocorrosion[J].Acs.Appl.Mater.Inter.,2009,1(3):640-652.
[33]Jampala S N,Sarmadi M,Somers E B,et al.Plasma-enhanced synthesis of bactericidal quaternary ammonium thin layers on stainless steel and cellulose surfaces[J].Langmuir,2008,24(16):8583-8591.
[34]Desmet T,Morent R,Geyter N D,et al.Nonthermal plasma technology as a versatile strategy for polymeric biomaterials surface modification:A review[J].Biomacromolecules,2009,10(9):2351-2378.
[35]左华江,罗照文,吴丁财,等.棉纤维/季铵盐接枝共聚物的合成及抗菌性能研究[J].中山大学学报:自然科学版,2010,49(5):61-66.
[36]Chen K Y,Lin Y S,Yao C H,et al.Synthesis and characterization of poly(vinyl alcohol)membranes with quaternary ammonium groups for wound dressing[J].J.Biomat Sci-Polym.E.,2010,21(4):429-443.
[37]Anand S C.Medical Textiles and Biomaterials for Healthcare[M].Kennedy J F,Miraftab M,Rajendran S.Cambridge:Woodhead Publishing Limited,2006:144-152.
[38]Moustafa H Y.Preparation and characterisation of grafted polysaccharides based on sulphadiazine[J].Pigm.Resin.Technol.,2006,35(2):71-75.
[39]Lv X,Song W,Ti Y,et al.Gamma radiation-induced grafting of acrylamide and dimethyl diallyl ammonium chloride onto starch[J].Carbohyd.Polym.,2013,92(1):388-393.
[40]Goel N K,Rao M S,Kumar V,et al.Synthesis of antibacterial cotton fabric by radiation-induced grafting of[2-(methacryloyloxy)ethyl]trimethylammonium chloride(MAETC) onto cotton[J].Radiat.Phys.Chem.,2009,78(6):399-406.
[41]Goel N K,Kumar V,Rao M S,et al.Functionalization of cotton fabrics by radiation induced grafting of quaternary salt to impart antibacterial property[J].Radiat.Phys.Chem.,2011,80(11):1233-1241.
[42]Zhou J,Yuan J,Zang X,et al.Platelet adhesion and protein adsorption on silicone rubber surface by ozone-induced grafted polymerization with carboxybetaine monomer[J].Colloid.Surface B,2005,41(1):55-62.
[43]Asadinezhad A,Novák I,Lehocký M,et al.Anin vitrobacterial adhesion assessment of surface-modified medical-grade PVC[J].Colloid.Surface.B.,2010,77(2):246-256.
[44]Yao C,Li X S,Neoh K G,et al.Surface modification and antibacterial activity of electrospun polyurethane fibrous membranes with quaternary ammonium moieties[J].J.Membrane.Sci.,2008,320(1-2):259-267.
[45]Cheng Z P,Zhu X L,Shi Z L,et al.Polymer microspheres with permanent antibacterial surface from surface-initiated atom transfer radical polymerization[J].Ind.Eng.Chem.Res.,2005,44(18):7098-7104.
[46]Yuan S J,Xu F J,Pehkonen S O,et al.Grafting of antibacterial polymers on stainless steelviasurface-initiated atom transfer radical polymerization for inhibiting biocorrosion by desulfovibrio desulfuricans[J].Biotechnol.Bioeng.,2009,103(2):268-281.
[47]Yao F,Fu G D,Zhao J P,et al.Antibacterial effect of surfacefunctionalized polypropylene hollow fiber membrane from surfaceinitiated atom transfer radical polymerization[J].J.Membrane.Sci.,2008,319(1-2):149-157.
[48]Xing T L,Wang H J,Li Z X,et al.Surface grafting modification of silk fibroin by atom transfer radical polymerization[J].Surf.Eng.,2008,373-374:629-632.
[49]Gao B J,Zhang X,Wang J.Preparation and antibacterial characteristic of water-insoluble antibacterial material QPEI/SiO2[J].J.Mater.Sci-Mater.M.,2008,19(9):3021-3028.
[50]Huang J Y,Koepsel R R,Murata H,et al.Nonleaching antibacterial glass surfacesvia“Grafting Onto”:The effect of the number of quaternary ammonium groups on biocidal activity[J].Langmuir,2008,24(13):6785-6795.
[51]Thomassin J M,Lenoir S,Riga J,et al.Grafting of poly[2-(tert-butylamino)ethyl methacrylate]onto polypropylene by reactive blending and antibacterial activity of the copolymer[J].Biomacromolecules,2007,8(4):1171-1177.
