食管鳞癌中MMP-2 TIMP-2的表达及意义
2013-10-11赵红莲邢恩鸿金小平申兴斌
赵红莲, 林 健, 赵 杨, 邢恩鸿, 金小平, 申兴斌
(承德医学院附属医院, 河北 承德 067000)
食管癌(esophageal carcinoma)是消化道常见的恶性肿瘤,死亡率高。我国EC的病理组织类型主要是鳞状细胞癌,约占食管总发病率的83%[1]。食管癌的发生发展受多种因子的调控与维持。很多研究发现,基质蛋白酶2(MMP-2)及其抑制剂TIMP-2的高表达在肿瘤侵袭、转移过程中起着重要作用[2,3]。本研究运用免疫组化法检测了50例食管鳞癌组织中MMP-2、TIMP-2的表达情况及其相关性,探讨其在食管鳞癌的浸润、转移中所起的作用,为食管鳞癌的诊断、治疗及预后判断提供新的理论依据。
1 资料与方法
1.1 一般资料:收集我院50例食管鳞癌患者中男性47例,女3例。年龄45-78岁,平均年龄56岁。病理学分级;其中高中分化36例,低分化14例;按浸润程度不同分为≤肌层组织9例,>全层41例。有淋巴转移组27例,无淋巴转移组23例。所有病人术前均未接受放化疗治疗;同时取距上述癌组织边缘大于5cm处的正常粘膜20例标本作为对照。
1.2 主要试剂:兔抗人MMP-2多克隆抗体(北京中杉金桥);兔抗人TIMP-2多克隆抗体(武汉博士德公司);即用型DAB显色试剂盒(购自福州迈新生物技术开发有限公司DAB-0031)。
1.3 实验方法:石蜡切片(5微米),电热恒温箱80℃烘烤50min,二甲苯脱蜡至水。3%过氧化氢室温孵育10min。蒸馏水冲洗,PBS浸泡5min,在微波炉里加热0.01 moL/L枸橼酸钠缓冲液(pH6.0)至沸腾后将上述组织切片放入,抗原热修复15min,室温放置 40min,PBS冲洗 3次,每次5min。滴加 Ι抗50μL(MMP-2 1:80工作液;TIMP-2 1:100工作液),4℃冰箱过夜。PBS洗3次每次5min。滴加Ⅱ抗(快捷型酶标羊抗鼠/兔Ig G聚合物),室温孵育15min。PBS洗3次,每次5min。DAB显色5min,苏木素复染,透明、封片、镜检。
1.4 免疫组化结果判断:MMP-2、TIMP-2主要定位于细胞质,细胞质内出现棕黄色或棕褐色颗粒为阳性细胞。采用阳性染色强度结合阳性细胞所占百分比进行判断。在400倍视野下,每张切片随机观察4个视野,将切片中平均阳性比例及染色深浅分别计0-3分,切片中无阳性细胞0分,阳性细胞<25%计1分,26-50%计2分,51-75%计3分,>75%计4分;染色强度以多数细胞为准;无着色计0分,淡黄色计1分,黄或深黄色计2分,褐或棕褐色计3分,再按这两项指标的积分相加将结果分为4级:0分为“-”,1-2分为“+”,3-4分为“++”,5-6分为“+++”,其中“++”“+++”为强阳性表达。
1.5 统计学分析:实验资料的统计学处理通过SPSS11.5统计软件完成,等级资料采用秩和检验(Wilcixon signed ranks text,Kruskal Wallis text),以 P<0.05为差异有显著性。采用Spearman等级相关分析MMP-2、TIMP-2的相关性。
2 结果
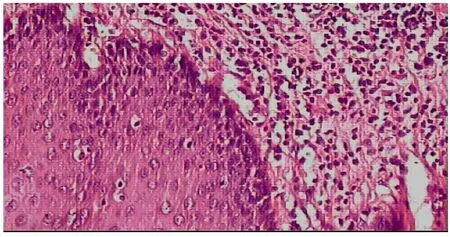
图1 正常食管粘膜(HE×200)

图2 食管鳞癌(HE×200)
2.1 免疫组化结果
2.1.1 MMP-2、TIMP-2在食管鳞癌和食管正常粘膜中的表达:MMP-2在20例正常食管粘膜与50例食管鳞癌中其强阳性、中等阳性及弱阳性表达分别为17例、16例、12例,5例阴性,两组比较表达强度有显著差异(P<0.01)。TIMP-2在正常食管粘膜中部分免疫反应呈弱阳性信号,在食管鳞癌组织中有8例强阳性表达,10例中等阳性表达,21例弱阳性表达。TIMP-2在两组中的表达强度有差异(P<0.01)。
2.1.2 食管鳞癌中MMP-2、TIMP-2与临床病理参数的关系:MMP-2在食管鳞癌的表达与浸润深度、有无淋巴结转移、TNM分期有关,与患者的年龄、性别、肿瘤大小、肿瘤分化程度无关。在有淋巴结转移的26例食管癌组织和无淋巴结转移的24例食管鳞癌标本中,MMP-2的强阳性表达分别是11例和6例,两组阳性表达比较有显著差异(P<0.05)。在9例浸润≤肌层组和41例浸润>肌层组MMP-2强阳性及中等阳性表达分别是16例、15例和1例、1例,两组阳性表达比较有显著差异(P<0.05)。TNM分期Ⅰ+Ⅱ期26例与Ⅲ+Ⅳ期24例强阳性表达为5例和11例,两组比较也有显著差异(P<0.05)。MMP-2在不同性别、年龄(<60岁,≥60岁)、肿瘤组织分化程度分组中的表达无明显差异 (P >0.05,P >0.05,P >0.05)。
TIMP-2在食管鳞癌的表达与浸润深度、有无淋巴结转移、TNM分期有关,与患者的年龄、性别、肿瘤大小、肿瘤分化程度无关。在26例有淋巴结转移和24例无淋巴结转移的食管鳞癌标本中,TIMP-2的阳性表达数分别是23例和16例,两组阳性表达数比较有显著差异性(P<0.05)。在9例浸润≤肌层组和41例浸润>肌层组,TIMP-2强阳性及中等阳性表达分别为8例、10例和0例、1例,两组比较差异有显著性(P<0.05)。在TNM分期Ⅰ+Ⅱ期26例与Ⅲ+Ⅳ期24例食管癌标本中,Ⅰ+Ⅱ期8例阴性,13例弱阳性,Ⅲ+Ⅳ期3例阴性,8例中等阳性,5例强阳性,两组比较也有显著差异(P<0.05)。TIMP-2在不同性别、年龄(<60岁,≥60岁)、肿瘤组织分化程度分组中的表达无明显差异 (P>0.05,P >0.05,P >0.05)。
2.1.3 MMP-2、TIMP-2在食管鳞癌中表达的相关性分析:对MMP-2、TIMP-2在食管鳞癌中的表达情况,采用spearman等级相关分析。MMP-2和TIMP-2相关系数r=0.51;P<0.01,表明他们之间有明显相关性。

表1 MMP-2在食管正常粘膜和食管鳞癌中的表达
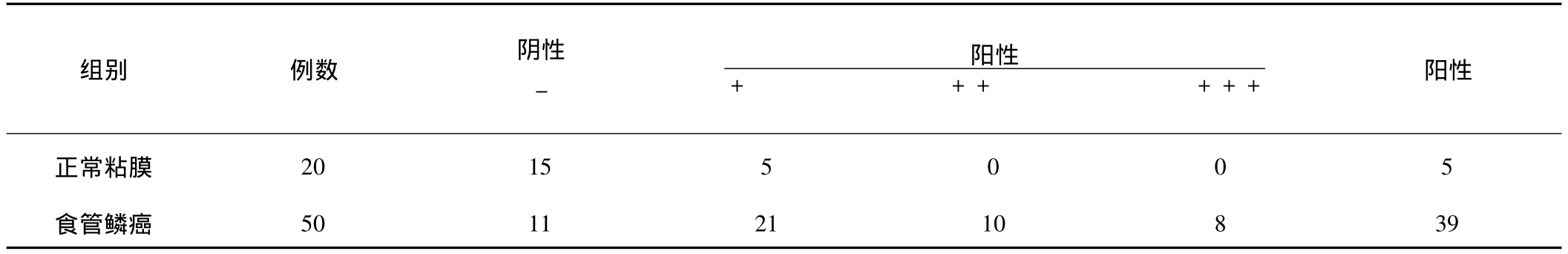
表2 TIMP-2在食管正常粘膜和食管鳞癌中的表达
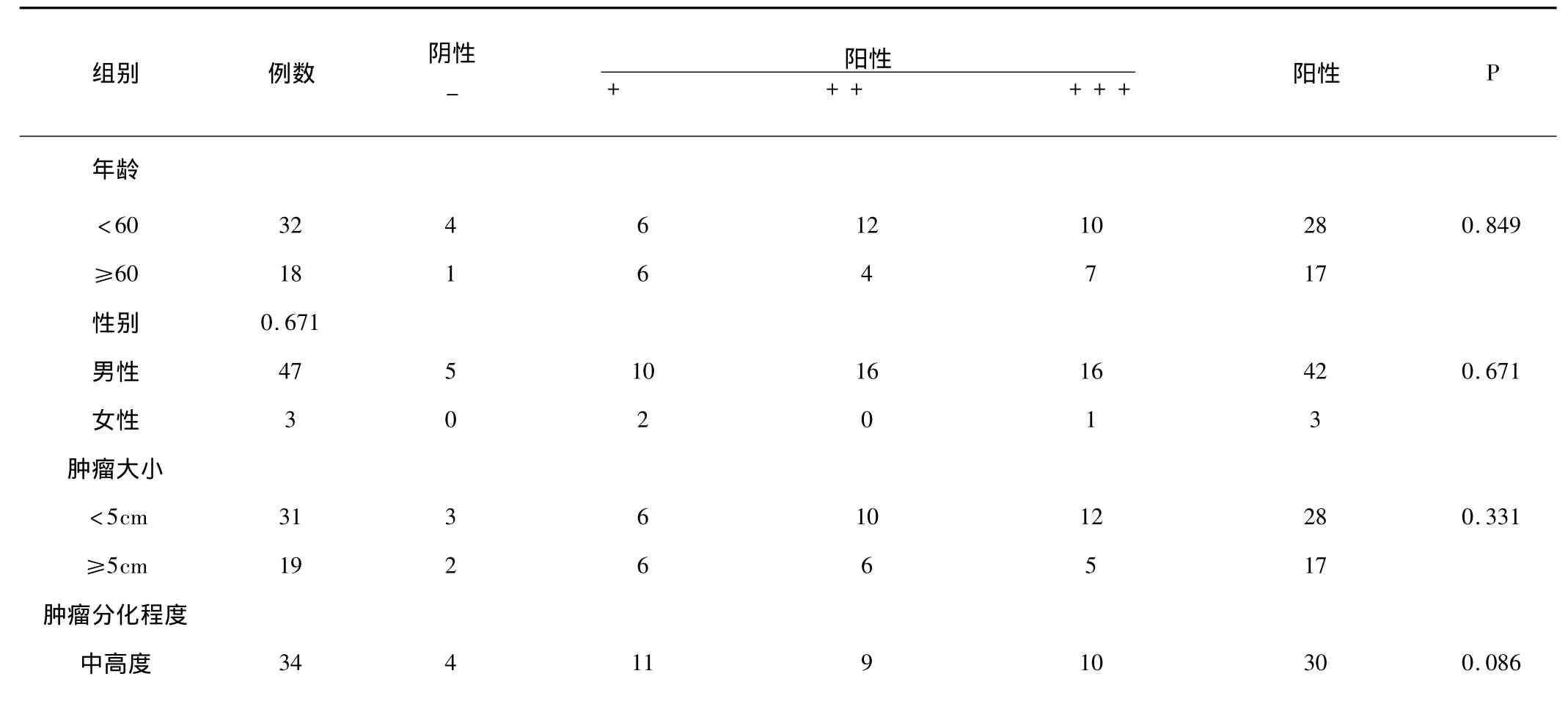
表3 食管鳞癌中MMP-2与临床病理参数的关系

*P <0.05

表4 食管鳞癌中TIMP-2与临床病理参数的关系
3 讨论
食管癌是当今世界导致人类死亡的主要恶性肿瘤之一,它的发生发展是一个多阶段多因素的过程。目前认为食管癌患者的预后受多种因素影响,随着基因研究的兴起,分子生物学指标对预后的影响是目前研究的热点。
基质金属蛋白酶MMPs是一个降解细胞外基质的酶家族,其功能活性受组织抑制物抑制。基质金属蛋白酶抑制剂TIMPs是MMPs的抑制剂,与MMPs共同参与ECM合成和降解。MMP-2具有降解多种ECM成分的强大能力,TIMP-2能特异性与MMP-2催化中心的锌离子结合,而封闭等催化中心,从而使MMP-2失去降解ECM的活性。MMP-2/TIMP-2表达失衡是引起ECM异常积聚的重要因素之一[4]。
研究表明,肿瘤中MMPS和TIMPS之间平衡失调,是肿瘤进展的一个重要因素[5]。近来基因调控的实验也进一步证实了MMP-2、TIMP-2失衡在肿瘤发生发展中的重要作用。本研究表明,MMP-2与TIMP-2在食管鳞癌中的表达明显高于正常食管组织,同时,在浸润超过肌层、有淋巴结转移、TNM分期Ⅲ+Ⅳ期的食管鳞癌组织中明显高于浸润未超过肌层、无淋巴结转移、TNM分期Ⅰ+Ⅱ期的食管鳞癌组织,说明MMP-2与TIMP-2在食管鳞癌的发生、发展过程中也起着非常重要的作用。
本研究应用免疫组化技术检测MMP-2、TIMP-2在食管鳞癌及正常食管粘膜中的表达情况。结果表明,50例食管鳞癌组织中MMP-2、TIMP-2的阳性表达例数分别是45例和39例,而在正常食管粘膜中的阳性数仅为7例和5例,经统计学分析发现,与食管正常粘膜相比,MMP-2、TIMP-2在食管鳞癌组织中存在高表达(p<0.01,P <0.01)。
本研究为了探讨MMP-2、TIMP-2在食管鳞癌发生发展之间的关系,检测MMP-2、TIMP-2在食管鳞癌中的表达情况,从而判断MMP-2、TIMP-2是否可能成为食管鳞癌诊断、治疗及预后的理想分子靶标。本研究分析了不同年龄、不同性别、不同分期、不同分化程度及淋巴结转移情况不同的食管鳞癌中MMP-2、TIMP-2的表达情况,旨在探讨MMP-2、TIMP-2与食管鳞癌的上述临床特征之间的相关性,以便较好地了解食管鳞癌从早期向晚期演变过程中MMP-2、TIMP-2的变化情况。免疫组化检测结果表明MMP-2、TIMP-2在浸润程度深、临床分期晚、有淋巴结转移的组织中的表达明显高于浸润程度浅、临床分期早、无淋巴结转移的组织。表明MMP-2、TIMP-2的表达与食管鳞癌的转化过程以及肿瘤细胞的侵袭有关。
本研究中MMP-2与TIMP-2在食管鳞癌浸润超过肌层组、有淋巴结转移组、TNMⅢ+Ⅳ期组的表达均高于浸润未超过肌层组、无淋巴结转移组、TNMⅠ+Ⅱ期组,但相对于MMP-2阳性表达的增高TIMP-2阳性表达增高的幅度较小,从而导致MMP-2、TIMP-2比例失衡,同时也提示MMP-2与TIMP-2表达比例的失衡与食管鳞癌的浸润、转移有关。
[1]孙秀娣,牧人,周有尚,等.中国胃癌死亡率20年变化情况分析及其发展趋势预测[J].中华肿瘤杂志,2004,26(1):429 -435.
[2]Massuoa I,Kotra L P,Fridman R,et al.Matrix metalloproteinase,structures,evolution and diversification[J].FASEBJ,1998,12(12):1075-1095.
[3]Nutt J E,Mellon J K,Qureshi K.Matrix metalloproteinase-1 is induced by epidermal growth factor in human bladder tumor cell lines and is detectable in urine of patients with bladder tumour[J].Cancer Res,1998,78(2):215 -220.
[4]Lenz O,Elliot SJ.Matrix metalloproteinases in real development and disease[J].Am Soc Nephrol,2000,11(3):5742 -5811.
[5]Yamamoto H,Itoh F,Iku S,et al.Expression of matrix metalloproteinases and tissue inhibitors of metalloproteinases in human pancreatic adenocarinomas clinicopathologic and prognostic significance of matrilysin expression[J].Clin Oncol,2001,19(4):1118 -1127.
